Momenti di dipolo
La distribuzione asimmetrica della carica in una sostanza polare come l’HCl produce un momento di dipolo Il prodotto della carica parziale Q sugli atomi legati e la distanza r tra le cariche parziali: µ=Qr, dove Q si misura in coulomb (C) e r in metri (m), abbreviato dalla lettera greca mu (µ). Il momento di dipolo è definito come il prodotto della carica parziale Q sugli atomi legati e la distanza r tra le cariche parziali:
Equazione 8.16
µ = Qr
dove Q si misura in coulomb (C) e r in metri. L’unità per i momenti di dipolo è il debye (D):
Equazione 8.17
1 D = 3,3356 × 10-30 C-m
Quando una molecola con un momento di dipolo è posta in un campo elettrico, tende a orientarsi con il campo elettrico a causa della sua distribuzione asimmetrica della carica (Figura 8.13 “Molecole che possiedono un momento di dipolo si allineano parzialmente con un campo elettrico applicato”).
Figura 8.13 Molecole che possiedono un momento di dipolo si allineano parzialmente con un campo elettrico applicato
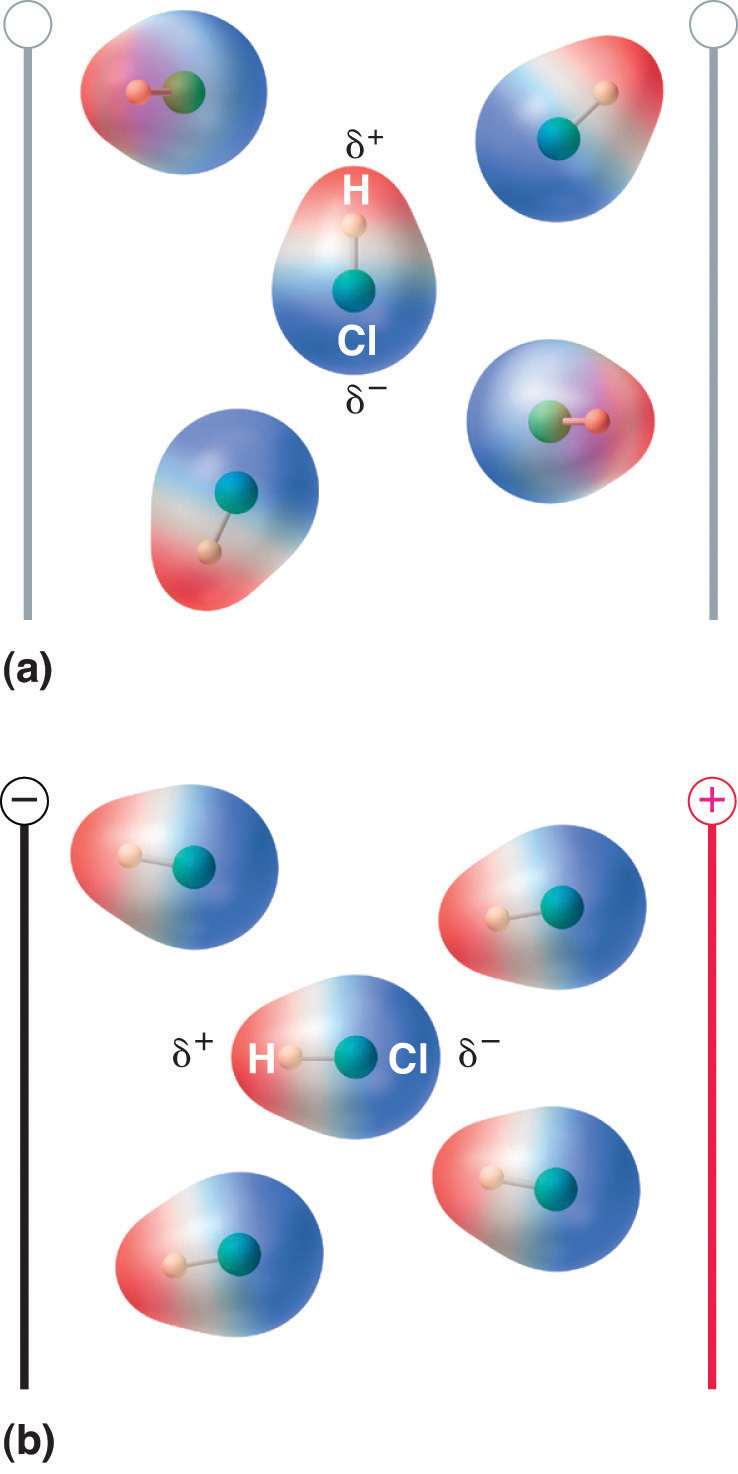
In assenza di un campo (a), le molecole di HCl sono orientate in modo casuale. Quando viene applicato un campo elettrico (b), le molecole tendono ad allinearsi con il campo, in modo che l’estremità positiva del dipolo molecolare punti verso il terminale negativo e viceversa.
Possiamo misurare le cariche parziali sugli atomi in una molecola come l’HCl usando l’equazione 8.16. Se il legame in HCl fosse puramente ionico, un elettrone sarebbe trasferito da H a Cl, quindi ci sarebbe una carica completa +1 sull’atomo H e una carica completa -1 sull’atomo Cl. Il momento di dipolo di HCl è 1,109 D, come determinato misurando l’estensione del suo allineamento in un campo elettrico, e la distanza H-Cl riportata in fase gassosa è 127,5 pm. Quindi la carica su ogni atomo è
Equazione 8.18
Q = μ r = 1,109 D ( 3,3356 × 10 -30 C – m 1 D ) ( 1 127,5 pm ) ( 1 pm 10 -12 m ) = 2,901 × 10 -20 C
Dividendo questo valore calcolato per la carica di un singolo elettrone (1.6022 × 10-19 C), troviamo che la carica sull’atomo di Cl di una molecola di HCl è circa -0,18, corrispondente a circa 0,18 e-:
Equazione 8.19
2,901 × 10 -20 C 1,6022 × 10 -19 C /e – = 0,1811 e –
Per formare un composto neutro, la carica sull’atomo H deve essere uguale ma opposta. Così il momento di dipolo misurato di HCl indica che il legame H-Cl ha circa il 18% di carattere ionico (0,1811 × 100), o l’82% di carattere covalente. Invece di scrivere HCl come Hδ+-Clδ- possiamo quindi indicare la separazione di carica quantitativamente come
H 0 .18 δ + – Cl 0 .18 δ –
I nostri risultati calcolati sono in accordo con la differenza di elettronegatività tra idrogeno e cloro χH = 2,20; χCl = 3,16, χCl – χH = 0,96), un valore ben all’interno dell’intervallo per legami covalenti polari. Indichiamo il momento di dipolo scrivendo una freccia sopra la molecola.Matematicamente, i momenti di dipolo sono vettori, e possiedono sia una grandezza che una direzione. Il momento di dipolo di una molecola è la somma vettoriale dei dipoli dei singoli legami. In HCl, per esempio, il momento di dipolo è indicato come segue:
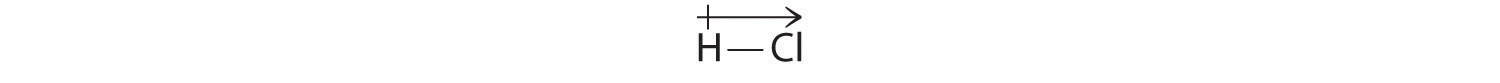
La freccia mostra la direzione del flusso di elettroni puntando verso l’atomo più elettronegativo.
La carica sugli atomi di molte sostanze in fase gassosa può essere calcolata usando momenti di dipolo misurati e distanze di legame. La figura 8.14 “Un grafico del carattere ionico percentuale di un legame come determinato dai momenti di dipolo misurati rispetto alla differenza di elettronegatività degli atomi legati” mostra un grafico del carattere ionico percentuale rispetto alla differenza di elettronegatività degli atomi legati per diverse sostanze. Secondo il grafico, il legame in specie come NaCl(g) e CsF(g) è sostanzialmente meno del 100% di carattere ionico. Quando il gas si condensa in un solido, tuttavia, le interazioni dipolo-dipolo tra le specie polarizzate aumentano le separazioni di carica. Nel cristallo, quindi, un elettrone viene trasferito dal metallo al non metallo, e queste sostanze si comportano come i classici composti ionici. I dati della figura 8.14 “Un grafico del carattere ionico percentuale di un legame come determinato dai momenti di dipolo misurati rispetto alla differenza di elettronegatività degli atomi legati” mostrano che le specie biatomiche con una differenza di elettronegatività inferiore a 1,5 hanno un carattere ionico inferiore al 50%, che è coerente con la nostra precedente descrizione di queste specie come contenenti legami covalenti polari. L’uso dei momenti di dipolo per determinare il carattere ionico di un legame polare è illustrato nell’esempio 11.
Figura 8.14 Un grafico del carattere ionico percentuale di un legame come determinato dai momenti di dipolo misurati rispetto alla differenza di elettronegatività degli atomi legati
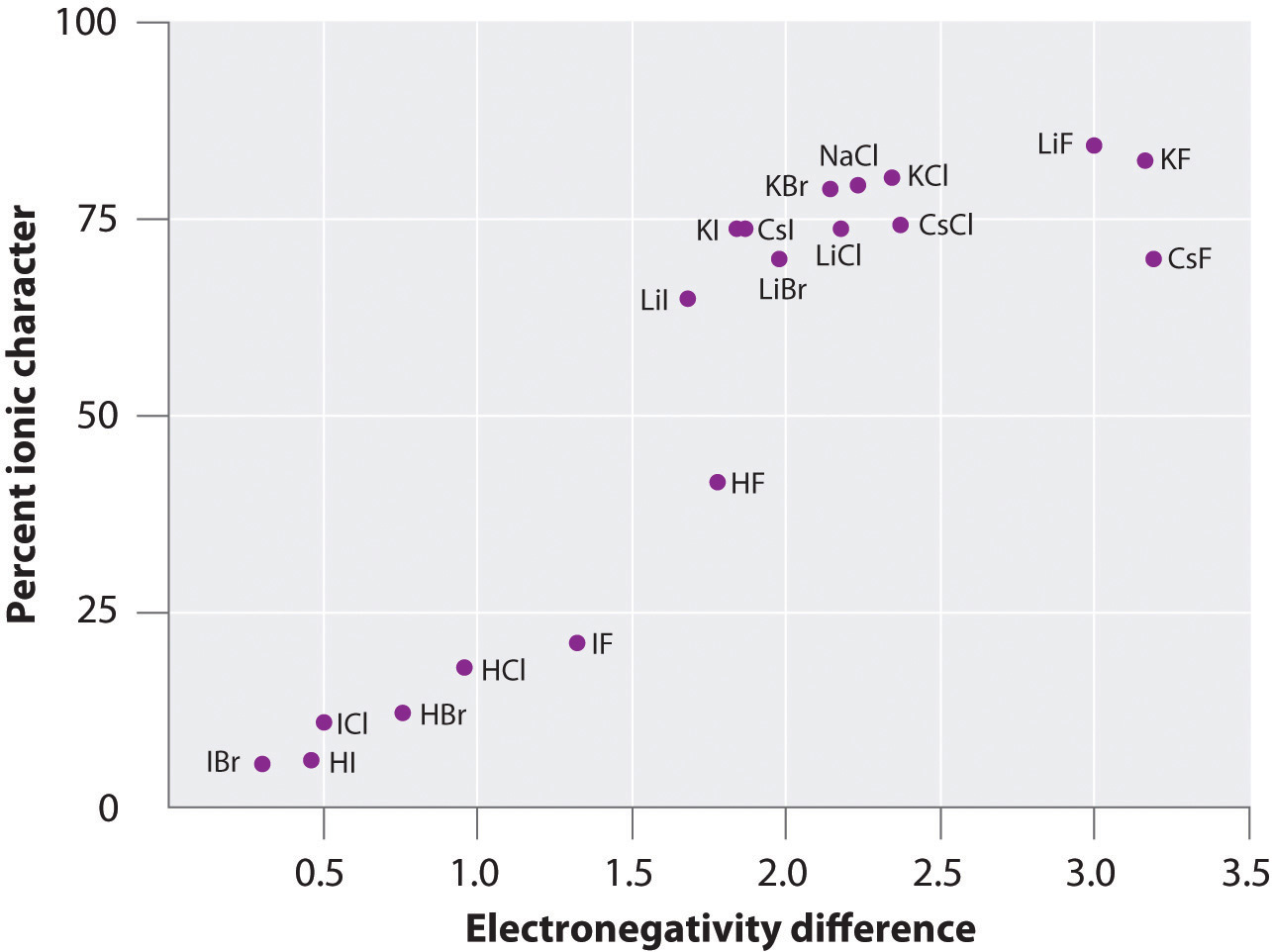
In fase gassosa, anche il CsF, che ha la più grande differenza possibile di elettronegatività tra gli atomi, non è ionico al 100%. Il CsF solido, tuttavia, è meglio visto come ionico al 100% a causa delle interazioni elettrostatiche aggiuntive nel reticolo.
Esempio 11
In fase gassosa, NaCl ha un momento di dipolo di 9,001 D e una distanza Na-Cl di 236,1 pm. Calcola la percentuale di carattere ionico in NaCl.
Dati: specie chimica, momento di dipolo e distanza internucleare
Richiesta: percentuale di carattere ionico
Strategia:
A Calcola la carica su ogni atomo usando le informazioni date e l’equazione 8.16.
B Trova la percentuale di carattere ionico dal rapporto tra la carica effettiva e la carica di un singolo elettrone.
Soluzione:
A La carica su ogni atomo è data da
Q = μ r = 9,001 D ( 3,3356 × 10 -30 C – m 1 D ) ( 1 236,1 pm ) ( 1 pm 10 -12 m ) = 1 . 2 7 2 × 1 0 -19 C
Quindi NaCl si comporta come se avesse cariche di 1,272 × 10-19 C su ogni atomo separate da 236,1 pm.
B Il carattere ionico percentuale è dato dal rapporto tra la carica effettiva e la carica di un singolo elettrone (la carica prevista per il trasferimento completo di un elettrone):
% carattere ionico = ( 1.272 × 10 -19 C 1.6022 × 10 -19 C ) ( 100 ) = 79.39 % ≃ 79 %
Esercizio
In fase gassosa, il cloruro di argento (AgCl) ha un momento di dipolo di 6.08 D e una distanza Ag-Cl di 228.1 pm. Qual è la percentuale di carattere ionico nel cloruro d’argento?
Risposta: 55.5%
Sommario
I composti con legami covalenti polari hanno elettroni che sono condivisi in modo ineguale tra gli atomi legati. La polarità di un tale legame è determinata in gran parte dagli elettronegativiti relativi degli atomi legati. La distribuzione asimmetrica della carica in una sostanza polare produce un momento di dipolo, che è il prodotto delle cariche parziali sugli atomi legati e la distanza tra loro.
Presa di coscienza
- La polarità del legame e il carattere ionico aumentano con l’aumentare della differenza di elettronegatività.
Equazione chiave
Momento di dipolo
Equazione 8.16: µ = Qr
Problemi concettuali
-
Perché i composti ionici come il KI mostrano un carattere sostanzialmente meno che ionico al 100% nella fase gassosa?
-
Tra i composti LiI e LiF, quale ti aspetti che si comporti più come un composto ionico classico? Quale avrebbe il momento di dipolo maggiore nella fase gassosa? Spiega le tue risposte.
Problemi numerici
-
Scrivi se ogni composto è puramente covalente, puramente ionico, o covalente polare.
- RbCl
- S8
- TiCl2
- SbCl3
- LiI
- Br2
-
In base alle elettronegatività relative, classificate il legame in ogni composto come ionico, covalente o covalente polare. Indica la direzione del dipolo di legame per ogni legame covalente polare.
- NO
- HF
- MgO
- AlCl3
- SiO2
- il legame C=O nell’acetone
- O3
-
In base alle elettronegatività relative, classificate il legame in ogni composto come ionico, covalente o covalente polare. Indica la direzione del dipolo di legame per ogni legame covalente polare.
- NaBr
- OF2
- BCl3
- il legame S-S in CH3CH2SSCH2CH3
- il legame C-Cl in CH2Cl2
- il legame O-H in CH3OH
- PtCl42-
-
Classificare ogni specie come avente carattere ionico 0%-40%, 40%-60% carattere ionico, o 60%-100% carattere ionico basato sul tipo di legame che ti aspetteresti. Giustifica il tuo ragionamento.
- CaO
- S8
- AlBr3
- ICl
- Na2S
- SiO2
- LiBr
-
Se la distanza di legame in HCl (momento di dipolo = 1.109 D) fosse il doppio del valore reale di 127,46 pm, quale sarebbe l’effetto sulla carica localizzata su ogni atomo? Quale sarebbe la percentuale di carica negativa su Cl? Alla distanza di legame attuale, come influirebbe sul momento di dipolo il raddoppio della carica su ogni atomo? Questo rappresenterebbe un carattere più ionico o covalente?
-
Calcolate la percentuale di carattere ionico di HF (momento di dipolo = 1.826 D) se la distanza del legame H-F è 92 pm.
-
Calcolare il carattere ionico percentuale di CO (momento di dipolo = 0.110 D) se la distanza C-O è 113 pm.
-
Calcolare il carattere ionico percentuale di PbS e PbO in fase gassosa, date le seguenti informazioni: per PbS, r = 228,69 pm e µ = 3.59 D; per PbO, r = 192,18 pm e µ = 4,64 D. Classificheresti questi composti come aventi legami covalenti o covalenti polari allo stato solido?