Momente dipolare
Distribuția asimetrică a sarcinilor într-o substanță polară, cum ar fi HCl, produce un moment dipolarProdusul dintre sarcina parțială Q de pe atomii legați și distanța r dintre sarcinile parțiale: µ=Qr, unde Q se măsoară în coulombi (C) și r în metri (m), prescurtat cu litera greacă mu (µ). Momentul dipolar este definit ca fiind produsul dintre sarcina parțială Q de pe atomii legați și distanța r dintre sarcinile parțiale:
Equația 8.16
µ = Qr
unde Q se măsoară în coulombi (C) și r în metri. Unitatea pentru momentele dipolare este debye (D):
Ecuația 8.17
1 D = 3,3356 × 10-30 C-m
Când o moleculă cu moment dipolar este plasată într-un câmp electric, aceasta tinde să se orienteze cu câmpul electric din cauza distribuției asimetrice a sarcinii sale (figura 8.13 „Moleculele care posedă un moment de dipol se aliniază parțial cu un câmp electric aplicat”).
Figura 8.13 Moleculele care posedă un moment de dipol se aliniază parțial cu un câmp electric aplicat
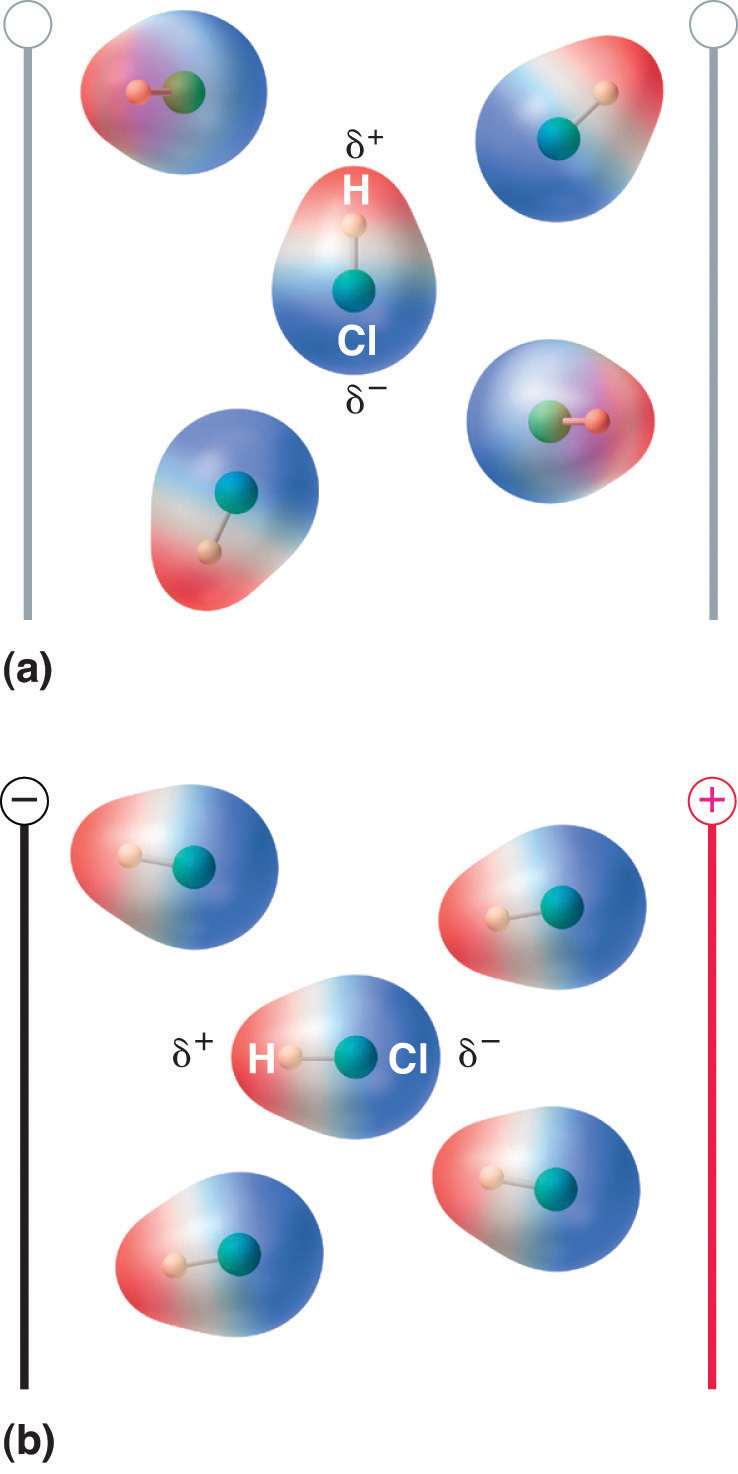
În absența unui câmp (a), moleculele de HCl sunt orientate aleatoriu. Atunci când se aplică un câmp electric (b), moleculele tind să se alinieze cu câmpul, astfel încât capătul pozitiv al dipolului molecular să se îndrepte spre terminalul negativ și invers.
Potem măsura sarcinile parțiale de pe atomii dintr-o moleculă precum HCl folosind ecuația 8.16. Dacă legătura din HCl ar fi pur ionică, un electron ar fi transferat de la H la Cl, astfel încât ar exista o sarcină completă +1 pe atomul de H și o sarcină completă -1 pe atomul de Cl. Momentul de dipol al HCl este de 1,109 D, determinat prin măsurarea gradului de aliniere a acestuia într-un câmp electric, iar distanța H-Cl în fază gazoasă raportată este de 127,5 pm. Prin urmare, sarcina pe fiecare atom este
Ecuația 8.18
Q = μ r = 1,109 D ( 3,3356 × 10 -30 C – m 1 D ) ( 1 127,5 pm ) ( 1 pm 10 -12 m ) = 2,901 × 10 -20 C
Prin împărțirea acestei valori calculate la sarcina pe un singur electron (1.6022 × 10-19 C), aflăm că sarcina pe atomul de Cl al unei molecule de HCl este de aproximativ -0,18, ceea ce corespunde la aproximativ 0,18 e-:
Equația 8.19
2,901 × 10 -20 C 1,6022 × 10 -19 C /e – = 0,1811 e –
Pentru a forma un compus neutru, sarcina pe atomul de H trebuie să fie egală, dar opusă. Astfel, momentul de dipol măsurat al HCl indică faptul că legătura H-Cl are aproximativ 18% caracter ionic (0,1811 × 100), sau 82% caracter covalent. În loc să scriem HCl ca Hδ+-Clδ- putem, prin urmare, să indicăm cantitativ separarea sarcinilor ca
H 0 ,18 δ + – Cl 0 ,18 δ –
Rezultatele noastre calculate sunt în concordanță cu diferența de electronegativitate dintre hidrogen și clor χH = 2,20; χCl = 3,16, χCl – χH = 0,96), o valoare care se încadrează bine în intervalul pentru legăturile covalente polare. Indicăm momentul dipolar prin scrierea unei săgeți deasupra moleculei. în mod matematic, momentele dipolare sunt vectori și posedă atât o mărime, cât și o direcție. Momentul dipolar al unei molecule este suma vectorială a dipolilor legăturilor individuale. În HCl, de exemplu, momentul de dipol este indicat după cum urmează:
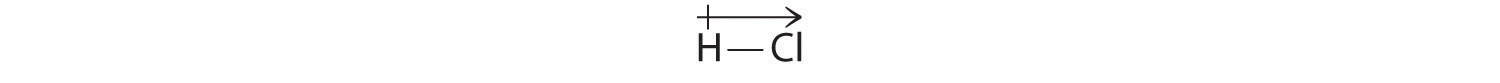
Săgeata arată direcția fluxului de electroni arătând spre atomul mai electronegativ.
Carga pe atomii multor substanțe din faza gazoasă poate fi calculată folosind momentele de dipol măsurate și distanțele legăturilor. Figura 8.14 „Reprezentarea grafică a procentului de caracter ionic al unei legături, determinat pe baza momentelor de dipol măsurate, în funcție de diferența de electronegativitate a atomilor legați” prezintă o reprezentare grafică a procentului de caracter ionic în funcție de diferența de electronegativitate a atomilor legați pentru mai multe substanțe. Conform graficului, legăturile din specii precum NaCl(g) și CsF(g) au un caracter ionic substanțial mai mic de 100%. Cu toate acestea, pe măsură ce gazul se condensează într-un solid, interacțiunile dipol-dipolare între speciile polarizate cresc separările de sarcină. În cristal, prin urmare, un electron este transferat de la metal la nemetal, iar aceste substanțe se comportă ca niște compuși ionici clasici. Datele din figura 8.14 „A Plot of the Percent Ionic Character of a Bond as Determined from Measured Dipole Moments versus the Difference in Electronegativity of the Bonded Atoms” arată că speciile diatomice cu o diferență de electronegativitate mai mică de 1,5 au un caracter ionic mai mic de 50%, ceea ce este în concordanță cu descrierea noastră anterioară a acestor specii ca conținând legături covalente polare. Utilizarea momentelor de dipol pentru a determina caracterul ionic al unei legături polare este ilustrată în Exemplul 11.
Figura 8.14 Un grafic al caracterului ionic procentual al unei legături determinat pe baza momentelor de dipol măsurate în funcție de diferența de electronegativitate a atomilor legați
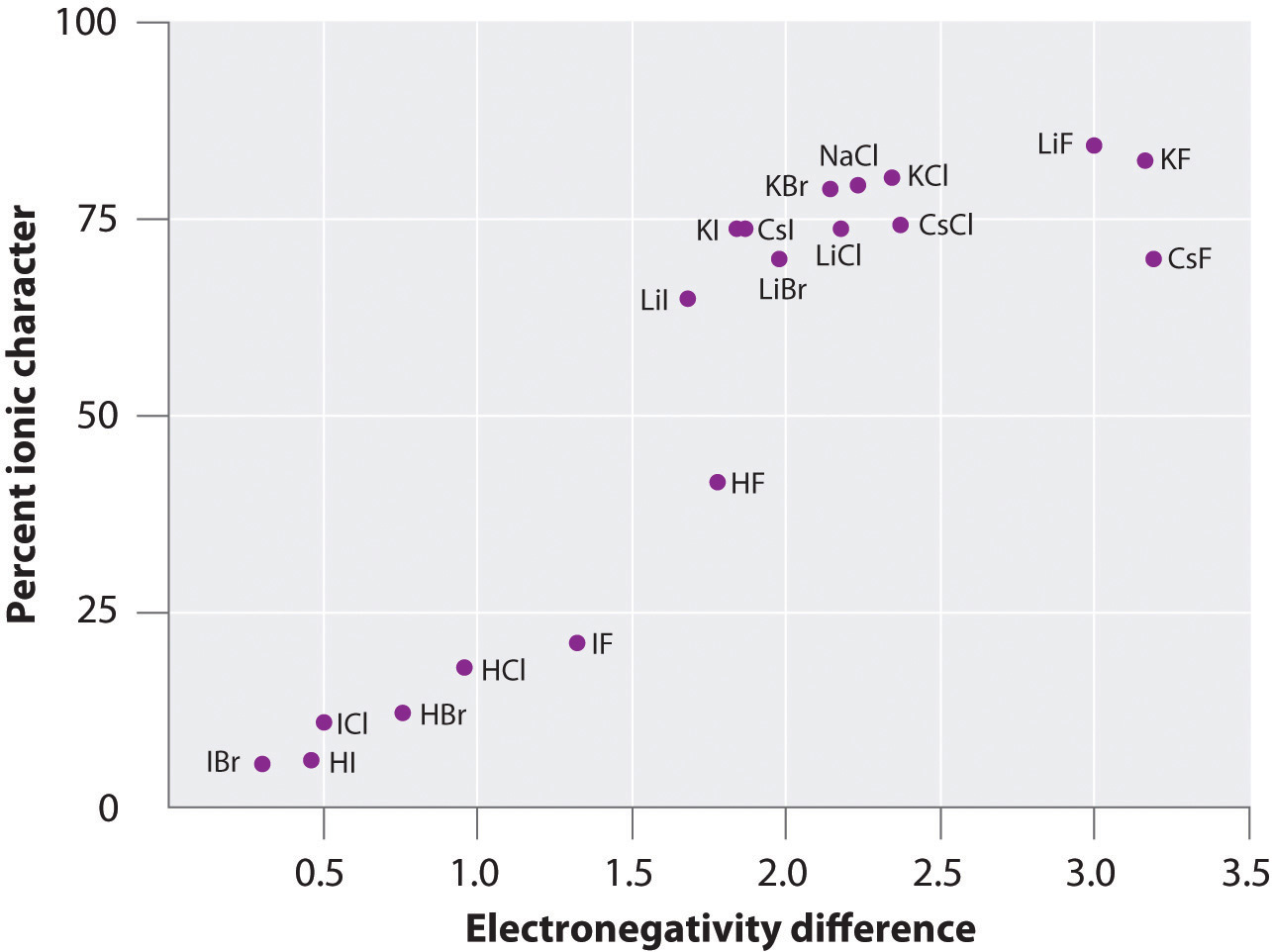
În faza gazoasă, chiar și CsF, care are cea mai mare diferență posibilă de electronegativitate între atomi, nu este 100% ionic. Cu toate acestea, CsF în stare solidă este cel mai bine privit ca fiind 100% ionic din cauza interacțiunilor electrostatice suplimentare din rețea.
Exemplul 11
În faza gazoasă, NaCl are un moment de dipol de 9,001 D și o distanță Na-Cl de 236,1 pm. Calculați procentul de caracter ionic în NaCl.
Date: specia chimică, momentul dipolar și distanța internucleară
Întrebare: procentul de caracter ionic
Strategie:
A Calculați sarcina fiecărui atom folosind informațiile date și ecuația 8.16.
B Găsiți procentul de caracter ionic din raportul dintre sarcina reală și sarcina unui singur electron.
Soluție:
A Sarcina pe fiecare atom este dată de
Q = μ r = 9,001 D ( 3,3356 × 10 -30 C – m 1 D ) ( 1 236,1 pm ) ( 1 pm 10 -12 m ) = 1 . 2 7 2 × 1 0 -19 C
Atunci NaCl se comportă ca și cum ar avea sarcini de 1,272 × 10-19 C pe fiecare atom separat de 236,1 pm.
B Caracterul ionic procentual este dat de raportul dintre sarcina reală și sarcina unui singur electron (sarcina așteptată pentru transferul complet al unui electron):
% caracter ionic = ( 1.272 × 10 -19 C 1,6022 × 10 -19 C ) ( 100 ) = 79,39 % ≃ 79 %
Exercițiu
În fază gazoasă, clorura de argint (AgCl) are un moment de dipol de 6,08 D și o distanță Ag-Cl de 228,1 pm. Care este procentul de caracter ionic în clorura de argint?
Răspuns: 55,5%
Rezumat
Compușii cu legături covalente polare au electroni care sunt împărțiți în mod inegal între atomii legați. Polaritatea unei astfel de legături este determinată în mare măsură de electronegativitățile relative ale atomilor legați. Distribuția asimetrică a sarcinilor într-o substanță polară produce un moment dipolar, care este produsul dintre sarcinile parțiale de pe atomii legați și distanța dintre aceștia.
Ecuția cheie
- Polaritatea legăturii și caracterul ionic cresc odată cu creșterea diferenței de electronegativitate.
Ecuția cheie
Momentul dipolar
Ecuția 8.16: µ = Qr
Probleme conceptuale
-
De ce compușii ionici, cum ar fi KI, prezintă un caracter ionic substanțial mai puțin de 100% în faza gazoasă?
-
Dintre compușii LiI și LiF, la care v-ați aștepta să se comporte mai mult ca un compus ionic clasic? Care dintre ei ar avea momentul dipolar mai mare în faza gazoasă? Explicați-vă răspunsurile.
Probleme numerice
-
Precizați dacă fiecare compus este pur covalent, pur ionic sau covalent polar.
- RbCl
- S8
- TiCl2
- SbCl3
- LiI
- Br2
-
Pe baza electronegativităților relative, clasificați legăturile din fiecare compus ca fiind ionice, covalente sau covalente polare. Indicați direcția dipolului de legătură pentru fiecare legătură covalentă polară.
- NO
- HF
- MgO
- AlCl3
- SiO2
- legatura C=O în acetonă
- O3
-
Bazat pe electronegativitățile relative, clasificați legăturile din fiecare compus ca fiind ionice, covalente sau covalente polare. Indicați direcția dipolului de legătură pentru fiecare legătură covalentă polară.
- NaBr
- OF2
- BCl3
- legătura S-S în CH3CH2SSCH2CH3
- legătura C-Cl în CH2Cl2
- legătura O-H în CH3OH
- PtCl42-
.
-
Clasificați fiecare specie ca având un caracter ionic 0%-40%, 40%-60% caracter ionic, sau 60%-100% caracter ionic pe baza tipului de legătură la care v-ați aștepta. Justificați raționamentul dumneavoastră.
- CaO
- S8
- AlBr3
- ICl
- Na2S
- SiO2
- LiBr
-
Dacă distanța de legătură în HCl (moment de dipol = 1.109 D) ar fi dublă față de valoarea reală de 127,46 pm, care ar fi efectul asupra sarcinii localizate pe fiecare atom? Care ar fi procentul de sarcină negativă pe Cl? La distanța reală a legăturii, cum ar afecta momentul dipolar dublarea sarcinii pe fiecare atom? Ar reprezenta aceasta mai mult caracter ionic sau covalent?
-
Calculați procentul de caracter ionic al HF (moment de dipol = 1.826 D) dacă distanța legăturii H-F este de 92 pm.
-
Calculați caracterul ionic procentual al CO (moment de dipol = 0,110 D) dacă distanța C-O este de 113 pm.
-
Calculați caracterul ionic procentual al PbS și PbO în fază gazoasă, având în vedere următoarele informații: pentru PbS, r = 228,69 pm și µ = 3.59 D; pentru PbO, r = 192,18 pm și µ = 4,64 D. Ați clasifica acești compuși ca având legături covalente sau covalente polare în stare solidă?