Dipoolmomenten
De asymmetrische ladingsverdeling in een polaire stof zoals HCl veroorzaakt een dipoolmomentHet product van de partiële lading Q op de gebonden atomen en de afstand r tussen de partiële ladingen: µ=Qr, waarbij Q wordt gemeten in coulomb (C) en r in meter (m)., afgekort met de Griekse letter mu (µ). Het dipoolmoment is gedefinieerd als het product van de partiële lading Q op de gebonden atomen en de afstand r tussen de partiële ladingen:
Vergelijking 8.16
µ = Qr
waarbij Q wordt gemeten in coulomb (C) en r in meter. De eenheid voor dipoolmomenten is de debye (D):
Vergelijking 8.17
1 D = 3,3356 × 10-30 C-m
Wanneer een molecuul met een dipoolmoment in een elektrisch veld wordt geplaatst, heeft het de neiging zich met het elektrische veld mee te oriënteren vanwege zijn asymmetrische ladingsverdeling (figuur 8.13 “Molecules That Possess a Dipole Moment Partially Align Themself with an Applied Electric Field”).
Figuur 8.13 Molecules That Possess a Dipole Moment Partially Align Themself with an Applied Electric Field
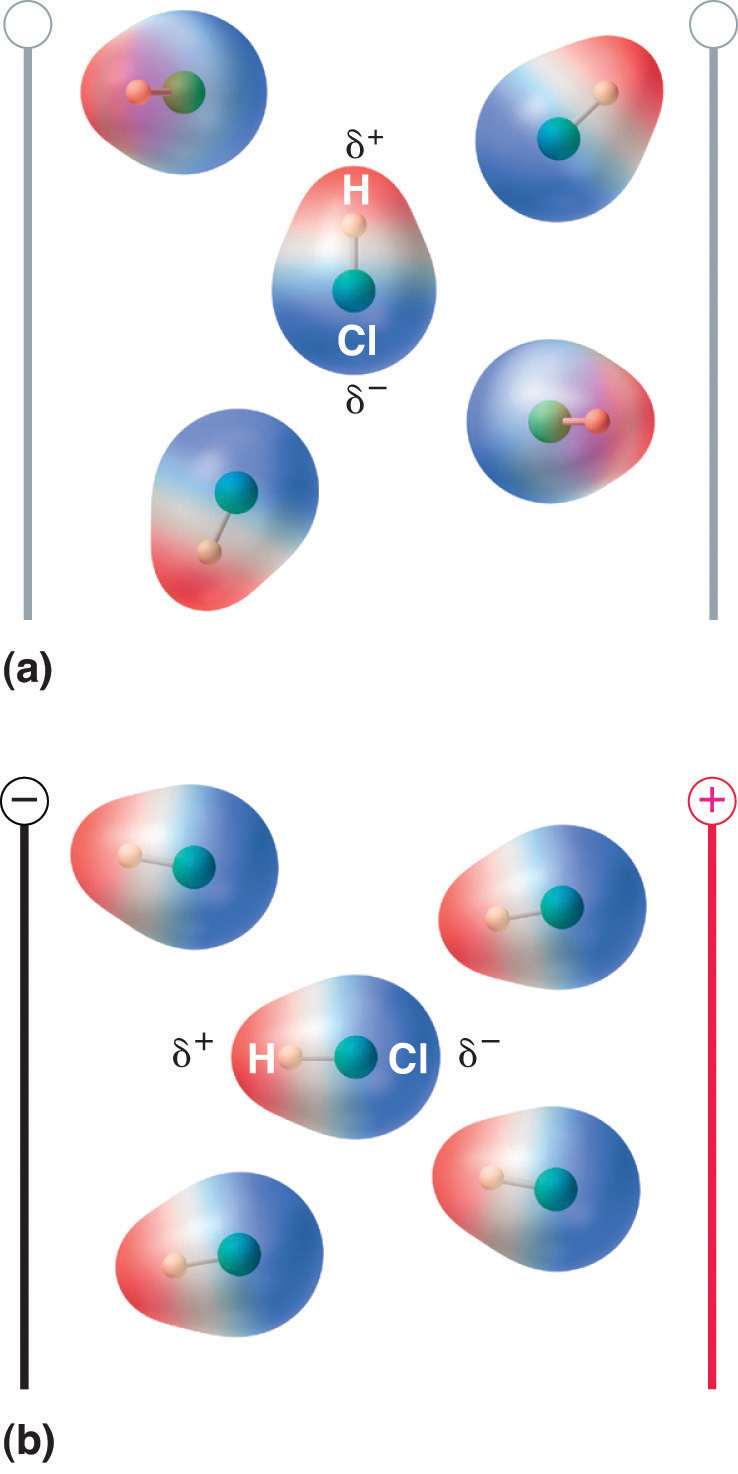
In de afwezigheid van een veld (a) zijn de HCl-moleculen willekeurig georiënteerd. Wanneer een elektrisch veld wordt aangelegd (b), hebben de moleculen de neiging zich uit te lijnen met het veld, zodanig dat het positieve uiteinde van de moleculaire dipool naar het negatieve uiteinde wijst en omgekeerd.
We kunnen de partiële ladingen op de atomen in een molecuul zoals HCl meten met behulp van vergelijking 8.16. Als de binding in HCl zuiver ionisch zou zijn, zou een elektron worden overgedragen van H naar Cl, zodat er een volledige +1 lading op het H-atoom zou zijn en een volledige -1 lading op het Cl-atoom. Het dipoolmoment van HCl is 1,109 D, zoals bepaald door het meten van de mate van uitlijning in een elektrisch veld, en de gerapporteerde gasfase H-Cl afstand is 127,5 pm. De lading op elk atoom is dus
Vergelijking 8.18
Q = μ r = 1.109 D ( 3.3356 × 10 -30 C – m 1 D ) ( 1 127.5 pm ) ( 1 pm 10 -12 m ) = 2.901 × 10 -20 C
Door deze berekende waarde te delen door de lading op een enkel elektron (1.6022 × 10-19 C), vinden we dat de lading op het Cl-atoom van een HCl-molecuul ongeveer -0,18 is, wat overeenkomt met ongeveer 0,18 e-:
Vergelijking 8.19
2,901 × 10 -20 C 1,6022 × 10 -19 C /e – = 0,1811 e –
Om een neutrale verbinding te vormen, moet de lading op het H-atoom gelijk maar tegengesteld zijn. Het gemeten dipoolmoment van HCl geeft dus aan dat de H-Cl binding ongeveer 18% ionisch karakter heeft (0.1811 × 100), of 82% covalent karakter. In plaats van HCl te schrijven als Hδ+-Clδ- kunnen we de ladingsscheiding dus kwantitatief aangeven als
H 0 .18 δ + – Cl 0 .18 δ –
Onze berekende resultaten zijn in overeenstemming met het elektronegativiteitsverschil tussen waterstof en chloor χH = 2.20; χCl = 3.16, χCl – χH = 0.96), een waarde die ruim binnen het bereik voor polaire covalente bindingen ligt. We geven het dipoolmoment aan door een pijl boven het molecuul te schrijven.Wiskundig gezien zijn dipoolmomenten vectoren, en ze bezitten zowel een magnitude als een richting. Het dipoolmoment van een molecuul is de vectorsom van de dipolen van de afzonderlijke bindingen. In HCl bijvoorbeeld wordt het dipoolmoment als volgt aangegeven:
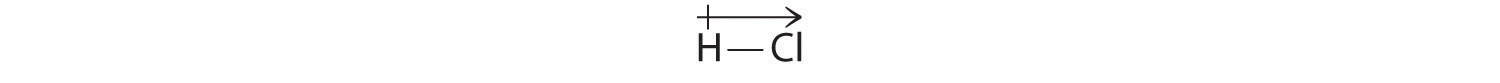
De pijl geeft de richting van de elektronenstroom aan door naar het meer elektronegatieve atoom te wijzen.
De lading op de atomen van veel stoffen in de gasfase kan worden berekend met behulp van gemeten dipoolmomenten en bindingsafstanden. Figuur 8.14 “A Plot of the Percent Ionic Character of a Bond as Determined from Measured Dipole Moments versus the Difference in Electronegativity of the Bonded Atoms” toont een grafiek van het procentuele ionische karakter versus het verschil in electronegativiteit van de gebonden atomen voor verschillende stoffen. Volgens de grafiek is de binding in soorten als NaCl(g) en CsF(g) substantieel minder dan 100% ionisch van karakter. Wanneer het gas echter condenseert tot een vaste stof, vergroten dipool-dipool interacties tussen gepolariseerde soorten de ladingsscheidingen. In het kristal wordt daarom een elektron overgedragen van het metaal naar het niet-metaal, en deze stoffen gedragen zich als klassieke ionische verbindingen. De gegevens in figuur 8.14 “A Plot of the Percent Ionic Character of a Bond as Determined from Measured Dipole Moments versus the Difference in Electronegativity of the Bonded Atoms” laten zien dat diatomeeënsoorten met een electronegativiteitsverschil van minder dan 1,5 voor minder dan 50% ionisch van karakter zijn, hetgeen consistent is met onze eerdere beschrijving van deze soorten als bevattende polaire covalente bindingen. Het gebruik van dipoolmomenten om het ionisch karakter van een polaire binding te bepalen wordt geïllustreerd in Voorbeeld 11.
Figuur 8.14 Een plot van het procentueel ionisch karakter van een binding zoals bepaald uit gemeten dipoolmomenten versus het verschil in elektronegativiteit van de gebonden atomen
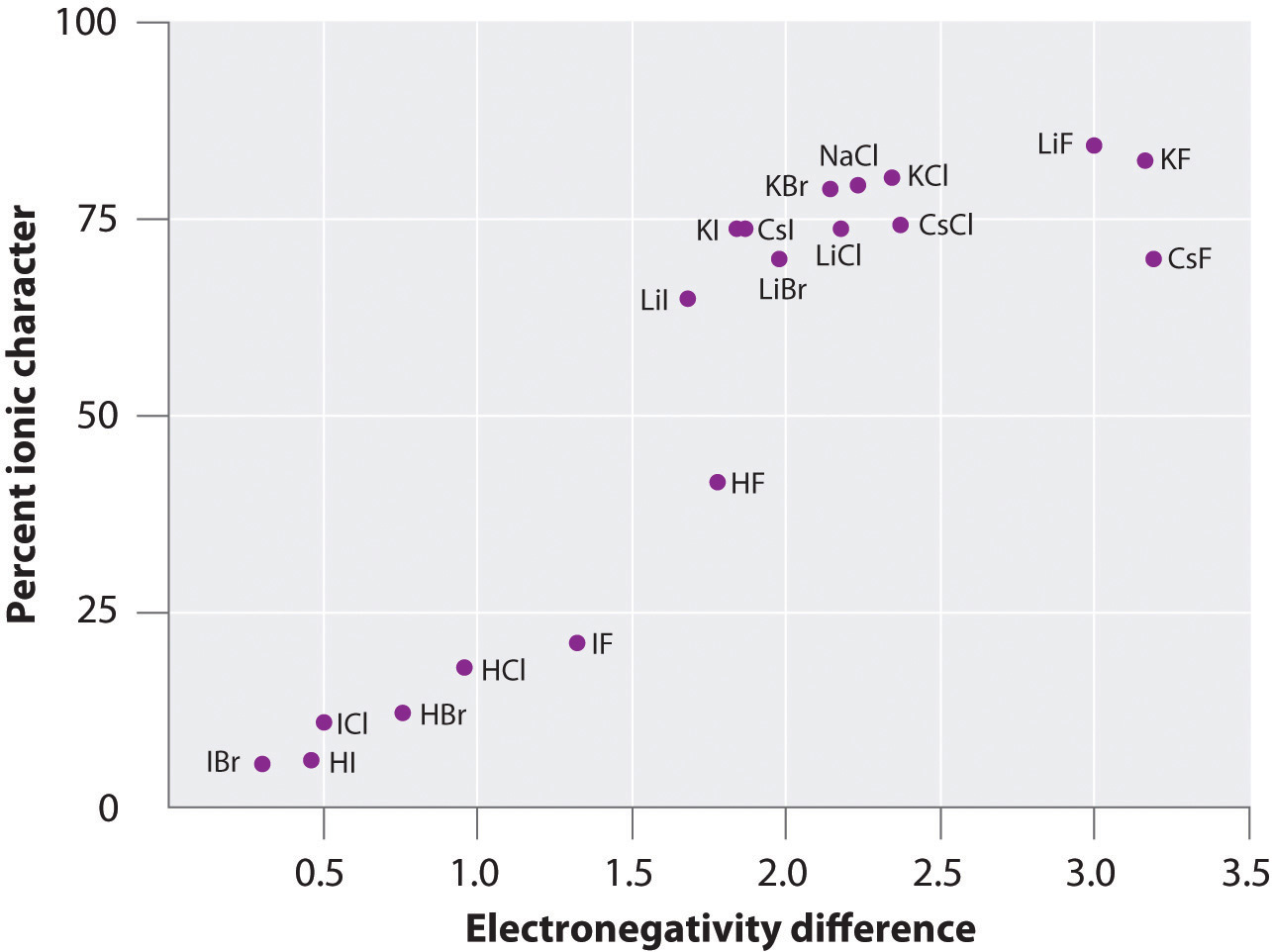
In de gasfase is zelfs CsF, dat het grootst mogelijke verschil in elektronegativiteit tussen de atomen heeft, niet 100% ionisch. Vast CsF kan echter het best als 100% ionisch worden beschouwd vanwege de extra elektrostatische interacties in het rooster.
Voorbeeld 11
In de gasfase heeft NaCl een dipoolmoment van 9,001 D en een Na-Cl afstand van 236,1 pm. Bereken het procent ionisch karakter in NaCl.
Gegeven: chemische species, dipoolmoment, en internucleaire afstand
Vraag: procent ionisch karakter
Strategie:
A Bereken de lading op elk atoom met behulp van de gegeven informatie en vergelijking 8.16.
B Vind het procent ionisch karakter uit de verhouding van de werkelijke lading tot de lading van een enkel elektron.
Oplossing:
A De lading op elk atoom wordt gegeven door
Q = μ r = 9,001 D ( 3,3356 × 10 -30 C – m 1 D ) ( 1 236,1 pm ) ( 1 pm 10 -12 m ) = 1 . 2 7 2 × 1 0 -19 C
Dus NaCl gedraagt zich alsof het ladingen van 1,272 × 10-19 C op elk atoom heeft, gescheiden door 236,1 pm.
B Het procentuele ionische karakter wordt gegeven door de verhouding van de werkelijke lading tot de lading van een enkel elektron (de lading die verwacht wordt voor de volledige overdracht van één elektron):
% ionisch karakter = ( 1.272 × 10 -19 C 1,6022 × 10 -19 C ) ( 100 ) = 79,39 % ≃ 79 %
Oefening
In de gasfase heeft zilverchloride (AgCl) een dipoolmoment van 6,08 D en een Ag-Cl afstand van 228,1 pm. Wat is het procent ionisch karakter in zilverchloride?
Antwoord: 55,5%
Samenvatting
Verbindingen met polaire covalente bindingen hebben elektronen die ongelijk verdeeld zijn over de gebonden atomen. De polariteit van zo’n binding wordt grotendeels bepaald door de relatieve elektronegativieten van de gebonden atomen. De asymmetrische ladingsverdeling in een polaire stof veroorzaakt een dipoolmoment, dat het product is van de partiële ladingen op de gebonden atomen en de afstand tussen hen.
Key Takeaway
- Bondspolariteit en ionisch karakter nemen toe met een toenemend verschil in elektronegativiteit.
Key Equation
Dipoolmoment
Equation 8.16: µ = Qr
Conceptuele problemen
-
Waarom vertonen ionische verbindingen zoals KI in de gasfase een aanzienlijk minder dan 100% ionisch karakter?
-
Van de verbindingen LiI en LiF, van welke zou je verwachten dat ze zich meer als een klassieke ionische verbinding zouden gedragen? Welke zou in de gasfase het grootste dipoolmoment hebben? Leg uw antwoorden uit.
Numerieke Problemen
-
Vel van elke verbinding in of deze zuiver covalent, zuiver ionisch, of polair covalent is.
- RbCl
- S8
- TiCl2
- SbCl3
- LiI
- Br2
-
Gebaseerd op relatieve elektronegativiteiten, classificeer de binding in elke verbinding als ionisch, covalent, of polair covalent. Geef de richting van de bindingsdipool aan voor elke polaire covalente binding.
- NO
- HF
- MgO
- AlCl3
- SiO2
- de C=O binding in aceton
- O3
-
Gebaseerd op relatieve elektronegativiteiten, classificeer de binding in elke verbinding als ionisch, covalent, of polair covalent. Geef de richting van de bindingsdipool aan voor elke polaire covalente binding.
- NaBr
- OF2
- BCl3
- de S-S binding in CH3CH2SSCH2CH3
- de C-Cl binding in CH2Cl2
- de O-H binding in CH3OH
- PtCl42-
-
Deel elke soort in als hebbend 0%-40% ionisch karakter, 40%-60% ionisch karakter, of 60%-100% ionisch karakter op basis van het type binding dat je zou verwachten. Motiveer uw redenering.
- CaO
- S8
- AlBr3
- ICl
- Na2S
- SiO2
- LiBr
-
Als de bindingsafstand in HCl (dipoolmoment = 1.109 D) twee keer zo groot zou zijn als de werkelijke waarde van 127,46 pm, wat zou dan het effect zijn op de lading die op elk atoom is gelokaliseerd? Wat zou het percentage negatieve lading op Cl zijn? Hoe zou bij de werkelijke bindingsafstand een verdubbeling van de lading op elk atoom het dipoolmoment beïnvloeden? Zou dit meer ionisch of covalent karakter opleveren?
-
Bereken het procent ionisch karakter van HF (dipoolmoment = 1.826 D) als de H-F bindingsafstand 92 pm is.
-
Bereken het procent ionisch karakter van CO (dipoolmoment = 0.110 D) als de C-O afstand 113 pm is.
-
Bereken het procent ionisch karakter van PbS en PbO in de gasfase, gegeven de volgende informatie: voor PbS, r = 228.69 pm en µ = 3.59 D; voor PbO, r = 192.18 pm en µ = 4.64 D. Zou u deze verbindingen classificeren als verbindingen met covalente of polaire covalente bindingen in de vaste toestand?