Dipole Moments
A distribuição assimétrica da carga numa substância polar como o HCl produz um momento dipoloO produto da carga parcial Q nos átomos colados e a distância r entre as cargas parciais: µ=Qr, onde Q é medido em coulombs (C) e r em metros (m), abreviado pela letra grega mu (µ). O momento dipolo é definido como o produto da carga parcial Q nos átomos colados e a distância r entre as cargas parciais:
Equação 8,16
µ = Qr
onde Q é medido em coulombs (C) e r em metros. A unidade para momentos dipolo é o debye (D):
Equação 8,17
1 D = 3,3356 × 10-30 C-m
Quando uma molécula com um momento dipolo é colocada num campo eléctrico, tende a orientar-se com o campo eléctrico devido à sua distribuição assimétrica de carga (Figura 8.13 “Moléculas que Possuem um Momento Dipolar se Alinham Parcialmente com um Campo Elétrico Aplicado”).
Figure 8.13 Moléculas que Possuem um Momento Dipolar se Alinham Parcialmente com um Campo Elétrico Aplicado
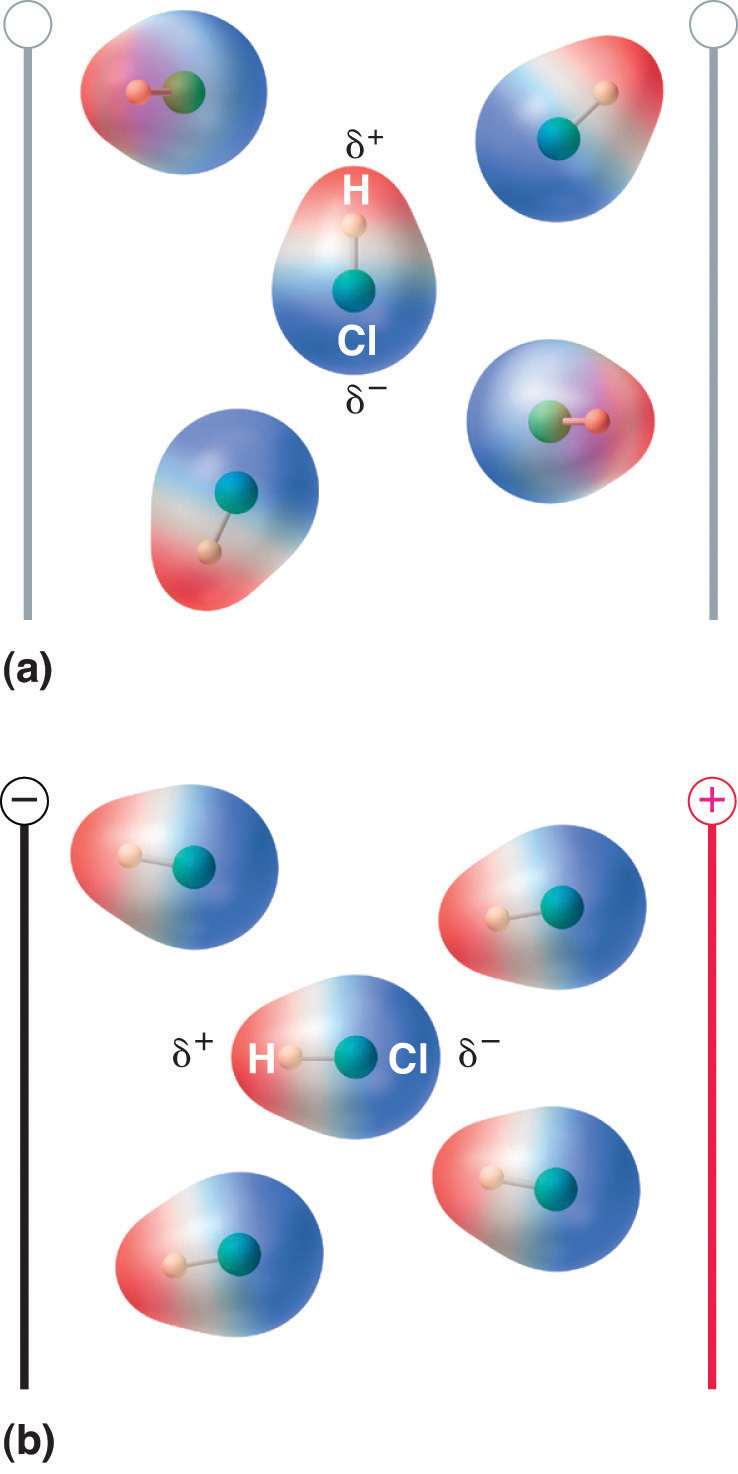
Na ausência de um campo (a), as moléculas do HCl são orientadas aleatoriamente. Quando um campo elétrico é aplicado (b), as moléculas tendem a se alinhar com o campo, de tal forma que a extremidade positiva do dipolo molecular aponta para o terminal negativo e vice-versa.
Podemos medir as cargas parciais sobre os átomos em uma molécula como o HCl usando a Equação 8.16. Se a ligação em HCl fosse puramente iônica, um elétron seria transferido de H para Cl, então haveria uma carga completa +1 no átomo H e uma carga completa -1 no átomo Cl. O momento dipolo do HCl é 1,109 D, como determinado pela medição da extensão de seu alinhamento em um campo elétrico, e a distância relatada da fase de gás H-Cl é 127,5 pm. Assim a carga em cada átomo é
Equação 8,18
Q = μ r = 1,109 D ( 3,3356 × 10 -30 C – m 1 D ) ( 1 127,5 pm ) ( 1 pm 10 -12 m ) = 2,901 × 10 -20 C
Dividindo este valor calculado pela carga sobre um único elétron (1.6022 × 10-19 C), verificamos que a carga sobre o átomo de Cl de uma molécula de HCl é cerca de -0,18, correspondendo a cerca de 0,18 e-:
Equação 8,19
2,901 × 10 -20 C 1,6022 × 10 -19 C /e – = 0,1811 e -4681>
Para formar um composto neutro, a carga sobre o átomo H deve ser igual, mas oposta. Assim, o momento dipolo medido do HCl indica que a ligação H-Cl tem aproximadamente 18% de caráter iônico (0,1811 × 100), ou 82% de caráter covalente. Ao invés de escrevermos HCl como Hδ+-Clδ- podemos então indicar quantitativamente a separação de carga como
H 0 .18 δ + – Cl 0 .18 δ –
Nossos resultados calculados estão de acordo com a diferença de eletronegatividade entre hidrogênio e cloro χH = 2,20; χCl = 3,16, χCl – χH = 0,96), um valor bem dentro da faixa para ligações polares covalentes. Matematicamente, os momentos dipolo são vetores e possuem tanto uma magnitude quanto uma direção. O momento dipolo de uma molécula é a soma vectorial dos dipolos das ligações individuais. Em HCl, por exemplo, o momento dipolo é indicado da seguinte forma:
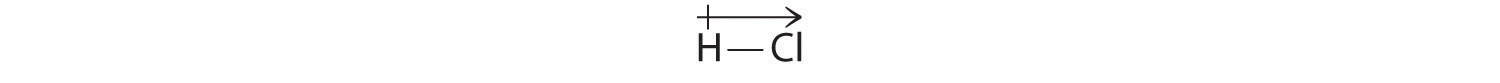
A seta mostra a direcção do fluxo de electrões apontando para o átomo mais electronegativo.
A carga sobre os átomos de muitas substâncias na fase gasosa pode ser calculada utilizando os momentos dipolo medidos e as distâncias de ligação. Figura 8.14 “Um gráfico da percentagem de carácter iónico de uma ligação, determinada a partir dos momentos dipolo medidos versus a diferença de electronegatividade dos átomos ligados” mostra um gráfico da percentagem de carácter iónico versus a diferença de electronegatividade dos átomos ligados para várias substâncias. De acordo com o gráfico, a ligação em espécies como NaCl(g) e CsF(g) é substancialmente inferior a 100% de carácter iónico. Como o gás se condensa num sólido, no entanto, as interacções dipolo-dipolo entre espécies polarizadas aumentam as separações de carga. No cristal, portanto, um elétron é transferido do metal para o não-metal e estas substâncias se comportam como compostos iônicos clássicos. Os dados da Figura 8.14 “A Plot of the Percent Ionic Character of a Bond as Determined from Measured Dipole Moments versus the Difference in Electronegativity of the Bonded Atoms” mostram que as espécies diatómicas com uma diferença de electronegatividade inferior a 1,5 são menos de 50% de carácter iónico, o que é consistente com a nossa anterior descrição destas espécies como contendo ligações polar covalentes. O uso de momentos dipolo para determinar o carácter iónico de uma ligação polar é ilustrado no Exemplo 11.
Figure 8.14 A Plot of the Percent Ionic Character of a Bond as Determined from Measured Dipole Moments versus the Difference in Electronegativity of the Bonded Atoms
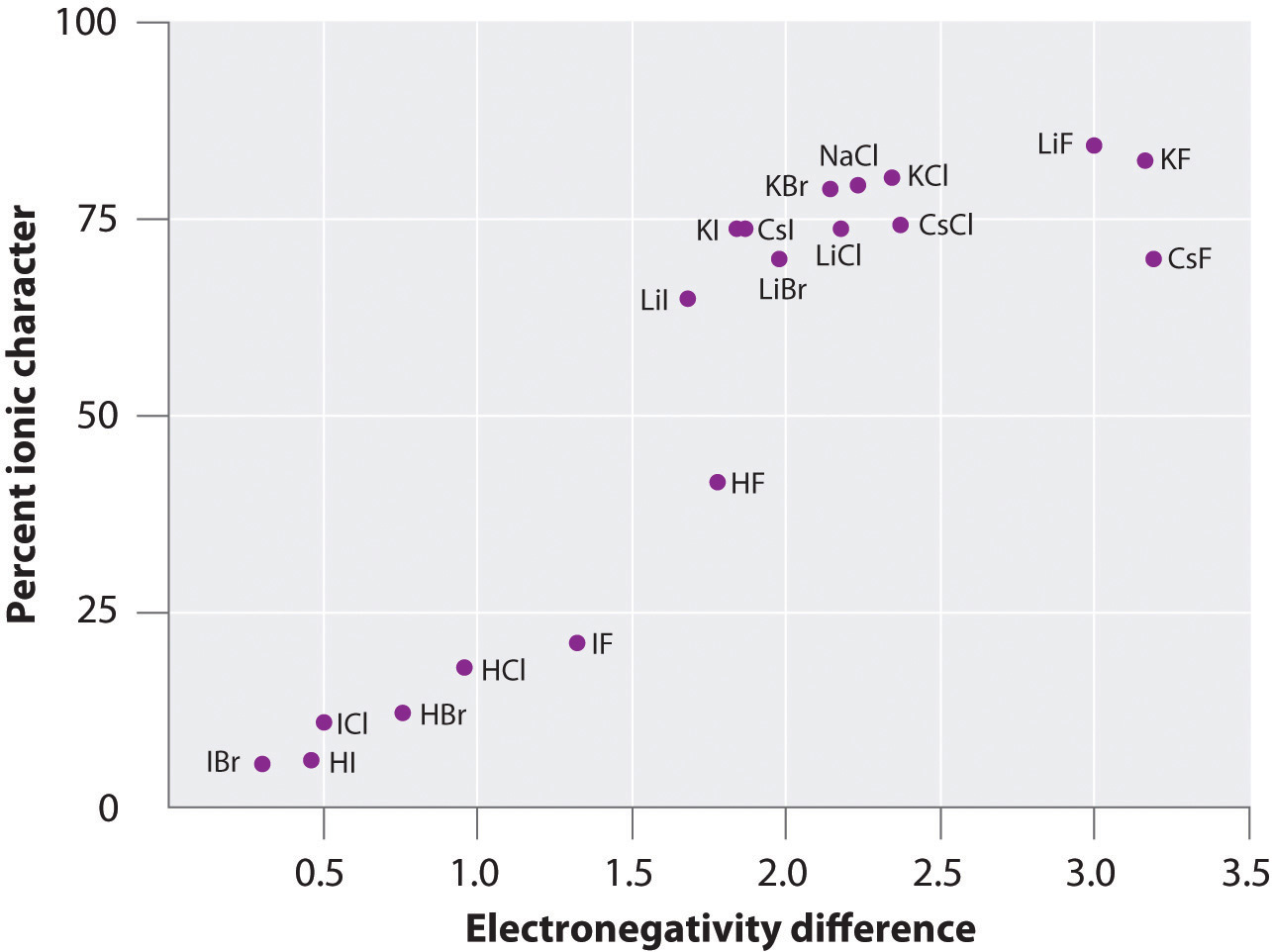
Na fase gasosa, mesmo CsF, que tem a maior diferença possível na electronegatividade entre átomos, não é 100% iónico. O CsF sólido, entretanto, é melhor visto como 100% iônico devido às interações eletrostáticas adicionais na malha.
Exemplo 11
Na fase gasosa, NaCl tem um momento dipolo de 9,001 D e uma distância Na-Cl de 236,1 pm. Calcular a porcentagem de caráter iônico em NaCl.
Dado: espécie química, momento dipolo e distância internuclear
Passagem para: porcentagem de caráter iônico
Estratégia:
A Calcule a carga em cada átomo usando a informação dada e Equação 8.16.
B Encontre a percentagem de carácter iónico a partir da razão entre a carga real e a carga de um único electrão.
Solução:
A A carga em cada átomo é dada por
Q = μ r = 9,001 D ( 3,3356 × 10 -30 C – m 1 D ) ( 1 236,1 pm ) ( 1 pm 10 -12 m ) = 1 . 2 7 2 × 1 0 -19 C
Que NaCl se comporta como se tivesse cargas de 1,272 × 10-19 C em cada átomo separado por 236,1 pm.
B A percentagem de carácter iónico é dada pela razão entre a carga real e a carga de um único electrão (a carga esperada para a transferência completa de um electrão):
% de carácter iónico = ( 1.272 × 10 -19 C 1,6022 × 10 -19 C ) ( 100 ) = 79,39 % ≃ 79 %
Exercício
Na fase gasosa, o cloreto de prata (AgCl) tem um momento dipolo de 6,08 D e uma distância de Ag-Cl de 228,1 pm. Qual é a percentagem de carácter iónico no cloreto de prata?
Resposta: 55.5%
Resumo
Compostos com ligações polares covalentes têm electrões que são partilhados de forma desigual entre os átomos ligados. A polaridade de tal ligação é determinada em grande parte pelos eletronegativites relativos dos átomos ligados. A distribuição assimétrica da carga numa substância polar produz um momento dipolo, que é o produto das cargas parciais sobre os átomos ligados e da distância entre eles.
Equação-chave
- Polaridade da ligação e aumento do carácter iónico com uma diferença crescente na electronegatividade.
Equação-chave
Momento dipolo
Equação 8.16: µ = Qr
Problemas conceptuais
-
Por que os compostos iónicos como o KI exibem substancialmente menos do que 100% de carácter iónico na fase gasosa?
-
Dos compostos LiI e LiF, que esperaria que se comportassem mais como um composto iónico clássico? Qual teria o maior momento dipolo na fase gasosa? Explique suas respostas.
Problemas Numéricos
-
Prever se cada composto é puramente covalente, puramente iônico, ou polar covalente.
>
- RbCl
- S8
- TiCl2
- SbCl3
- LiI
- Br2
-
Baseado em electronegatividades relativas, classificar a ligação em cada composto como iónica, covalente ou covalente polar. Indique a direção do dipolo da ligação para cada ligação polar covalente.
- NO
- HF
- MgO
- AlCl3
- SiO2
- a ligação C=O em acetona
- O3
-
Baseado nas actividades electrónicas relativas, classificar a ligação em cada composto como iónica, covalente ou covalente polar. Indique a direção do dipolo da ligação para cada ligação polar covalente.
- NaBr
- OF2
- BCl3
- a ligação S-S em CH3CH2SSCH2CH3
- a ligação C-Cl em CH2Cl2
- A ligação O-H em CH3OH
- PtCl42-
-
Classificar cada espécie como tendo 0%-40% de carácter iónico, 40%-60% de carácter iónico, ou 60%-100% de carácter iónico com base no tipo de ligação que você esperaria. Justifique o seu raciocínio.
- CaO
- S8
- AlBr3
- ICl
- Na2S
- SiO2
- LiBr
-
Se a distância da ligação em HCl (momento dipolo = 1.109 D) fosse o dobro do valor real de 127,46 pm, qual seria o efeito sobre a carga localizada em cada átomo? Qual seria a porcentagem de carga negativa sobre o Cl? Na distância real da ligação, como a duplicação da carga em cada átomo afetaria o momento dipolo? Isto representaria mais caráter iônico ou covalente?
-
Calcular a porcentagem de caráter iônico de HF (momento dipolo = 1.826 D) se a distância da ligação H-F for 92 pm.
-
Calcular a percentagem de carácter iónico de CO (momento dipolo = 0,110 D) se a distância C-O for 113 pm.
-
Calcular a percentagem de carácter iónico de PbS e PbO na fase gasosa, dada a seguinte informação: para PbS, r = 228,69 pm e µ = 3.59 D; para PbO, r = 192,18 pm e µ = 4,64 D. Você classificaria estes compostos como tendo ligações covalentes ou polares no estado sólido?