Dipolimomentit
Polaarisen aineen, kuten HCl:n, epäsymmetrinen varausjakauma tuottaa dipolimomentinSidoksissa olevien atomien osittaisvarauksen Q ja osittaisvarausten välisen etäisyyden r tulo: µ=Qr, jossa Q mitataan coulombeina (C) ja r metreinä (m). lyhennettynä kreikkalaisella kirjaimella mu (µ). Dipolimomentti määritellään sidoksissa olevien atomien osavarauksen Q ja osavarausten välisen etäisyyden r tulona:
Yhtälö 8.16
µ = Qr
missä Q mitataan coulombeina (C) ja r metreinä. Dipolimomenttien yksikkö on Debye (D):
Yhtälö 8.17
1 D = 3,3356 × 10-30 C-m
Kun dipolimomentin omaava molekyyli sijoitetaan sähkökenttään, sillä on taipumus suuntautua sähkökentän suuntaisesti epäsymmetrisen varausjakaumansa vuoksi (kuva 8.13 ”Molecules That Possess a Dipole Moment Partially Align Themely Themselves with an Applied Electric Field”).
Kuva 8.13 Molecules That Possess a Dipole Moment Partially Align Themely with an Applied Electric Field
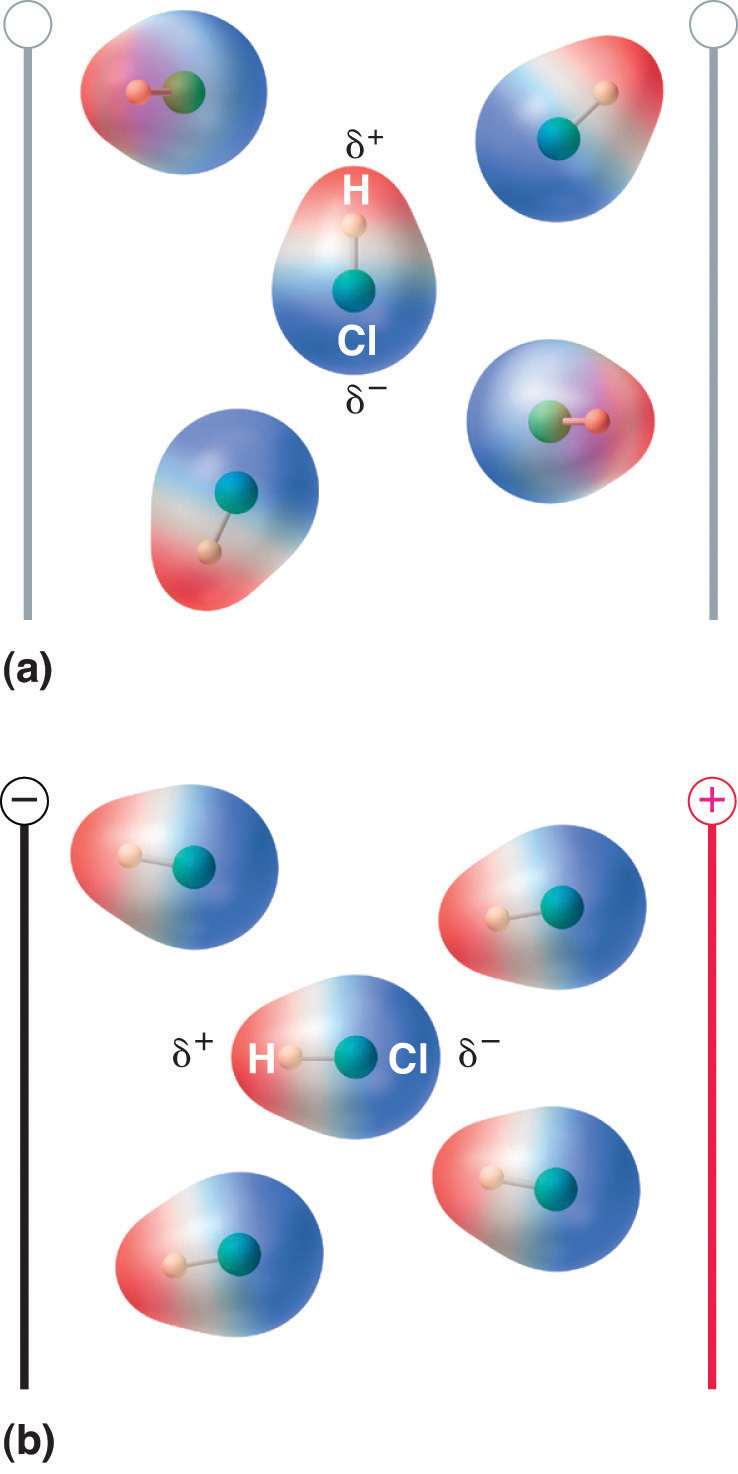
Kentän puuttuessa (a) HCl-molekyylit ovat satunnaisesti suuntautuneita. Kun siihen kohdistetaan sähkökenttä (b), molekyylit pyrkivät suuntautumaan kentän mukaan siten, että molekyylin dipolin positiivinen pää osoittaa kohti negatiivista päätepistettä ja päinvastoin.
Voidaan mitata HCl:n kaltaisen molekyylin atomien osittaisvaraukset yhtälön 8.16 avulla. Jos HCl:n sidos olisi puhtaasti ioninen, elektroni siirtyisi H:sta Cl:ään, joten H-atomilla olisi täysi +1 varaus ja Cl-atomilla täysi -1 varaus. HCl:n dipolimomentti on 1,109 D, joka määritetään mittaamalla sen suuntautumisen laajuus sähkökentässä, ja ilmoitettu kaasufaasin H-Cl-etäisyys on 127,5 pm. Näin ollen kunkin atomin varaus on
Yhtälö 8.18
Q = μ r = 1,109 D ( 3,3356 × 10 -30 C – m 1 D ) ( 1 127,5 pm ) ( 1 pm 10 -12 m ) ( 1 pm 10 -12 m ) = 2,901 × 10 -20 C
Jakaamalla tämä laskettu arvo yhden elektronin varauksella (1.6022 × 10-19 C), saadaan, että HCl-molekyylin Cl-atomin varaus on noin -0,18, mikä vastaa noin 0,18 e-:
Yhtälö 8.19
2,901 × 10 -20 C 1,6022 × 10 -19 C 1,6022 × 10 -19 C /e – = 0,1811 e –
Neutraalin yhdisteen muodostamiseksi H-atomin varauksen on oltava yhtä suuri kuin H-atomin varauksen on oltava yhtä suuri, mutta vastakkainen. Näin ollen HCl:n mitattu dipolimomentti osoittaa, että H-Cl-sidoksella on noin 18 % ionista luonnetta (0,1811 × 100) eli 82 % kovalenttista luonnetta. Sen sijaan, että kirjoittaisimme HCl:n muodossa Hδ+-Clδ-, voimme näin ollen ilmoittaa varaukseneron kvantitatiivisesti muodossa
H 0 ,18 δ + – Cl 0 ,18 δ –
Lasketut tuloksemme ovat sopusoinnussa vedyn ja kloorin elektronegatiivisuuseron kanssa χH = 2,20; χCl = 3,16, χCl – χH = 0,96), mikä on arvo, joka on hyvin polaarisille kovalenttisille sidoksille tyypillinen. Osoitamme dipolimomentin kirjoittamalla nuolen molekyylin yläpuolelle.Matemaattisesti dipolimomentit ovat vektoreita, ja niillä on sekä suuruus että suunta. Molekyylin dipolimomentti on yksittäisten sidosten dipolien vektorisumma. Esimerkiksi HCl:n dipolimomentti ilmoitetaan seuraavasti:
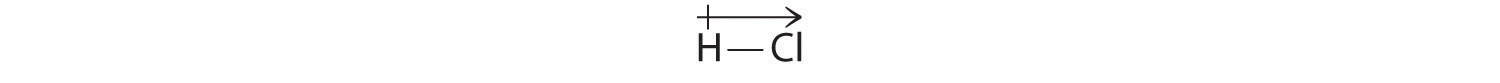
Nuoli osoittaa elektronivirran suunnan osoittamalla kohti elektronegatiivisempaa atomia.
Monien kaasufaasissa olevien aineiden atomien varaukset voidaan laskea mitattujen dipolimomenttien ja sidosetäisyyksien avulla. Kuvassa 8.14 ”A Plot of the Percent Ionic Character of a Bond as Determined from Measured Dipole Moments versus the Difference in Electronegativity of the Bonded Atoms” esitetään useiden aineiden prosentuaalisen ionisen luonteen kuvaaja sidoksissa olevien atomien elektronegatiivisuuseron suhteen. Kuvaajan mukaan NaCl(g):n ja CsF(g):n kaltaisten lajien sidokset ovat luonteeltaan huomattavasti alle 100-prosenttisesti ionisia. Kun kaasu tiivistyy kiinteäksi aineeksi, polarisoituneiden lajien väliset dipoli-dipoli-vuorovaikutukset kuitenkin lisäävät varauseroja. Kiteessä elektroni siis siirtyy metallista epämetalliin, ja nämä aineet käyttäytyvät kuin klassiset ioniset yhdisteet. Kuvan 8.14 ”A Plot of the Percent Ionic Character of a Bond as Determined from Measured Dipole Moments versus the Difference in Electronegativity of the Bonded Atoms” tiedot osoittavat, että kaksiatomiset lajit, joiden elektronegatiivisuusero on alle 1,5, ovat luonteeltaan alle 50-prosenttisesti ionisia, mikä vastaa aiempaa kuvaustamme näiden lajien sisältävän polaarisia kovalenttisidoksia. Dipolimomenttien käyttöä polaarisen sidoksen ionisen luonteen määrittämiseksi havainnollistetaan esimerkissä 11.
Kuva 8.14 Mitattujen dipolimomenttien perusteella määritetyn sidoksen ionisen luonteen prosenttiosuuden kuvaaja suhteessa sidoksissa olevien atomien elektronegatiivisuuseroon
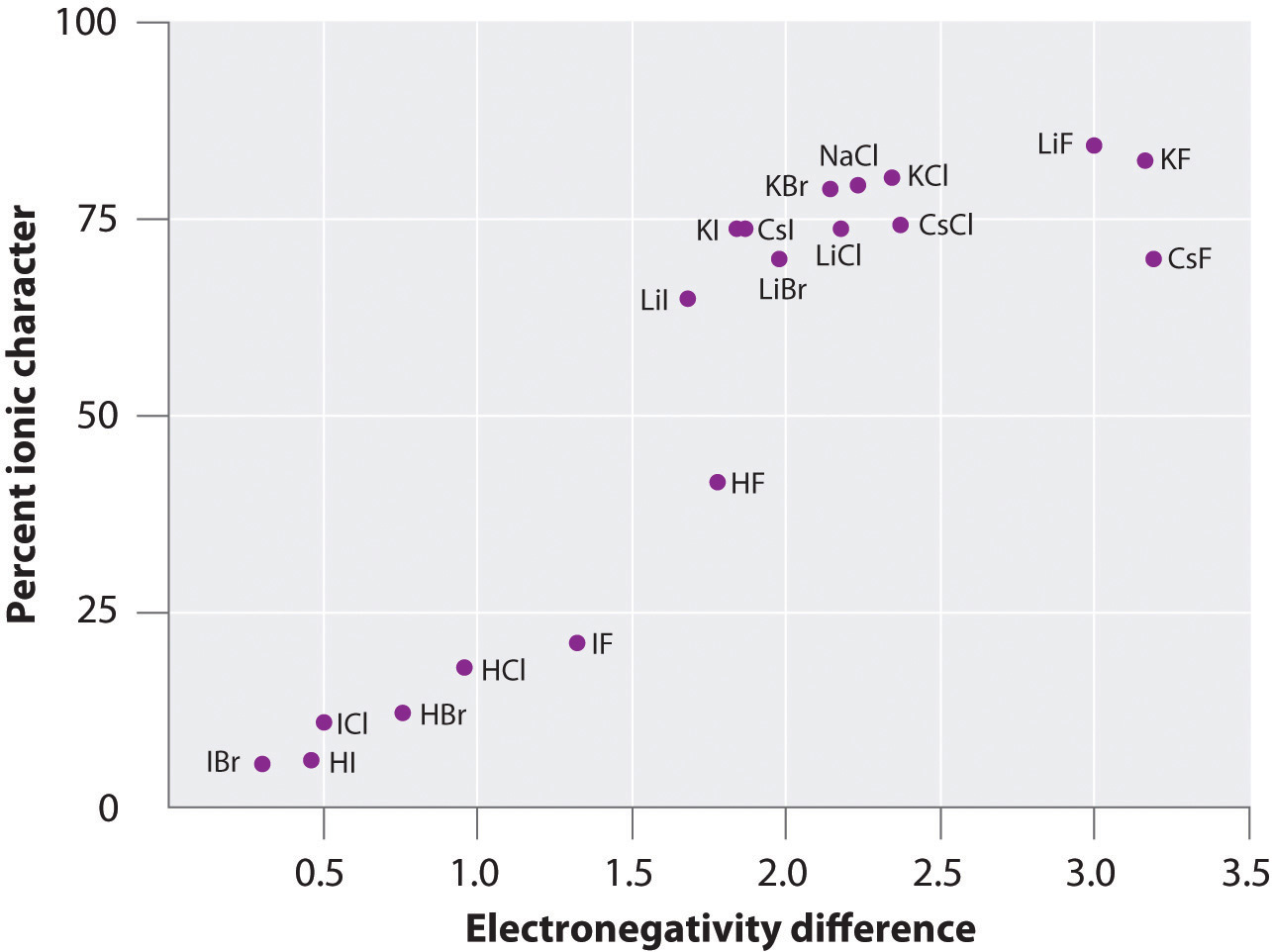
Kaasufaasissa edes CsF, jolla on suurin mahdollinen atomien välinen elektronegatiivisuusero, ei ole 100-prosenttisesti ioninen. Kiinteää CsF:ää voidaan kuitenkin pitää parhaiten 100-prosenttisesti ionisena, koska ristikossa on ylimääräisiä sähköstaattisia vuorovaikutuksia.
Esimerkki 11
Kaasufaasissa NaCl:n dipolimomentti on 9,001 D ja Na-Cl-etäisyys 236,1 pm. Laske NaCl:n prosentuaalinen ioninen luonne.
Annetaan: kemiallinen laji, dipolimomentti ja sisäydinetäisyys
Kysytään: prosentuaalinen ioninen luonne
Strategia:
A Laske kunkin atomin varaus käyttäen annettuja tietoja ja yhtälöä 8.16.
B Etsi prosentuaalinen ioniluonne todellisen varauksen ja yhden elektronin varauksen suhteesta.
Ratkaisu:
A Kunkin atomin varaus saadaan
Q = μ r = 9,001 D ( 3,3356 × 10 -30 C – m 1 D ) ( 1 236,1 pm ) ( 1 pm 10 -12 m ) = 1 . 2 7 2 × 1 0 -19 C
Siten NaCl käyttäytyy ikään kuin sillä olisi kullakin 236,1 pm:n etäisyydellä toisistaan olevilla atomeilla varaukset, joiden suuruus on 1,272 × 10-19 C.
B Ionisen luonteen prosenttiosuus saadaan todellisen varauksen ja yhden elektronin varauksen (yhden elektronin täydellisestä siirtymisestä odotettavissa olevan varauksen) suhteesta:
% ioninen luonne = ( 1.272 × 10 -19 C 1,6022 × 10 -19 C ) ( 100 ) = 79,39 % ≃ 79 %
Harjoitus
Hopeakloridin (AgCl) dipolimomentti kaasufaasissa on 6,08 D ja Ag-Cl-etäisyys 228,1 pm. Mikä on hopeakloridin ionisen luonteen prosenttiosuus?
Vastaus: 55,5 %
Yhteenveto
Yhdisteissä, joissa on polaarisia kovalenttisia sidoksia, elektronit jakautuvat epätasaisesti sidoksissa olevien atomien kesken. Tällaisen sidoksen polaarisuus määräytyy pitkälti sidoksissa olevien atomien suhteellisten elektronegatiivisuuksien perusteella. Epäsymmetrinen varausjakauma polaarisessa aineessa tuottaa dipolimomentin, joka on sidoksissa olevien atomien osittaisvarausten ja niiden välisen etäisyyden tulo.
Key Takeaway
- Sidoksen poolisuus ja ioninen luonne kasvavat elektronegatiivisuuseron kasvaessa.
Key Equation
Dipolimomentti
Yhtälö 8.16: µ = Qr
Käsitteellisiä ongelmia
-
Miksi ioniset yhdisteet, kuten KI, osoittavat kaasufaasissa huomattavasti vähemmän kuin 100 % ionista luonnetta?
-
Yhdisteistä LiI ja LiF kumman odottaisit käyttäytyvän enemmän klassisen ioniyhdisteen tavoin? Kummalla olisi suurempi dipolimomentti kaasufaasissa? Selitä vastauksesi.
Numeerisia ongelmia
-
Arvioi, onko kukin yhdiste puhtaasti kovalenttinen, puhtaasti ioninen vai polaarisesti kovalenttinen. luokittele kunkin yhdisteen sidokset ionisiksi, kovalenttisiksi tai polaarikovalenttisiksi. Ilmoita kunkin poolisen kovalenttisen sidoksen sidosdipolin suunta.
- NO
- HF
- MgO
- AlCl3
- SiO2
- C=O-sidos. asetonissa
- O3
-
Suhteellisten elektronegatiivisuuksien perusteella, luokittele kunkin yhdisteen sidokset ionisiksi, kovalenttisiksi tai polaarikovalenttisiksi. Ilmoita kunkin poolisen kovalenttisen sidoksen sidosdipolin suunta.
- NaBr
- OF2
- BCl3
- CH3CH2SSCH2CH3:n S-S-sidos
- C2Cl2:n C-Cl-sidos
- O-H-sidos CH3OH:ssa
- PtCl42-
.
-
Luokittele kukin laji siten, että sen ioninen luonne on 0-40 %, 40-60 % ioninen luonne tai 60-100 % ioninen luonne sen perusteella, millaista sidostyyppiä odotat. Perustele perustelusi.
- CaO
- S8
- AlBr3
- ICl
- Na2S
- SiO2
- LiBr
-
Jos HCl:n sidosetäisyys (dipolimomentti = 1.109 D) olisi kaksinkertainen todelliseen arvoon 127,46 pm verrattuna, mikä olisi vaikutus kuhunkin atomiin lokalisoituneeseen varaukseen? Mikä olisi Cl:n prosentuaalinen negatiivinen varaus? Miten kunkin atomin varauksen kaksinkertaistaminen vaikuttaisi dipolimomenttiin todellisella sidosetäisyydellä? Edustaisiko tämä enemmän ionista vai kovalenttista luonnetta?
-
Laskekaa HF:n prosentuaalinen ioninen luonne (dipolimomentti = 1.826 D), jos H-F-sidoksen etäisyys on 92 pm.
-
Laskekaa CO:n prosentuaalinen ioninen luonne (dipolimomentti = 0,110 D), jos C-O:n etäisyys on 113 pm.
-
Laskekaa PbS:n ja PbO:n prosentuaalinen ioninen luonne kaasufaasissa, kun otetaan huomioon seuraavat tiedot: PbS:lle r = 228,69 pm ja µ = 3.59 D; PbO:lle r = 192,18 pm ja µ = 4,64 D. Luokittelisitko nämä yhdisteet kiinteässä olomuodossa kovalenttisiksi vai poolisiksi kovalenttisiksi sidoksiksi?