Dipolmomente
Die asymmetrische Ladungsverteilung in einer polaren Substanz wie HCl erzeugt ein DipolmomentDas Produkt aus der Teilladung Q an den gebundenen Atomen und dem Abstand r zwischen den Teilladungen: µ=Qr, wobei Q in Coulomb (C) und r in Meter (m) gemessen wird, abgekürzt mit dem griechischen Buchstaben mu (µ). Das Dipolmoment ist definiert als das Produkt aus der Teilladung Q der gebundenen Atome und dem Abstand r zwischen den Teilladungen:
Gleichung 8.16
µ = Qr
wobei Q in Coulomb (C) und r in Metern gemessen wird. Die Einheit für Dipolmomente ist das Debye (D):
Gleichung 8.17
1 D = 3,3356 × 10-30 C-m
Wenn ein Molekül mit einem Dipolmoment in ein elektrisches Feld gebracht wird, neigt es aufgrund seiner asymmetrischen Ladungsverteilung dazu, sich mit dem elektrischen Feld auszurichten (Abbildung 8.13 „Moleküle, die ein Dipolmoment besitzen, richten sich teilweise nach einem angelegten elektrischen Feld aus“).
Abbildung 8.13 Moleküle, die ein Dipolmoment besitzen, richten sich teilweise nach einem angelegten elektrischen Feld aus
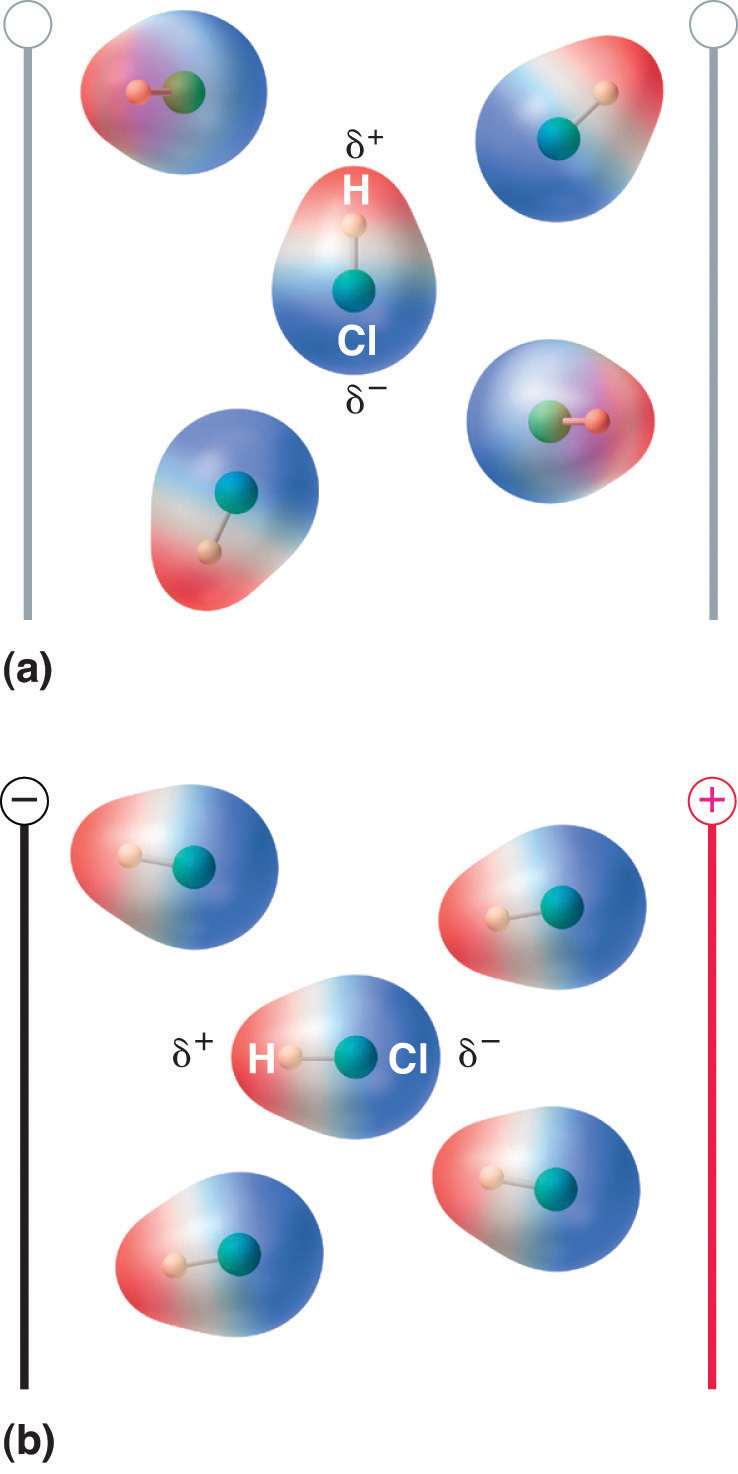
In Abwesenheit eines Feldes (a) sind die HCl-Moleküle zufällig ausgerichtet. Wenn ein elektrisches Feld angelegt wird (b), neigen die Moleküle dazu, sich nach dem Feld auszurichten, so dass das positive Ende des molekularen Dipols zum negativen Pol zeigt und umgekehrt.
Wir können die Teilladungen der Atome in einem Molekül wie HCl mit Gleichung 8.16 messen. Wäre die Bindung in HCl rein ionisch, würde ein Elektron von H auf Cl übertragen werden, so dass das H-Atom eine volle +1-Ladung und das Cl-Atom eine volle -1-Ladung hätte. Das Dipolmoment von HCl beträgt 1,109 D, wie durch Messung des Ausmaßes seiner Ausrichtung in einem elektrischen Feld bestimmt, und der gemeldete H-Cl-Abstand in der Gasphase beträgt 127,5 pm. Daher beträgt die Ladung an jedem Atom
Gleichung 8.18
Q = μ r = 1,109 D ( 3,3356 × 10 -30 C – m 1 D ) ( 1 127,5 pm ) ( 1 pm 10 -12 m ) = 2,901 × 10 -20 C
Durch Division dieses berechneten Wertes durch die Ladung an einem einzelnen Elektron (1.6022 × 10-19 C), ergibt sich, dass die Ladung am Cl-Atom eines HCl-Moleküls etwa -0,18 beträgt, was etwa 0,18 e- entspricht:
Gleichung 8.19
2,901 × 10 -20 C 1,6022 × 10 -19 C /e – = 0,1811 e –
Um eine neutrale Verbindung zu bilden, muss die Ladung am H-Atom gleich groß aber entgegengesetzt sein. Das gemessene Dipolmoment von HCl deutet also darauf hin, dass die H-Cl-Bindung zu etwa 18 % ionischen Charakter hat (0,1811 × 100), also zu 82 % kovalenten Charakter. Anstatt HCl als Hδ+-Clδ- zu schreiben, können wir daher die Ladungstrennung quantitativ angeben als
H 0,18 δ + – Cl 0,18 δ –
Unsere berechneten Ergebnisse stimmen mit der Elektronegativitätsdifferenz zwischen Wasserstoff und Chlor überein χH = 2,20; χCl = 3,16, χCl – χH = 0,96), ein Wert, der gut im Bereich für polare kovalente Bindungen liegt. Das Dipolmoment wird durch einen Pfeil oberhalb des Moleküls angezeigt.Mathematisch gesehen sind Dipolmomente Vektoren, die sowohl einen Betrag als auch eine Richtung haben. Das Dipolmoment eines Moleküls ist die Vektorsumme der Dipole der einzelnen Bindungen. In HCl beispielsweise wird das Dipolmoment wie folgt angegeben:
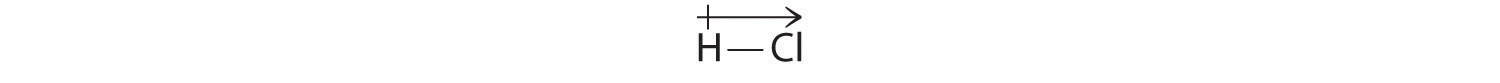
Der Pfeil zeigt die Richtung des Elektronenflusses, indem er auf das elektronegativere Atom zeigt.
Die Ladung der Atome vieler Stoffe in der Gasphase kann anhand der gemessenen Dipolmomente und Bindungsabstände berechnet werden. Abbildung 8.14 „A Plot of the Percent Ionic Character of a Bond as Determined from Measured Dipole Moments versus the Difference in Electronegativity of the Bonded Atoms“ zeigt eine Darstellung des prozentualen ionischen Charakters gegenüber dem Unterschied in der Elektronegativität der gebundenen Atome für mehrere Stoffe. Aus dem Diagramm geht hervor, dass die Bindungen in Stoffen wie NaCl(g) und CsF(g) zu deutlich weniger als 100 % ionisch sind. Wenn das Gas jedoch zu einem Festkörper kondensiert, erhöhen Dipol-Dipol-Wechselwirkungen zwischen polarisierten Spezies die Ladungstrennungen. Im Kristall wird daher ein Elektron vom Metall auf das Nichtmetall übertragen, und diese Stoffe verhalten sich wie klassische ionische Verbindungen. Die Daten in Abbildung 8.14 „A Plot of the Percent Ionic Character of a Bond as Determined from Measured Dipole Moments versus the Difference in Electronegativity of the Bonded Atoms“ (Ein Diagramm des prozentualen ionischen Charakters einer Bindung, wie aus gemessenen Dipolmomenten bestimmt, gegenüber der Differenz der Elektronegativität der gebundenen Atome) zeigen, dass zweiatomige Spezies mit einer Elektronegativitätsdifferenz von weniger als 1,5 zu weniger als 50 % ionischen Charakter haben, was mit unserer früheren Beschreibung dieser Spezies als polare kovalente Bindungen übereinstimmt. Die Verwendung von Dipolmomenten zur Bestimmung des ionischen Charakters einer polaren Bindung wird in Beispiel 11 veranschaulicht.
Abbildung 8.14 Ein Diagramm des prozentualen ionischen Charakters einer Bindung, bestimmt aus gemessenen Dipolmomenten im Vergleich zur Differenz der Elektronegativität der gebundenen Atome
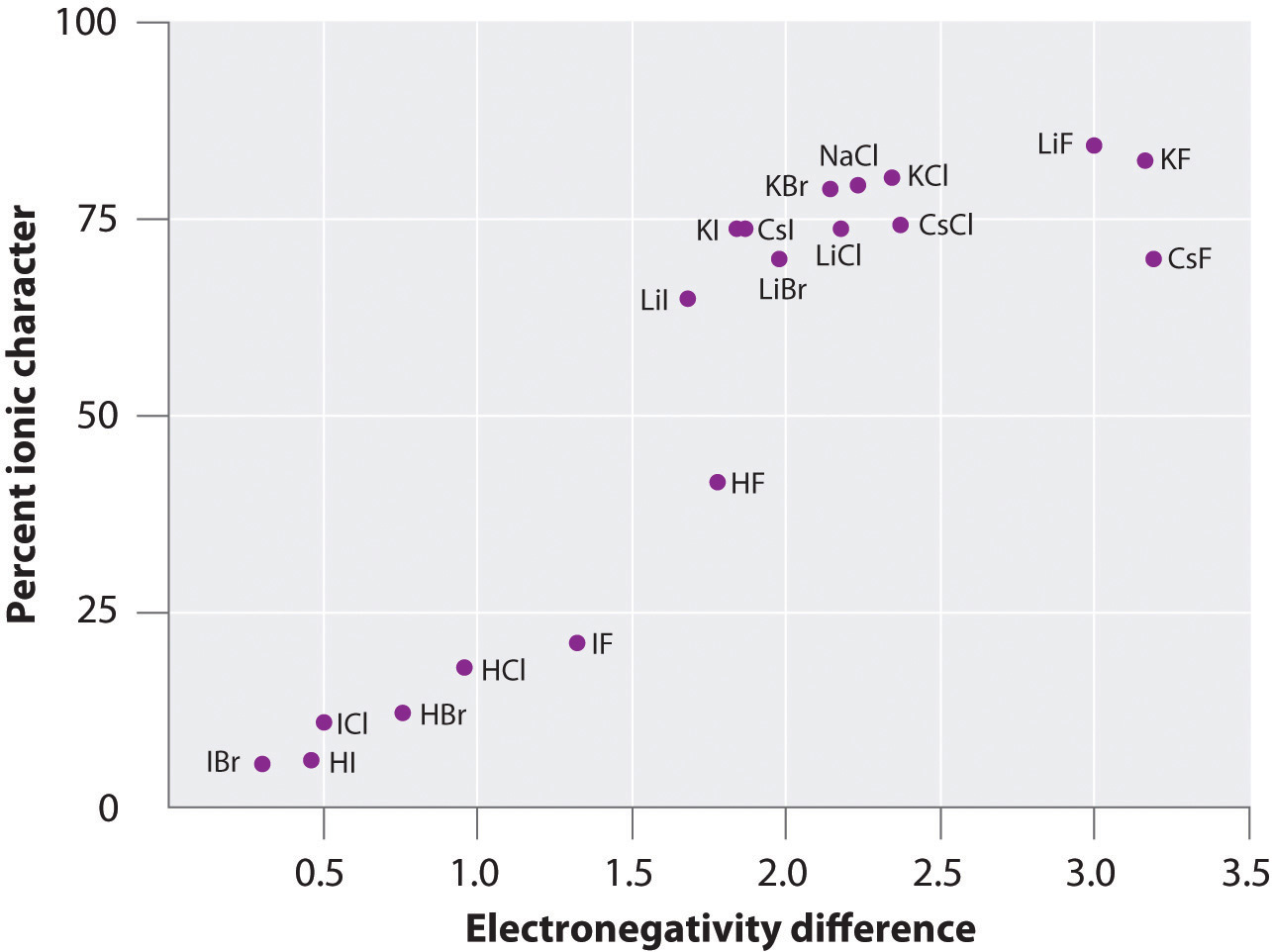
In der Gasphase ist selbst CsF, das die größtmögliche Differenz der Elektronegativität zwischen den Atomen aufweist, nicht zu 100 % ionisch. Festes CsF ist jedoch wegen der zusätzlichen elektrostatischen Wechselwirkungen im Gitter am besten als 100% ionisch anzusehen.
Beispiel 11
In der Gasphase hat NaCl ein Dipolmoment von 9,001 D und einen Na-Cl-Abstand von 236,1 pm. Berechnen Sie den prozentualen Ionencharakter von NaCl.
Gegeben sind: chemische Spezies, Dipolmoment und innerer Kernabstand
Gefragt ist: prozentualer Ionencharakter
Strategie:
A Berechnen Sie die Ladung jedes Atoms anhand der gegebenen Informationen und der Gleichung 8.16.
B Ermitteln Sie den prozentualen Ionencharakter aus dem Verhältnis der tatsächlichen Ladung zur Ladung eines einzelnen Elektrons.
Lösung:
A Die Ladung an jedem Atom ist gegeben durch
Q = μ r = 9,001 D ( 3,3356 × 10 -30 C – m 1 D ) ( 1 236,1 pm ) ( 1 pm 10 -12 m ) = 1 . 2 7 2 × 1 0 -19 C
Damit verhält sich NaCl so, als hätte es Ladungen von 1,272 × 10-19 C an jedem Atom im Abstand von 236,1 pm.
B Der prozentuale Ionencharakter ergibt sich aus dem Verhältnis der tatsächlichen Ladung zur Ladung eines einzelnen Elektrons (die für die vollständige Übertragung eines Elektrons erwartete Ladung):
% Ionencharakter = ( 1.272 × 10 -19 C 1.6022 × 10 -19 C ) ( 100 ) = 79.39 % ≃ 79 %
Übung
In der Gasphase hat Silberchlorid (AgCl) ein Dipolmoment von 6.08 D und einen Ag-Cl-Abstand von 228.1 pm. Wie hoch ist der prozentuale Ionenanteil in Silberchlorid?
Antwort: 55,5%
Zusammenfassung
Verbindungen mit polaren kovalenten Bindungen haben Elektronen, die ungleichmäßig zwischen den gebundenen Atomen verteilt sind. Die Polarität einer solchen Bindung wird weitgehend durch die relativen Elektronegativitäten der gebundenen Atome bestimmt. Die asymmetrische Ladungsverteilung in einer polaren Substanz erzeugt ein Dipolmoment, das das Produkt aus den Teilladungen der gebundenen Atome und dem Abstand zwischen ihnen ist.
Key Takeaway
- Bindungspolarität und ionischer Charakter nehmen mit zunehmender Elektronegativitätsdifferenz zu.
Key Equation
Dipolmoment
Equation 8.16: µ = Qr
Konzeptuelle Probleme
-
Warum weisen ionische Verbindungen wie KI in der Gasphase einen wesentlich geringeren als den 100%igen ionischen Charakter auf?
-
Von den Verbindungen LiI und LiF, von welcher würden Sie erwarten, dass sie sich eher wie eine klassische ionische Verbindung verhalten? Welche würde das größere Dipolmoment in der Gasphase haben? Erläutern Sie Ihre Antworten.
Numerische Probleme
-
Bestimmen Sie, ob jede Verbindung rein kovalent, rein ionisch oder polar kovalent ist.
- RbCl
- S8
- TiCl2
- SbCl3
- LiI
- Br2
-
Basierend auf relativen Elektronegativitäten, Ordnen Sie die Bindungen in jeder Verbindung als ionisch, kovalent oder polar kovalent ein. Geben Sie die Richtung des Bindungsdipols für jede polare kovalente Bindung an.
- NO
- HF
- MgO
- AlCl3
- SiO2
- die C=O-Bindung in Aceton
- O3
-
Basierend auf relativen Elektronegativitäten, Ordnen Sie die Bindungen in jeder Verbindung als ionisch, kovalent oder polar kovalent ein. Geben Sie die Richtung des Bindungsdipols für jede polare kovalente Bindung an.
- NaBr
- OF2
- BCl3
- die S-S-Bindung in CH3CH2SSCH2CH3
- die C-Cl-Bindung in CH2Cl2
- die O-H-Bindung in CH3OH
- PtCl42-
-
Klassifizieren Sie jede Spezies als eine mit 0%-40% ionischem Charakter, 40%-60% ionischen Charakter oder 60%-100% ionischen Charakter auf der Grundlage der Art der Bindung, die Sie erwarten würden. Begründen Sie Ihre Überlegungen.
- CaO
- S8
- AlBr3
- ICl
- Na2S
- SiO2
- LiBr
-
Wenn der Bindungsabstand in HCl (Dipolmoment = 1.109 D) doppelt so groß wäre wie der tatsächliche Wert von 127,46 pm, wie würde sich das auf die an jedem Atom lokalisierte Ladung auswirken? Wie hoch wäre der Prozentsatz der negativen Ladung von Cl? Wie würde sich die Verdoppelung der Ladung an jedem Atom bei dem tatsächlichen Bindungsabstand auf das Dipolmoment auswirken? Würde dies mehr ionischen oder kovalenten Charakter bedeuten?
-
Berechnen Sie den prozentualen ionischen Charakter von HF (Dipolmoment = 1.826 D), wenn der H-F-Bindungsabstand 92 pm beträgt.
-
Berechnen Sie den prozentualen Ionencharakter von CO (Dipolmoment = 0,110 D), wenn der C-O-Abstand 113 pm beträgt.
-
Berechnen Sie den prozentualen Ionencharakter von PbS und PbO in der Gasphase unter Berücksichtigung der folgenden Angaben: für PbS gilt r = 228,69 pm und µ = 3.59 D; für PbO r = 192,18 pm und µ = 4,64 D. Würden Sie diese Verbindungen im festen Zustand als kovalent oder polar kovalent gebunden einstufen?