Moments dipolaires
La distribution asymétrique des charges dans une substance polaire telle que HCl produit un moment dipolaireLe produit de la charge partielle Q sur les atomes liés et de la distance r entre les charges partielles : µ=Qr, où Q est mesuré en coulombs (C) et r en mètres (m)., abrégé par la lettre grecque mu (µ). Le moment dipolaire est défini comme le produit de la charge partielle Q sur les atomes liés et de la distance r entre les charges partielles :
Equation 8.16
µ = Qr
où Q est mesuré en coulombs (C) et r en mètres. L’unité pour les moments dipolaires est le debye (D) :
Equation 8.17
1 D = 3,3356 × 10-30 C-m
Lorsqu’une molécule avec un moment dipolaire est placée dans un champ électrique, elle a tendance à s’orienter avec le champ électrique à cause de sa distribution de charge asymétrique (figure 8.13 « Molécules qui possèdent un moment dipolaire s’alignent partiellement avec un champ électrique appliqué »).
Figure 8.13 Molécules qui possèdent un moment dipolaire s’alignent partiellement avec un champ électrique appliqué
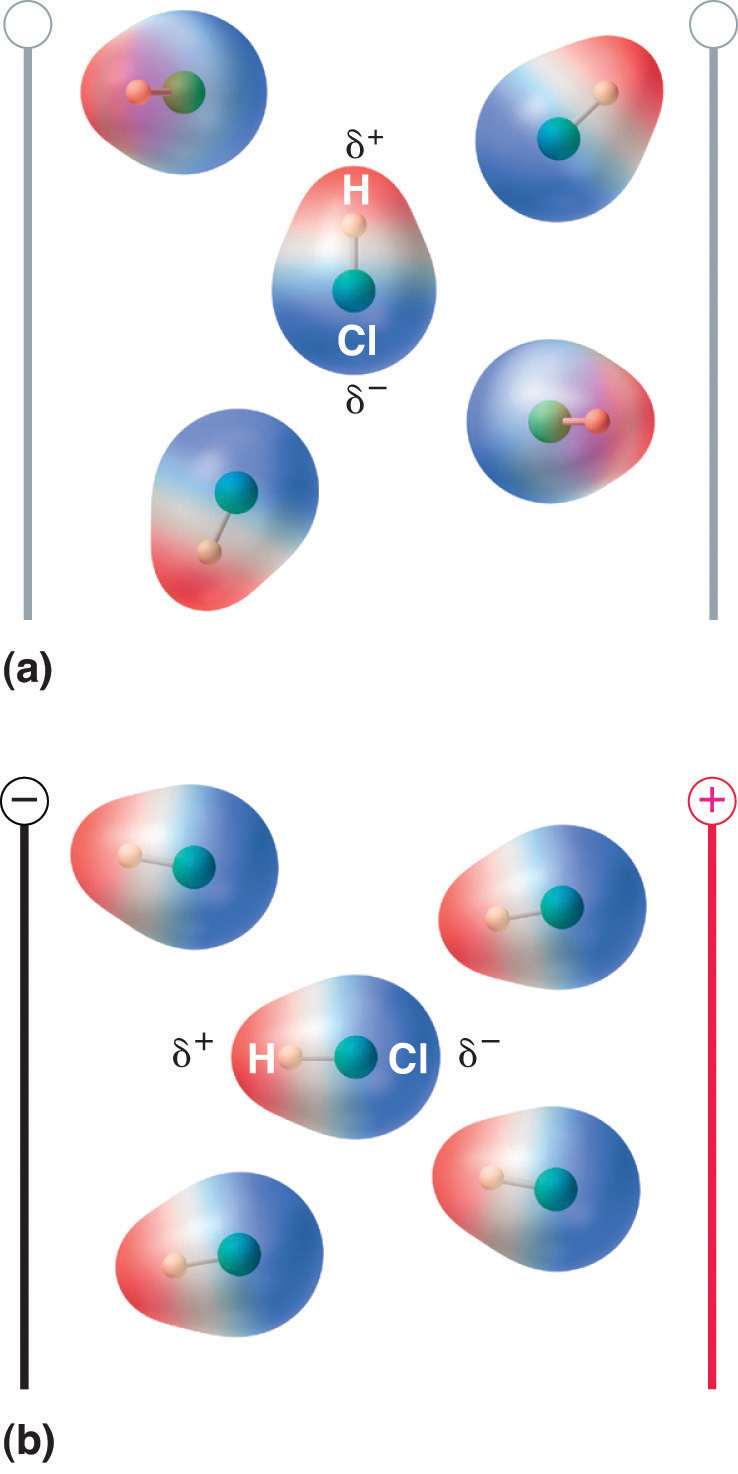
En l’absence de champ (a), les molécules de HCl sont orientées de façon aléatoire. Lorsqu’un champ électrique est appliqué (b), les molécules ont tendance à s’aligner avec le champ, de sorte que l’extrémité positive du dipôle moléculaire pointe vers la borne négative et vice versa.
Nous pouvons mesurer les charges partielles sur les atomes d’une molécule telle que le HCl en utilisant l’équation 8.16. Si la liaison dans HCl était purement ionique, un électron serait transféré de H à Cl, il y aurait donc une charge complète +1 sur l’atome de H et une charge complète -1 sur l’atome de Cl. Le moment dipolaire du HCl est de 1,109 D, déterminé en mesurant l’étendue de son alignement dans un champ électrique, et la distance H-Cl rapportée en phase gazeuse est de 127,5 pm. Par conséquent, la charge sur chaque atome est
Equation 8.18
Q = μ r = 1,109 D ( 3,3356 × 10 -30 C – m 1 D ) ( 1 127,5 pm ) ( 1 pm 10 -12 m ) = 2,901 × 10 -20 C
En divisant cette valeur calculée par la charge sur un électron unique (1.6022 × 10-19 C), on trouve que la charge sur l’atome de Cl d’une molécule de HCl est d’environ -0,18, ce qui correspond à environ 0,18 e-:
Equation 8.19
2,901 × 10 -20 C 1,6022 × 10 -19 C /e – = 0,1811 e –
Pour former un composé neutre, la charge sur l’atome de H doit être égale mais opposée. Ainsi, le moment dipolaire mesuré de HCl indique que la liaison H-Cl a un caractère ionique d’environ 18 % (0,1811 × 100), ou un caractère covalent de 82 %. Au lieu d’écrire HCl comme Hδ+-Clδ-, nous pouvons donc indiquer la séparation de charge quantitativement comme
H 0 ,18 δ + – Cl 0 ,18 δ –
Nos résultats calculés sont en accord avec la différence d’électronégativité entre l’hydrogène et le chlore χH = 2,20 ; χCl = 3,16, χCl – χH = 0,96), une valeur bien dans la gamme des liaisons covalentes polaires. Nous indiquons le moment dipolaire en écrivant une flèche au-dessus de la molécule.Mathématiquement, les moments dipolaires sont des vecteurs, et ils possèdent à la fois une magnitude et une direction. Le moment dipolaire d’une molécule est la somme vectorielle des dipôles des liaisons individuelles. Dans HCl, par exemple, le moment dipolaire est indiqué comme suit :
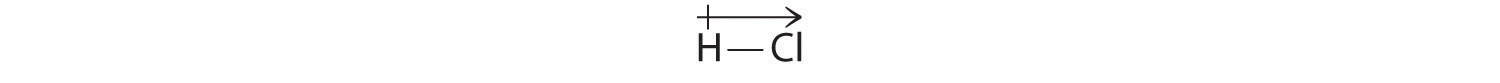
La flèche indique la direction du flux d’électrons en pointant vers l’atome le plus électronégatif.
La charge des atomes de nombreuses substances en phase gazeuse peut être calculée à l’aide des moments dipolaires mesurés et des distances entre les liaisons. La figure 8.14 » Tracé du pourcentage de caractère ionique d’une liaison, déterminé à partir des moments dipolaires mesurés, en fonction de la différence d’électronégativité des atomes liés » montre un tracé du pourcentage de caractère ionique en fonction de la différence d’électronégativité des atomes liés pour plusieurs substances. D’après le graphique, la liaison dans des espèces telles que NaCl(g) et CsF(g) est sensiblement inférieure à 100% de caractère ionique. Cependant, lorsque le gaz se condense en un solide, les interactions dipôle-dipôle entre les espèces polarisées augmentent les séparations de charge. Dans le cristal, un électron est donc transféré du métal au non-métal, et ces substances se comportent comme des composés ioniques classiques. Les données de la figure 8.14 « Tracé du pourcentage de caractère ionique d’une liaison, déterminé à partir des moments dipolaires mesurés, en fonction de la différence d’électronégativité des atomes liés » montrent que les espèces diatomiques dont la différence d’électronégativité est inférieure à 1,5 ont un caractère ionique inférieur à 50 %, ce qui est cohérent avec notre description précédente de ces espèces comme contenant des liaisons covalentes polaires. L’utilisation des moments dipolaires pour déterminer le caractère ionique d’une liaison polaire est illustrée dans l’exemple 11.
Figure 8.14 Tracé du pourcentage de caractère ionique d’une liaison tel que déterminé à partir des moments dipolaires mesurés en fonction de la différence d’électronégativité des atomes liés
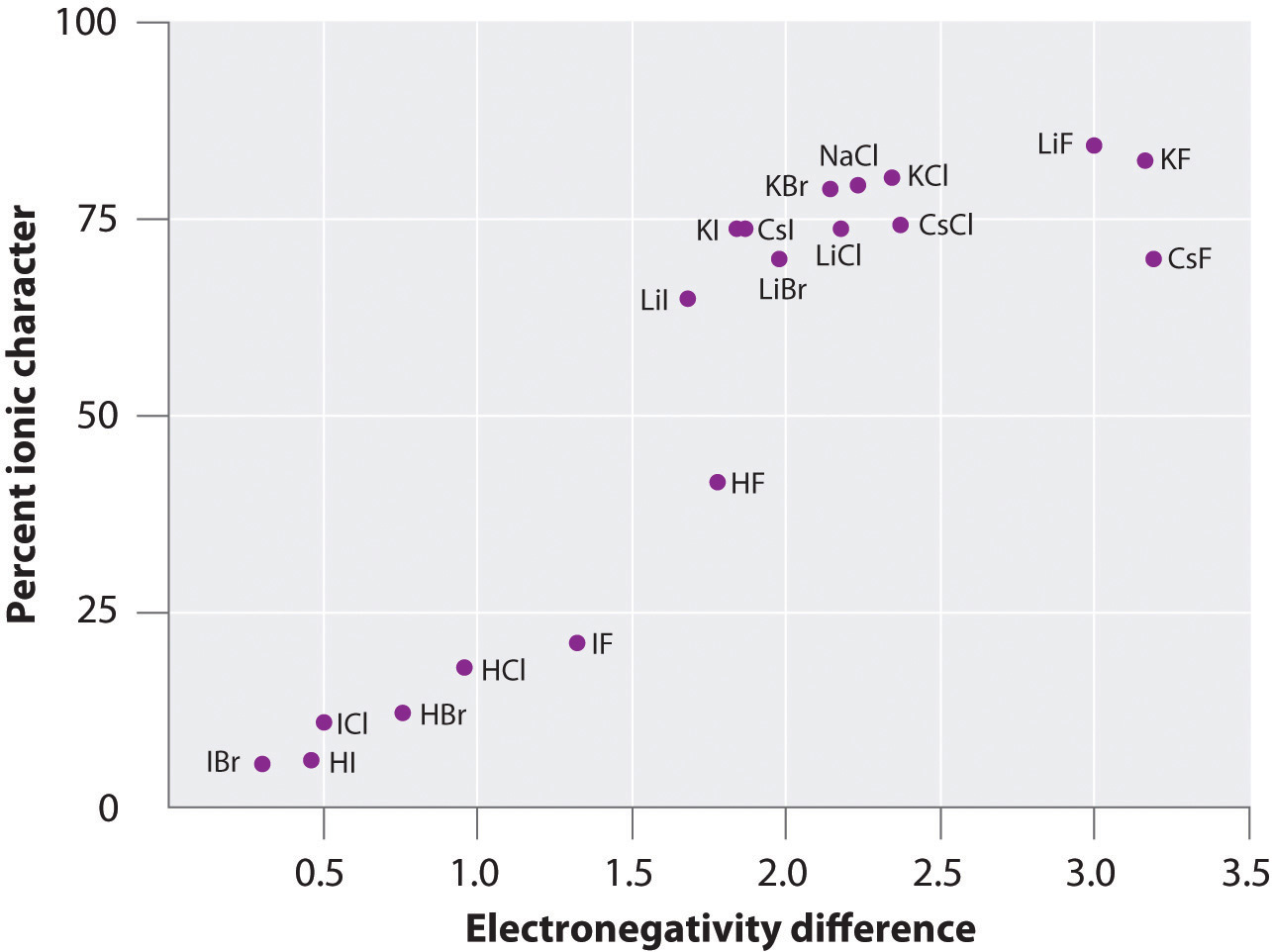
En phase gazeuse, même le CsF, qui présente la plus grande différence possible d’électronégativité entre les atomes, n’est pas ionique à 100 %. Le CsF solide, cependant, est mieux considéré comme 100% ionique en raison des interactions électrostatiques supplémentaires dans le réseau.
Exemple 11
En phase gazeuse, NaCl a un moment dipolaire de 9,001 D et une distance Na-Cl de 236,1 pm. Calculez le pourcentage de caractère ionique dans le NaCl.
Donné : espèce chimique, moment dipolaire et distance internucléaire
Demande : pourcentage de caractère ionique
Stratégie :
A Calculer la charge de chaque atome en utilisant les informations données et l’équation 8.16.
B Trouver le pourcentage de caractère ionique à partir du rapport entre la charge réelle et la charge d’un seul électron.
Solution :
A La charge de chaque atome est donnée par
Q = μ r = 9,001 D ( 3,3356 × 10 -30 C – m 1 D ) ( 1 236,1 pm ) ( 1 pm 10 -12 m ) = 1 . 2 7 2 × 1 0 -19 C
Donc NaCl se comporte comme s’il avait des charges de 1,272 × 10-19 C sur chaque atome séparé par 236,1 pm.
B Le pourcentage de caractère ionique est donné par le rapport entre la charge réelle et la charge d’un électron unique (la charge attendue pour le transfert complet d’un électron) :
% de caractère ionique = ( 1.272 × 10 -19 C 1,6022 × 10 -19 C ) ( 100 ) = 79,39 % ≃ 79 %
Exercice
En phase gazeuse, le chlorure d’argent (AgCl) a un moment dipolaire de 6,08 D et une distance Ag-Cl de 228,1 pm. Quel est le pourcentage de caractère ionique dans le chlorure d’argent ?
Réponse : 55,5%
Résumé
Les composés ayant des liaisons covalentes polaires ont des électrons qui sont partagés de façon inégale entre les atomes liés. La polarité d’une telle liaison est déterminée en grande partie par les électronégativités relatives des atomes liés. La répartition asymétrique des charges dans une substance polaire produit un moment dipolaire, qui est le produit des charges partielles des atomes liés et de la distance qui les sépare.
Clef à retenir
- La polarité des liaisons et le caractère ionique augmentent avec une différence croissante d’électronégativité.
Équation clef
Moment dipolaire
Équation 8.16 : µ = Qr
Problèmes conceptuels
-
Pourquoi les composés ioniques tels que le KI présentent-ils un caractère ionique sensiblement inférieur à 100% en phase gazeuse ?
-
Parmi les composés LiI et LiF, lequel se comporterait le plus comme un composé ionique classique ? Lequel aurait le plus grand moment dipolaire en phase gazeuse ? Expliquez vos réponses.
Problèmes numériques
-
Prédisez si chaque composé est purement covalent, purement ionique ou covalent polaire.
- RbCl
- S8
- TiCl2
- SbCl3
- LiI
- Br2
-
Selon les électronégativités relatives, classez la liaison dans chaque composé comme ionique, covalente ou covalente polaire. Indiquez la direction du dipôle de liaison pour chaque liaison covalente polaire.
- NO
- HF
- MgO
- AlCl3
- SiO2
- la liaison C=O dans l’acétone
- O3
-
Selon les électronégativités relatives, classez la liaison dans chaque composé comme ionique, covalente ou covalente polaire. Indiquez la direction du dipôle de liaison pour chaque liaison covalente polaire.
- NaBr
- OF2
- BCl3
- la liaison S-S dans CH3CH2SSCH2CH3
- la liaison C-Cl dans CH2Cl2
- la liaison O-H dans CH3OH
- PtCl42-
.
-
Classez chaque espèce comme ayant un caractère ionique de 0%-40%, 40 %-60 % de caractère ionique, ou 60 %-100 % de caractère ionique en fonction du type de liaison auquel vous vous attendez. Justifiez votre raisonnement.
- CaO
- S8
- AlBr3
- ICl
- Na2S
- SiO2
- LiBr
-
Si la distance de liaison dans HCl (moment dipolaire = 1.109 D) était le double de la valeur réelle de 127,46 pm, quel serait l’effet sur la charge localisée sur chaque atome ? Quel serait le pourcentage de charge négative sur Cl ? À la distance de liaison réelle, comment le fait de doubler la charge sur chaque atome affecterait-il le moment dipolaire ? Cela représenterait-il un caractère plus ionique ou covalent ?
-
Calculez le pourcentage de caractère ionique de HF (moment dipolaire = 1.826 D) si la distance de la liaison H-F est de 92 pm.
-
Calculez le caractère ionique en pourcentage de CO (moment dipolaire = 0,110 D) si la distance C-O est de 113 pm.
-
Calculez le caractère ionique en pourcentage de PbS et PbO en phase gazeuse, compte tenu des informations suivantes : pour PbS, r = 228,69 pm et µ = 3.59 D ; pour PbO, r = 192,18 pm et µ = 4,64 D. Classeriez-vous ces composés comme ayant des liaisons covalentes ou polaires à l’état solide ?