双極子モーメント
HClのような極性物質の非対称な電荷分布は、結合原子上の部分電荷Qと部分電荷間の距離rの積:μ=Qr、ここでQはクーロム(C)、rはメートル(m)、ギリシャ文字のミュー(μ)で略されます双極子モーメントを発生させます。 双極子モーメントは結合した原子の部分電荷Qと部分電荷間の距離rの積として定義されます:
式 8.16
μ = Qr
ここでQはクーロム(C)、rはメーターで測定されます。 双極子モーメントの単位はデバイ(D):
式 8.17
1 D = 3.3356 × 10-30 C-m
双極子モーメントを持つ分子を電場に置くと、その非対称電荷分布から電場方向に向く傾向があります(図8.1)。8254>
図8.13 双極子モーメントを持つ分子は電界をかけると部分的に整列する
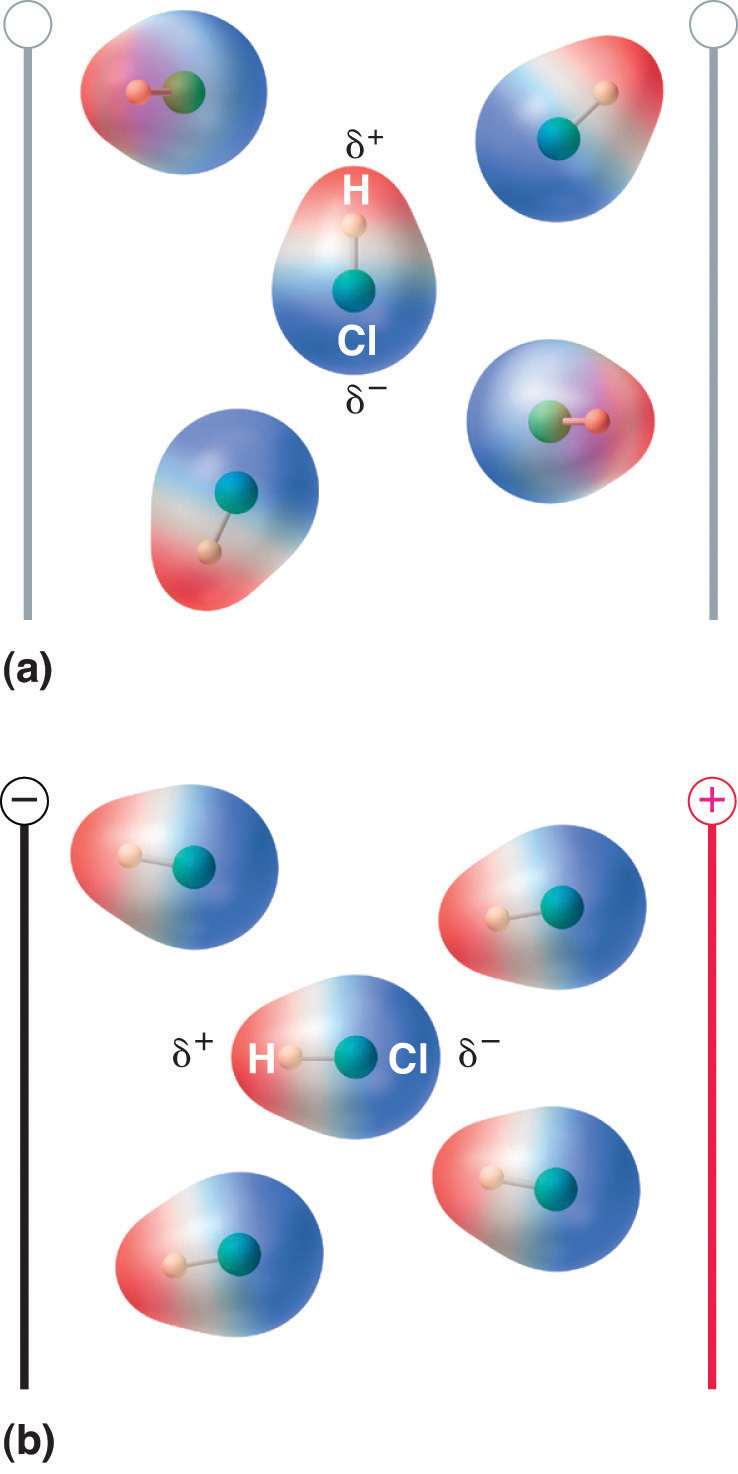
電界がない場合(a)、HCl分子はランダムに配向している。 電界をかけると(b)、分子は電界に整列する傾向があり、分子双極子のプラス端がマイナス端の方を向き、逆もまた同様である。
HClなどの分子の原子上の部分電荷は式8.16を用いて測定することができます。 HClの結合が純粋なイオン結合であれば、電子はHからClに移動するので、H原子には完全に+1、Cl原子には完全に-1の電荷が存在することになります。 HClの双極子モーメントは1.109 Dであり、電場中での配列の程度を測定することによって決定され、気相でのH-Cl距離は127.5 pmであると報告されている。 したがって各原子の電荷は
式 8.18
Q = μ r = 1.109 D ( 3.3356 × 10 -30 C – m 1 D ) ( 1 127.5 pm ) ( 1 pm 10 -12 m ) = 2.901 × 10 -20 C
この計算値を電子1個にかかる電荷(1.10 D)で割ると、1.10 D = 1.901 × 10 -20 Cとなる。8254>
式 8.19
2.901 × 10 -20 C 1.6022 × 10 -19 C /e – = 0.1811 e –
中性化合物を形成するには、H原子の電荷は等しいが反対でなければなりません。 したがって、HClの測定された双極子モーメントは、H-Cl結合が約18%のイオン性(0.1811×100)、または82%の共有結合性を持つことを示します。 HClをHδ+-Clδ-と書く代わりに、 H 0 .18 δ + – Cl 0 .18 δ –
この計算結果は、水素と塩素の電気陰性度の差χH = 2.20; χCl = 3.16, χCl -χH = 0.96) という極性共有結合の範囲内の値で一致する。 数学的には、双極子モーメントはベクトルであり、大きさと方向の両方を持つ。 分子の双極子モーメントは、個々の結合の双極子のベクトル和である。 例えばHClの場合、双極子モーメントは次のように示されます。
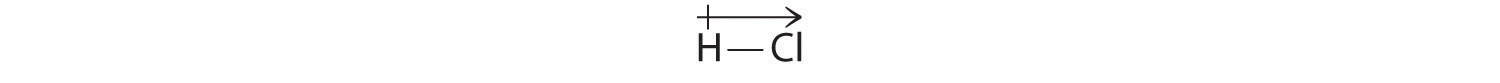
矢印は、より電気陰性の原子を指すことで電子の流れの方向を示しています。 図8.14「A Plot of the Percent Ionic Character of a Bond as Determined from Measured Dipole Moments versus the Difference in Electronegativity of the Bond」は、いくつかの物質のイオン性の割合と結合原子の電気陰性度の差のプロットを示したものである。 このグラフによると、NaCl(g)やCsF(g)などの種の結合は、100%イオン性よりもかなり小さいことがわかります。 しかし、気体が凝縮して固体になると、分極した種間の双極子-双極子相互作用により、電荷分離が大きくなる。 したがって、結晶中では、金属から非金属に電子が移動し、これらの物質は古典的なイオン化合物のように振る舞います。 図8.14「測定した双極子モーメントから求めた結合のイオン性の割合と結合原子の電気陰性度の差のプロット」のデータは、電気陰性度の差が1.5未満の2原子種はイオン性が50%未満であることを示しており、これらの種は極性共有結合を含むという前述の説明と一致しています。 図8.14 双極子モーメントから求めた結合のイオン性の割合と結合原子の電気陰性度の差のプロット
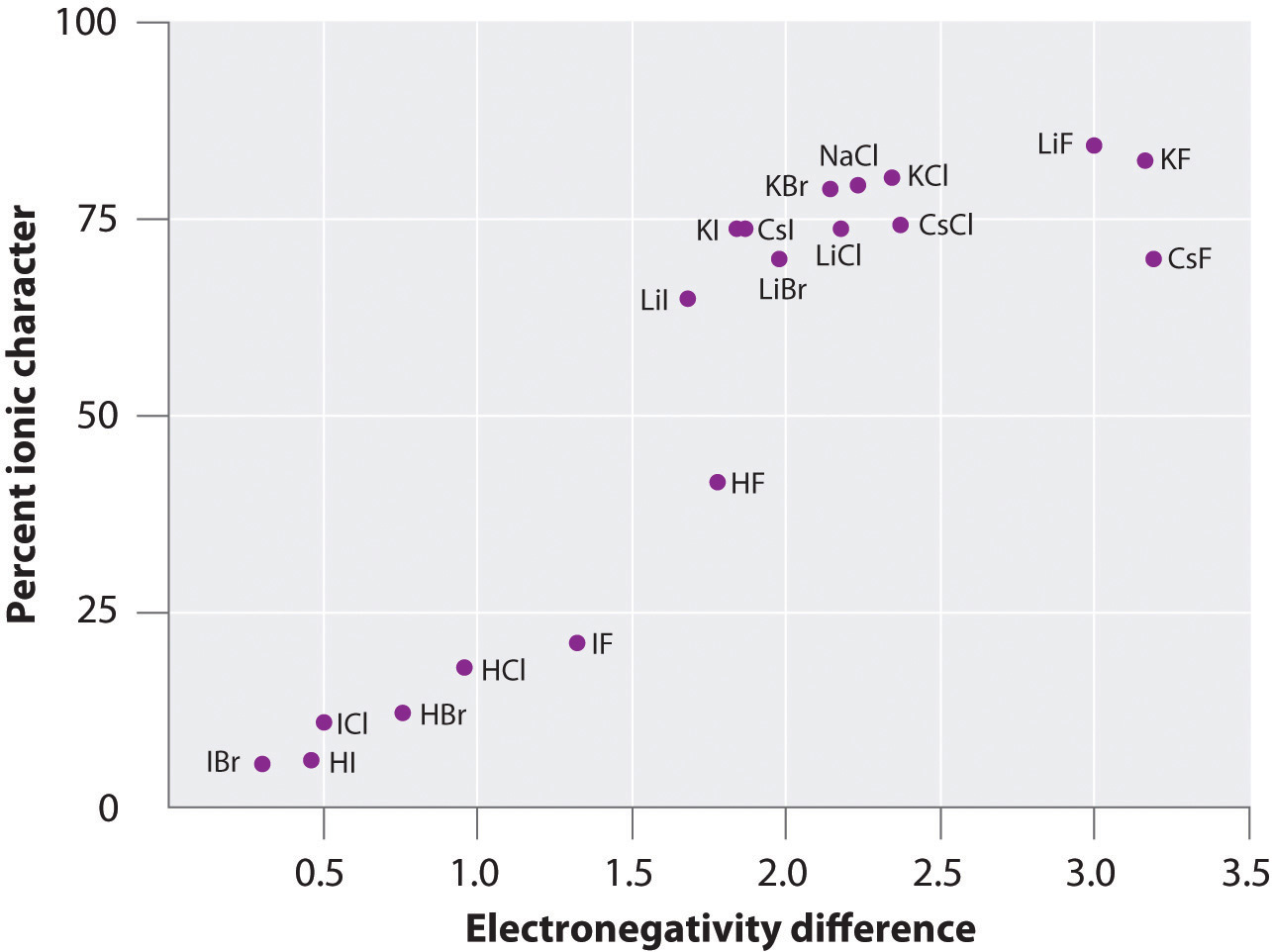
気相では、原子間の電気陰性度の差が最も大きいCsFでさえ100%イオン性ではありませんが、極性結合のイオン性については、双極子モーメントを用いることにより決定することができます。
例11
気相では、NaClは双極子モーメント9.001D、Na-Cl距離236.1pmであった。 NaClのパーセントイオン性を計算せよ。
与えられるもの:化学種、双極子モーメント、核間距離
求められるもの:パーセントイオン性
戦略。
A 与えられた情報と式8.16を用いて各原子の電荷を計算する。
B 実際の電荷と単一電子の電荷の比からパーセントイオン性を求める。
解答を求める。
A 各原子の電荷は
Q = μ r = 9.001 D ( 3.3356 × 10 -30 C – m 1 D ) ( 1 236.1 pm ) ( 1 pm 10 -12 m ) = 1 . 2 7 2 × 1 0 -19 C
したがって、NaClは236.1 pm離れた各原子上に1.272 × 10-19 Cの電荷を持っているかのようにふるまう。
B イオン性パーセントは、実際の電荷と1個の電子の電荷(1個の電子が完全に移動したときに予想される電荷)の比で与えられます:
イオン性パーセント = ( 1.272 × 10 -19 C 1.6022 × 10 -19 C ) ( 100 ) = 79.39 % ≃ 79 %
演習
気相中の塩化銀(AgCl)は、6.08Dの双極子モーメントとAg-Cl距離228.1 pmを持つ。 塩化銀のイオン性は何パーセントですか
答え。 55.5%
まとめ
極性共有結合を持つ化合物は、結合した原子間で不均等に共有される電子を持ちます。 このような結合の極性は、結合した原子の相対的な電気陰性度によってほぼ決定される。 極性物質における非対称な電荷分布は、結合した原子上の部分電荷と原子間の距離の積である双極子モーメントを生じさせる。
Key Takeaway
- 結合極性およびイオン特性は電気陰性度の差が大きくなると増加する。
Key Equation
Dipole moment
式 8.16: µ = Qr
Conceptual Problems
-
なぜKIなどのイオン性化合物は気相で100%よりかなり少ないイオン性を示すのか?
-
LiIとLiFのうちどちらかというと古典的イオン性化合物に似た挙動をすると思われるだろうか? また、気相ではどちらの方が大きな双極子モーメントを持つでしょうか。 8254>
数値問題
-
それぞれの化合物が純粋共有結合、純粋イオン結合、または極性共有結合であるかを予測しなさい。
- RbCl
- S8
- TiCl2
- SbCl3
- LiI
- Br2
-
相対電気陰性度から判断して。 各化合物の結合を、イオン結合、共有結合、極性共有結合に分類しなさい。 各極性共有結合の結合双極子の向きを示せ。
- NO
- HF
- MgO
- AlCl3
- SiO2
- C=O結合は? アセトン
- O3
-
相対電気陰性度に基づいている。 各化合物の結合を、イオン結合、共有結合、極性共有結合に分類しなさい。 各極性共有結合の結合双極子の向きを示せ。
- NaBr
- OF2
- BCl3
- CH3CH2SSCH2CH3
- CH2Cl2
- the O-H bond in CH3OH
- PtCl42-
のC-Cl結合のS-S結合
-
それぞれの種を0%-40%のイオン性で分類してください。 40%〜60%のイオン性、または60%〜100%のイオン性を、あなたが予想する結合の種類に基づいて判断してください。 また、その理由を説明しなさい。
- CaO
- S8
- AlBr3
- ICl
- Na2S
- SiO2
- LiBr
-
もしHClの結合距離(双極子モーメント=1.109 D)が実際の値127.46 pmの2倍であったとしたら、各原子に局在する電荷にどのような影響を及ぼすでしょうか。 Clの負電荷は何パーセントになるか? 実際の結合距離で、各原子の電荷を2倍にすると、双極子モーメントにどのような影響があるでしょうか?
-
HFのイオン性(双極子モーメント=1.0)を計算しなさい。826 D)、H-F結合距離は92 pmです。
-
C-O距離が113 pmである場合、CO(双極子モーメント= 0.110 D)のパーセントイオン特性を計算する。
-
気相でのPbSとPbOのイオン性を、次の情報から計算しなさい:PbSについては、r = 228.69 pmおよびμ = 3.これらの化合物は固相では共有結合と極性共有結合のどちらに分類されるか。