Dipólusmomentumok
Az aszimmetrikus töltéseloszlás egy poláris anyagban, mint például a HCl, dipólusmomentumot eredményezA kötött atomok Q parciális töltésének és a parciális töltések közötti r távolságnak a szorzata: µ=Qr, ahol Q-t coulombban (C), r-t pedig méterben (m) mérik, a görög mu (µ) betűvel rövidítve. A dipólusmomentumot a kötött atomok Q parciális töltésének és a parciális töltések közötti r távolságnak a szorzataként határozzuk meg:
8.16. egyenlet
µ = Qr
ahol Q-t coulombban (C) és r-t méterben mérjük. A dipólusmomentumok mértékegysége a debye (D):
egyenlet 8.17
1 D = 3,3356 × 10-30 C-m
Mikor egy dipólusmomentummal rendelkező molekulát elektromos térbe helyezünk, aszimmetrikus töltéseloszlása miatt hajlamos az elektromos térrel együtt orientálódni (8. ábra.13. “A dipólusmomentummal rendelkező molekulák részben igazodnak az alkalmazott elektromos térhez”).
8.13. ábra A dipólusmomentummal rendelkező molekulák részben igazodnak az alkalmazott elektromos térhez
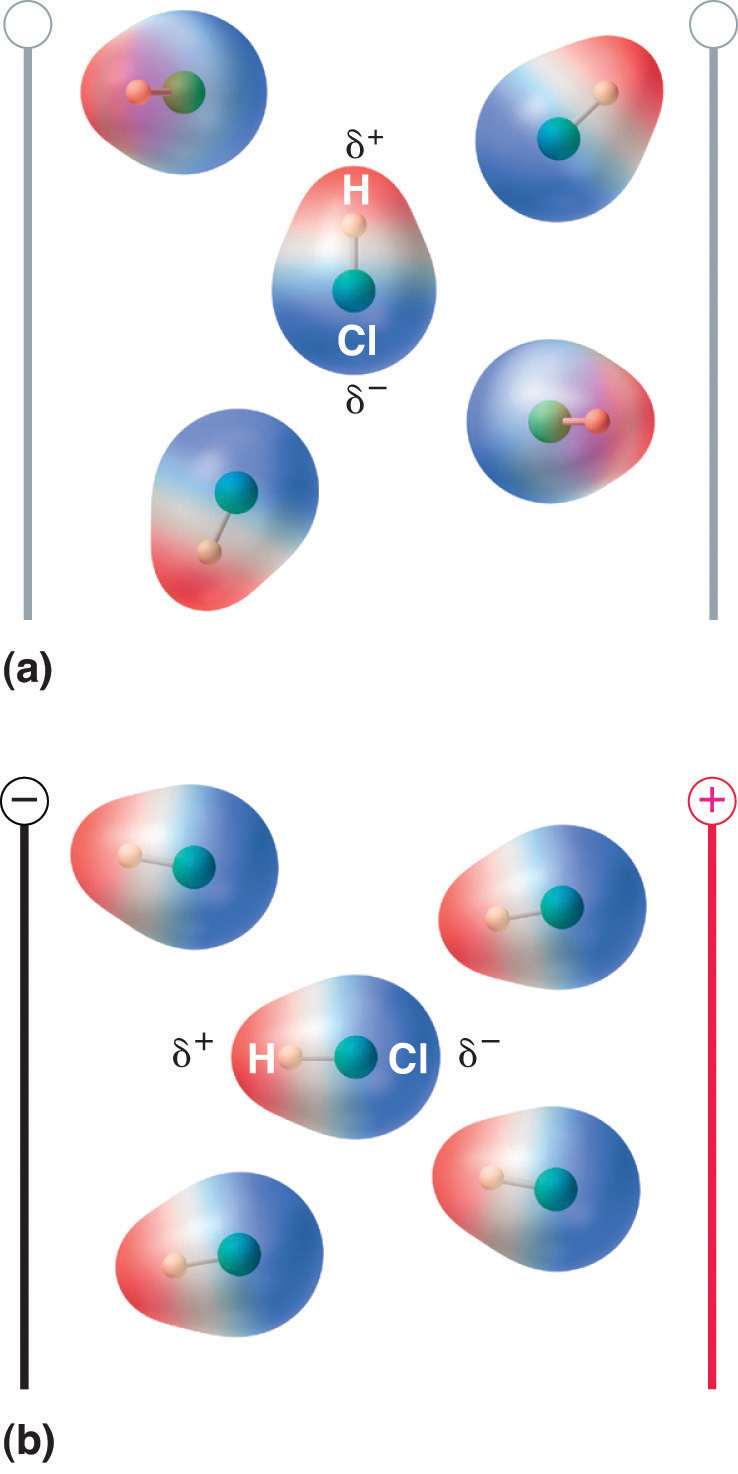
A mező hiányában (a) a HCl-molekulák véletlenszerűen orientálódnak. Ha elektromos teret alkalmazunk (b), a molekulák hajlamosak a mezőhöz igazodni, úgy, hogy a molekuláris dipólus pozitív vége a negatív végpont felé mutat, és fordítva.
A 8.16. egyenlet segítségével megmérhetjük egy olyan molekula atomjainak parciális töltéseit, mint a HCl. Ha a HCl-ben a kötés tisztán ionos lenne, akkor egy elektron átkerülne H-ról Cl-re, így a H atomon teljes +1 töltés, a Cl atomon pedig teljes -1 töltés lenne. A HCl dipólusmomentuma 1,109 D, amit az elektromos mezőben való igazodás mértékének mérésével határozunk meg, és a bejelentett gázfázisú H-Cl távolság 127,5 pm. Az egyes atomok töltése tehát
egyenlet 8.18
Q = μ r = 1,109 D ( 3,3356 × 10 -30 C – m 1 D ) ( 1 127,5 pm ) ( 1 pm 10 -12 m ) = 2,901 × 10 -20 C
Ezt a számított értéket elosztva az egyetlen elektron töltésével (1 .6022 × 10-19 C), azt kapjuk, hogy a HCl-molekula Cl atomjának töltése kb. -0,18, ami kb. 0,18 e-nek felel meg:
egyenlet 8.19
2,901 × 10 -20 C 1,6022 × 10 -19 C /e – = 0,1811 e –
A semleges vegyület kialakításához a H atom töltésének egyenlőnek, de ellentétesnek kell lennie. Így a HCl mért dipólusmomentuma azt mutatja, hogy a H-Cl kötés kb. 18%-ban ionos jellegű (0,1811 × 100), vagy 82%-ban kovalens jellegű. Ahelyett, hogy a HCl-t Hδ+-Clδ-nek írnánk, a töltésszétválasztást tehát kvantitatív módon így adhatjuk meg:
H 0 ,18 δ + – Cl 0 ,18 δ –
Kiszámított eredményeink összhangban vannak a hidrogén és a klór közötti elektronegativitáskülönbséggel χH = 2,20; χCl = 3,16, χCl – χH = 0,96), ami a poláros kovalens kötésekre jellemző értékeken belül van. A dipólusmomentumot a molekula fölé írt nyíllal jelöljük. matematikailag a dipólusmomentumok vektorok, amelyeknek van nagyságuk és irányuk is. A molekula dipólusmomentuma az egyes kötések dipólusainak vektoros összege. A HCl-ben például a dipólusmomentum a következőképpen van feltüntetve:
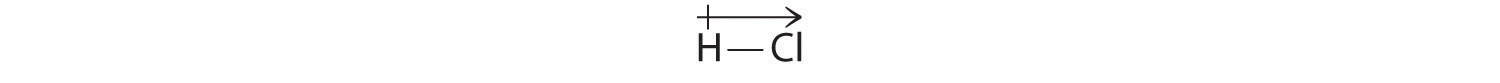
A nyíl az elektronáramlás irányát mutatja azáltal, hogy az elektronegatívabb atom felé mutat.
A gázfázisban sok anyag atomjainak töltése kiszámítható a mért dipólusmomentumok és kötéstávolságok segítségével. A 8.14. ábra “A kötés százalékos ionos jellegének ábrázolása a mért dipólusmomentumok alapján a kötött atomok elektronegativitásának különbségével szemben” című ábrán több anyag esetében látható a kötés százalékos ionos jellegének ábrázolása a kötött atomok elektronegativitásának különbségével szemben. A grafikon szerint az olyan fajok kötése, mint a NaCl(g) és a CsF(g), lényegesen kisebb, mint 100%-ban ionos jellegű. Ahogy azonban a gáz szilárd anyaggá sűrűsödik, a polarizált fajok közötti dipólus-dipólus kölcsönhatások növelik a töltéskülönbségeket. A kristályban tehát egy elektron átkerül a fémből a nemfémbe, és ezek az anyagok klasszikus ionos vegyületekként viselkednek. A 8.14. ábra “A kötés ionos jellegének százalékos ábrázolása a mért dipólusmomentumok alapján a kötött atomok elektronegativitásának különbsége függvényében” című ábrájának adatai azt mutatják, hogy az 1,5-nél kisebb elektronegativitáskülönbségű kétatomos fajok kevesebb, mint 50%-ban ionos jellegűek, ami összhangban van azzal a korábbi leírásunkkal, hogy ezek a fajok poláris kovalens kötéseket tartalmaznak. A dipólusmomentumok használatát egy poláris kötés ionos jellegének meghatározására a 11. példa szemlélteti.
8.14. ábra A kötés ionos jellegének százalékos ábrázolása a mért dipólusmomentumok alapján a kötött atomok elektronegativitásának különbségével szemben
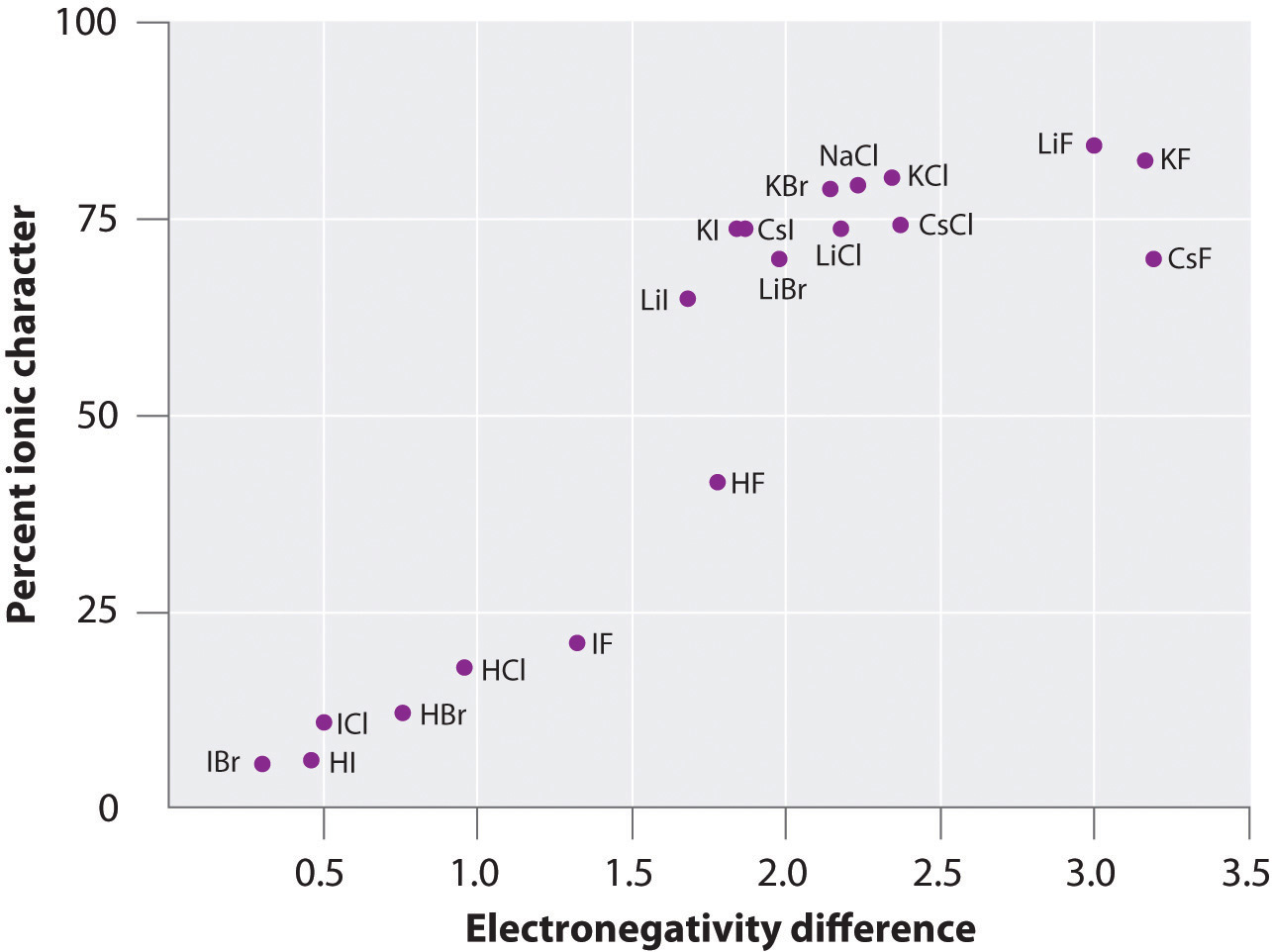
A gázfázisban még a CsF sem 100%-ban ionos, amelynek az atomok közötti elektronegativitáskülönbsége a lehető legnagyobb. A szilárd CsF azonban a rácsban lévő további elektrosztatikus kölcsönhatások miatt leginkább 100%-ban ionosnak tekinthető.
11. példa
A gázfázisban a NaCl dipólusmomentuma 9,001 D, Na-Cl távolsága pedig 236,1 pm. Számítsuk ki a NaCl százalékos ionos jellegét.
Adott: kémiai faj, dipólusmomentum és belső magtávolság
Kérdés: százalékos ionos jelleg
Stratégia:
A Számítsa ki az egyes atomok töltését a megadott információk és a 8.16. egyenlet segítségével.
B Határozza meg a százalékos ionjelleget a tényleges töltés és az egyetlen elektron töltésének arányából.
Megoldás:
A Az egyes atomok töltését a
Q = μ r = 9,001 D ( 3,3356 × 10 -30 C – m 1 D ) ( 1 236,1 pm ) ( 1 pm 10 -12 m ) = 1 . 2 7 2 × 1 0 -19 C
A NaCl tehát úgy viselkedik, mintha az egyes atomokon 1,272 × 10-19 C töltés lenne 236,1 pm távolságban egymástól.
B A százalékos ionkaraktert a tényleges töltés és az egyetlen elektron töltésének (az egy elektron teljes átadásakor várható töltés) aránya adja meg:
% ionkarakter = ( 1.272 × 10 -19 C 1,6022 × 10 -19 C ) ( 100 ) = 79,39 % ≃ 79 %
GYakorlat
A gázfázisban az ezüstklorid (AgCl) dipólusmomentuma 6,08 D, az Ag-Cl távolság 228,1 pm. Mekkora az ezüst-klorid százalékos ionjellege?
Válasz: Az ezüst-klorid ionjellegének százalékos aránya az ezüst-kloridban? 55,5%
Összefoglaló
A poláros kovalens kötéssel rendelkező vegyületek elektronjai egyenlőtlenül oszlanak meg a kötött atomok között. Az ilyen kötés polaritását nagyrészt a kapcsolt atomok relatív elektronegativitása határozza meg. Az aszimmetrikus töltéseloszlás egy poláris anyagban dipólusmomentumot eredményez, amely a kötött atomok parciális töltéseinek és a köztük lévő távolságnak a szorzata.
Főbb tanulság
- A kötés polaritása és ionos jellege az elektronegativitáskülönbség növekedésével nő.
Főbb egyenlet
Dipolmomentum
8. egyenlet.16: µ = Qr
Konceptuális problémák
-
Miért mutatnak az olyan ionos vegyületek, mint a KI, gázfázisban lényegesen kevesebb, mint 100%-os ionos jelleget?
-
A LiI és LiF vegyületek közül melyikről várná, hogy inkább klasszikus ionos vegyületként viselkedik? Melyiknek lenne nagyobb a dipólusmomentuma a gázfázisban? Magyarázza meg válaszát.
Numerikus feladatok
-
Jósolja meg, hogy az egyes vegyületek tisztán kovalens, tisztán ionos vagy poláros kovalens vegyületek-e!
- RbCl
- S8
- TiCl2
- SbCl3
- LiI
- Br2
-
A relatív elektronegativitások alapján, osztályozza az egyes vegyületek kötéseit ionos, kovalens vagy poláros kovalens kötésként. Adja meg a kötés dipólusának irányát minden poláros kovalens kötés esetében.
- NO
- HF
- MgO
- AlCl3
- SiO2
- a C=O kötés. az acetonban
- O3
-
A relatív elektronegativitások alapján, osztályozza az egyes vegyületek kötéseit ionos, kovalens vagy poláros kovalens kötésként. Adja meg a kötés dipólusának irányát minden poláros kovalens kötés esetében.
- NaBr
- OF2
- BCl3
- az S-S kötés a CH3CH2SSCH2CH3-ban
- a C-Cl kötés a CH2Cl2-ben
- az O-H kötés a CH3OH-ban
- PtCl42-
.
-
osztályozza az egyes fajokat 0%-40%-os ionos jelleggel, 40%-60%-os ionos jelleggel, vagy 60%-100%-os ionos jelleggel a várható kötés típusa alapján. Indokolja az érvelését.
- CaO
- S8
- AlBr3
- ICl
- Na2S
- SiO2
- LiBr
-
Ha a kötéstávolság a HCl-ben (dipólusmomentum = 1.109 D) kétszerese lenne a tényleges 127,46 pm értéknek, milyen hatással lenne az egyes atomokra lokalizált töltésre? Mennyi lenne a Cl százalékos negatív töltése? A tényleges kötéstávolság mellett hogyan befolyásolná az egyes atomok töltésének megduplázása a dipólusmomentumot? Ez inkább ionos vagy kovalens jelleget képviselne?
-
Kalkulálja ki a HF százalékos ionos jellegét (dipólusmomentum = 1.826 D), ha a H-F kötéstávolság 92 pm.
-
Kalkulálja ki a CO százalékos ionos jellegét (dipólusmomentum = 0,110 D), ha a C-O távolság 113 pm.
-
Kalkulálja ki a PbS és a PbO százalékos ionjellegét a gázfázisban a következő információk birtokában: PbS esetében r = 228,69 pm és µ = 3.59 D; a PbO esetében r = 192,18 pm és µ = 4,64 D. A szilárd halmazállapotban kovalens vagy poláris kovalens kötésekkel rendelkező vegyületek közé sorolná ezeket a vegyületeket?