Dipolmomenter
Den asymmetriske ladningsfordeling i et polært stof som HCl giver et dipolmomentProduktet af den partielle ladning Q på de bundne atomer og afstanden r mellem de partielle ladninger: µ=Qr, hvor Q er målt i coulomb (C) og r i meter (m), forkortet med det græske bogstav mu (µ). Dipolmomentet er defineret som produktet af partialladningen Q på de bundne atomer og afstanden r mellem partialladningerne:
Geligning 8.16
µ = Qr
hvor Q er målt i coulomb (C) og r i meter. Enheden for dipolmomenter er debye (D):
Sammenligning 8.17
1 D = 3,3356 × 10-30 C-m
Når et molekyle med et dipolmoment placeres i et elektrisk felt, har det en tendens til at orientere sig med det elektriske felt på grund af sin asymmetriske ladningsfordeling (Figur 8.13 “Molekyler, der besidder et dipolmoment, retter sig delvist ind efter et påført elektrisk felt”).
Figur 8.13 Molekyler, der besidder et dipolmoment, retter sig delvist ind efter et påført elektrisk felt
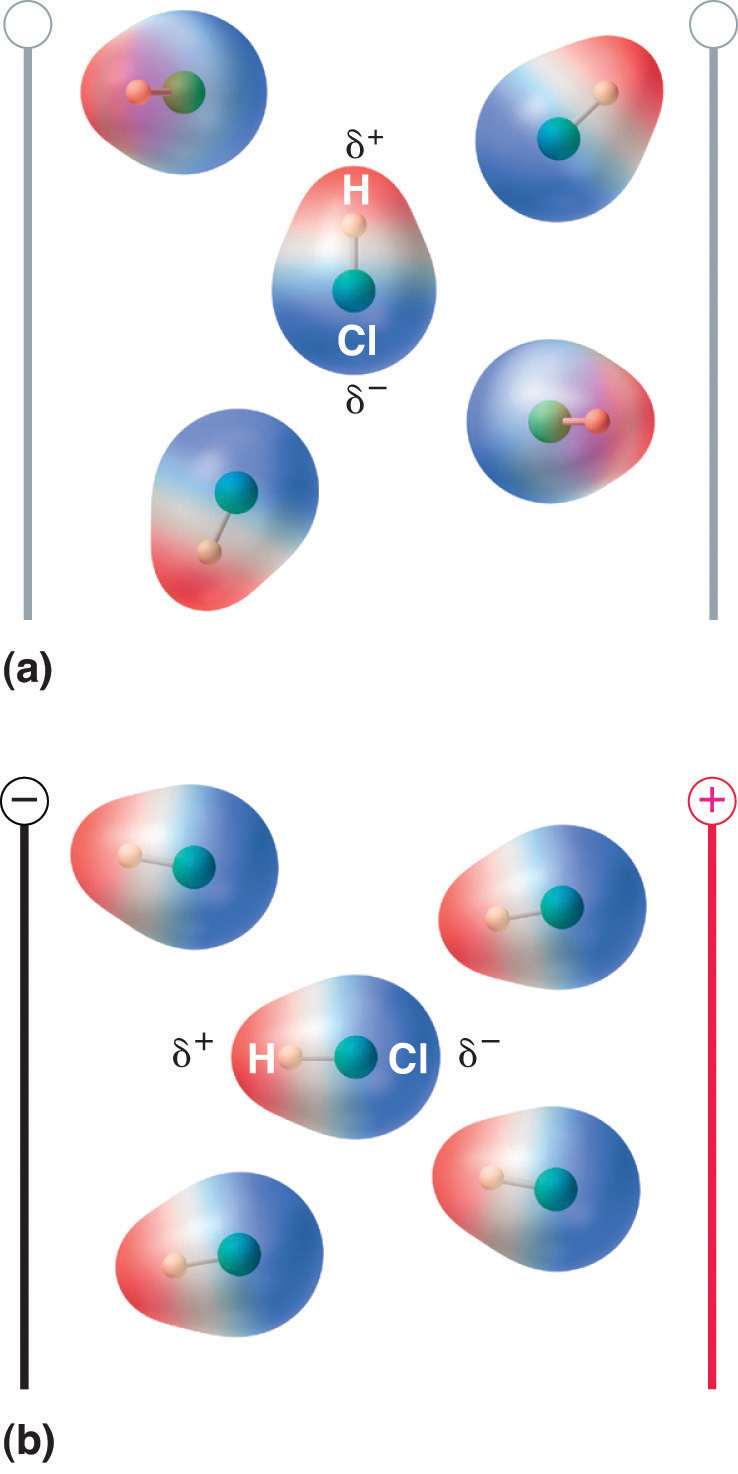
I fravær af et felt (a) er HCl-molekylerne tilfældigt orienteret. Når der påføres et elektrisk felt (b), har molekylerne en tendens til at rette sig ind efter feltet, således at den positive ende af den molekylære dipol peger mod den negative terminal og omvendt.
Vi kan måle de partielle ladninger på atomerne i et molekyle som HCl ved hjælp af ligning 8.16. Hvis bindingen i HCl var rent ionisk, ville der blive overført en elektron fra H til Cl, så der ville være en fuld +1 ladning på H-atomet og en fuld -1 ladning på Cl-atomet. HCl’s dipolmoment er 1,109 D, som bestemmes ved at måle omfanget af dets tilpasning i et elektrisk felt, og den rapporterede H-Cl-afstand i gasfasen er 127,5 pm. Derfor er ladningen på hvert atom
Geligning 8.18
Q = μ r = 1,109 D ( 3,3356 × 10 -30 C – m 1 D ) ( 1 127,5 pm ) ( 1 pm 10 -12 m ) = 2,901 × 10 -20 C
Gennem at dividere denne beregnede værdi med ladningen på en enkelt elektron (1.6022 × 10-19 C), finder vi, at ladningen på Cl-atomet i et HCl-molekyle er ca. -0,18, svarende til ca. 0,18 e-:
Bedømmelse 8.19
2,901 × 10 -20 C 1,6022 × 10 -19 C /e – = 0,1811 e –
For at danne en neutral forbindelse skal ladningen på H-atomet være lige stor, men modsatrettet. Det målte dipolmoment for HCl viser således, at H-Cl-bindingen har ca. 18% ionisk karakter (0,1811 × 100), eller 82% kovalent karakter. I stedet for at skrive HCl som Hδ+-Clδ- kan vi derfor angive ladningsadskillelsen kvantitativt som
H 0 ,18 δ + – Cl 0 ,18 δ –
Vores beregnede resultater er i overensstemmelse med elektronegativitetsforskellen mellem hydrogen og klor χH = 2,20; χCl = 3,16, χCl – χH = 0,96), en værdi, der ligger godt inden for intervallet for polære kovalente bindinger. Vi angiver dipolmomentet ved at skrive en pil over molekylet. matematisk set er dipolmomenter vektorer, og de besidder både en størrelse og en retning. Et molekyls dipolmoment er vektorsummen af dipolerne for de enkelte bindinger. I HCl er dipolmomentet f.eks. angivet på følgende måde:
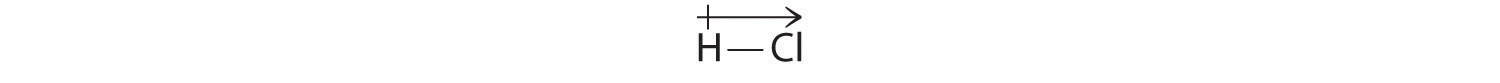
Pilen viser elektronstrømmenes retning ved at pege mod det mere elektronegative atom.
Ladningen på atomerne i mange stoffer i gasfasen kan beregnes ved hjælp af målte dipolmomenter og bindingsafstande. Figur 8.14 “A Plot of the Percent Ionic Character of a Bond as Determined from Measured Dipole Moments versus the Difference in Electronegativity of the Bonded Atoms” viser et plot af den procentvise ioniske karakter versus forskellen i elektronegativitet af de bundne atomer for flere stoffer. Ifølge grafen er bindingen i arter som NaCl(g) og CsF(g) væsentligt mindre end 100 % ionisk af karakter. Når gassen kondenserer til et fast stof, øger dipol-dipol-interaktioner mellem polariserede arter imidlertid ladningsadskillelserne. I krystallen overføres der derfor en elektron fra metallet til ikke-metallet, og disse stoffer opfører sig som klassiske ionforbindelser. Dataene i figur 8.14 “A Plot of the Percent Ionic Character of a Bond as Determined from Measured Dipole Moments versus the Difference in Electronegativity of the Bonded Atoms” viser, at diatomare arter med en elektronegativitetsforskel på mindre end 1,5 har mindre end 50% ionisk karakter, hvilket er i overensstemmelse med vores tidligere beskrivelse af disse arter som indeholdende polære kovalente bindinger. Brugen af dipolmomenter til at bestemme den ioniske karakter af en polær binding illustreres i eksempel 11.
Figur 8.14 A Plot of the Percent Ionic Character of a Bond as Determined from Measured Dipole Moments versus the Difference in Electronegativity of the Bonded Atoms
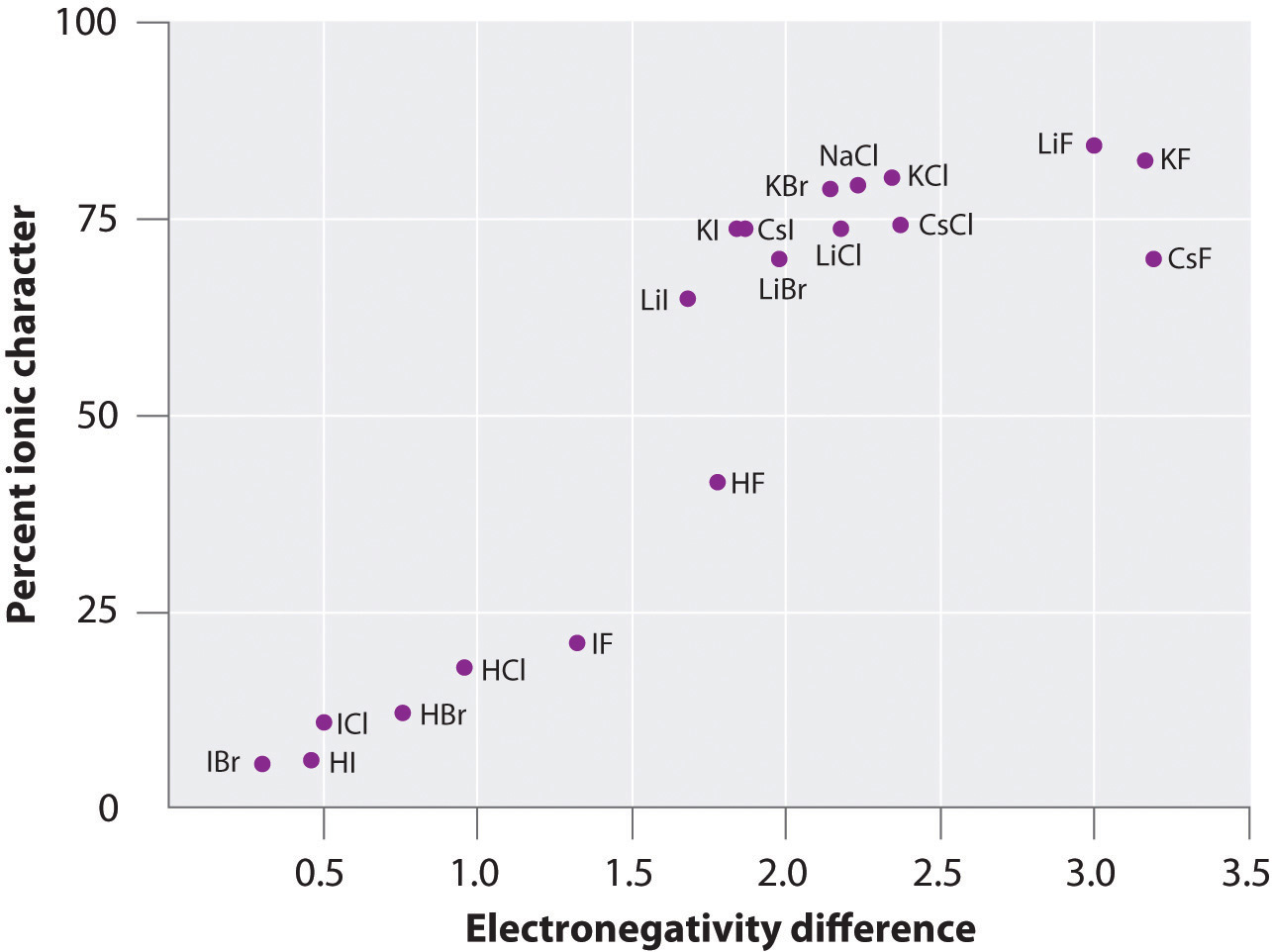
I gasfasen er selv CsF, som har den størst mulige forskel i elektronegativitet mellem atomerne, ikke 100% ionisk. Fast CsF betragtes dog bedst som 100 % ionisk på grund af de ekstra elektrostatiske vekselvirkninger i gitteret.
Eksempel 11
I gasfasen har NaCl et dipolmoment på 9,001 D og en Na-Cl-afstand på 236,1 pm. Beregn den procentvise ioniske karakter i NaCl.
Givet: kemisk art, dipolmoment og mellemkerneafstand
Spørgsmål: procentvis ionisk karakter
Strategi:
A Beregn ladningen på hvert atom ved hjælp af de givne oplysninger og ligning 8.16.
B Find den procentvise ioniske karakter ud fra forholdet mellem den faktiske ladning og ladningen af en enkelt elektron.
Løsning:
A Ladningen på hvert atom er givet ved
Q = μ r = 9,001 D ( 3,3356 × 10 -30 C – m 1 D ) ( 1 236,1 pm ) ( 1 pm 10 -12 m ) = 1 . 2 7 2 × 1 0 -19 C
Dermed opfører NaCl sig som om det havde ladninger på 1,272 × 10-19 C på hvert atom, der er adskilt af 236,1 pm.
B Den procentvise ioniske karakter er givet ved forholdet mellem den faktiske ladning og ladningen af en enkelt elektron (den ladning, der forventes ved fuldstændig overførsel af en elektron):
% ionisk karakter = ( 1.272 × 10 -19 C 1,6022 × 10 -19 C ) ( 100 ) = 79,39 % ≃ 79 %
Ovelse
I gasfasen har sølvklorid (AgCl) et dipolmoment på 6,08 D og en Ag-Cl-afstand på 228,1 pm. Hvad er den procentvise ioniske karakter i sølvchlorid?
Svar: 55,5%
Summarum
Forbindelser med polære kovalente bindinger har elektroner, der deles ulige mellem de bundne atomer. Polariteten af en sådan binding bestemmes i vid udstrækning af de bundne atomers relative elektronegativites. Den asymmetriske ladningsfordeling i et polært stof frembringer et dipolmoment, som er produktet af de partielle ladninger på de bundne atomer og afstanden mellem dem.
Nøgleudtryk
- Bindingspolaritet og ionisk karakter øges med en stigende forskel i elektronegativitet.
Nøgleligning
Dipolmoment
Sammenligning 8.16: µ = Qr
Begrebsmæssige problemer
-
Hvorfor viser ionforbindelser som KI væsentligt mindre end 100 % ionisk karakter i gasfasen?
-
Hvilken af forbindelserne LiI og LiF ville du forvente, at den ville opføre sig mest som en klassisk ionisk forbindelse? Hvilken ville have det største dipolmoment i gasfasen? Forklar dine svar.
Numeriske problemer
-
Forudsig, om hver forbindelse er rent kovalent, rent ionisk eller polært kovalent.
- RbCl
- S8
- TiCl2
- SbCl3
- LiI
- Br2
-
Baseret på de relative elektronegativiteter, klassificer bindingerne i hver forbindelse som ioniske, kovalente eller polære kovalente. Angiv retningen af bindingsdipolen for hver polær kovalent binding.
- NO
- HF
- MgO
- AlCl3
- SiO2
- C=O-bindingen i acetone
- O3
-
Baseret på de relative elektronegativiteter, klassificer bindingerne i hver forbindelse som ioniske, kovalente eller polære kovalente bindinger. Angiv retningen af bindingsdipolen for hver polær kovalent binding.
- NaBr
- OF2
- BCl3
- Den S-S-binding i CH3CH2SSCH2CH3
- Den C-Cl-binding i CH2Cl2
- O-H-bindingen i CH3OH
- PtCl42-
-
Klassificer hver art som havende 0-40% ionisk karakter, 40%-60% ionisk karakter, eller 60%-100% ionisk karakter baseret på den type binding, du ville forvente. Begrund din argumentation.
- CaO
- S8
- AlBr3
- ICl
- Na2S
- SiO2
- LiBr
-
Hvis bindingsafstanden i HCl (dipolmoment = 1.109 D) var dobbelt så stor som den faktiske værdi på 127,46 pm, hvilken virkning ville det have på den ladning, der er lokaliseret på hvert atom? Hvad ville være den procentvise negative ladning på Cl? Hvordan ville en fordobling af ladningen på hvert atom påvirke dipolmomentet ved den faktiske bindingsafstand? Ville dette repræsentere mere ionisk eller kovalent karakter?
-
Beregne den procentvise ioniske karakter af HF (dipolmoment = 1.826 D), hvis H-F-bindingsafstanden er 92 pm.
-
Beregne den procentvise ioniske karakter af CO (dipolmoment = 0,110 D), hvis C-O-afstanden er 113 pm.
-
Beregn den procentvise ioniske karakter af PbS og PbO i gasfasen, idet følgende oplysninger er givet: For PbS er r = 228,69 pm og µ = 3.59 D; for PbO er r = 192,18 pm og µ = 4,64 D. Ville du klassificere disse forbindelser som havende kovalente eller polære kovalente bindinger i fast tilstand?