Dipolmoment
Den asymmetriska laddningsfördelningen i en polär substans som HCl ger upphov till ett dipolmomentProdukten av den partiella laddningen Q på de bundna atomerna och avståndet r mellan de partiella laddningarna: µ=Qr, där Q mäts i coulomb (C) och r i meter (m), förkortat med den grekiska bokstaven mu (µ). Dipolmomentet definieras som produkten av den partiella laddningen Q på de bundna atomerna och avståndet r mellan de partiella laddningarna:
Ekvation 8.16
µ = Qr
där Q mäts i coulombs (C) och r i meter. Enheten för dipolmoment är debye (D):
Bedömning 8.17
1 D = 3,3356 × 10-30 C-m
När en molekyl med dipolmoment placeras i ett elektriskt fält tenderar den att orientera sig med det elektriska fältet på grund av sin asymmetriska laddningsfördelning (Figur 8.13 ”Molekyler som har ett dipolmoment orienterar sig delvis med ett anbringat elektriskt fält”).
Figur 8.13 Molekyler som har ett dipolmoment orienterar sig delvis med ett anbringat elektriskt fält
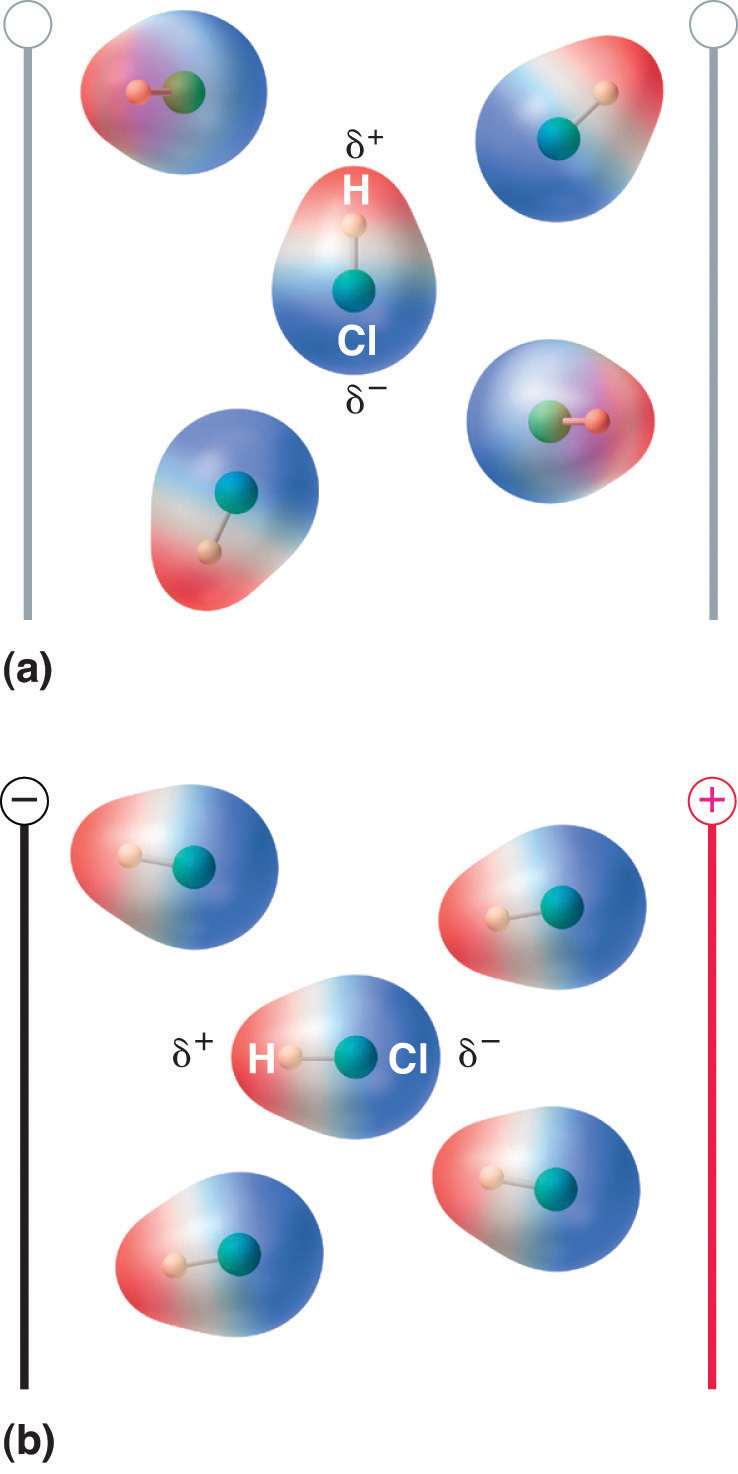
I avsaknad av ett fält (a) är HCl-molekylerna slumpmässigt orienterade. När ett elektriskt fält anbringas (b) tenderar molekylerna att anpassa sig till fältet, så att den positiva änden av den molekylära dipolen pekar mot den negativa terminalen och vice versa.
Vi kan mäta de partiella laddningarna på atomerna i en molekyl som HCl med hjälp av ekvation 8.16. Om bindningen i HCl var rent jonisk skulle en elektron överföras från H till Cl, så det skulle finnas en full +1-laddning på H-atomen och en full -1-laddning på Cl-atomen. HCl:s dipolmoment är 1,109 D, vilket bestäms genom att mäta omfattningen av dess inriktning i ett elektriskt fält, och det rapporterade avståndet mellan H och Cl i gasfasen är 127,5 pm. Därför är laddningen på varje atom
Bedömning 8.18
Q = μ r = 1,109 D ( 3,3356 × 10 -30 C – m 1 D ) ( 1 127,5 pm ) ( 1 pm 10 -12 m ) = 2,901 × 10 -20 C
Därvid dividerar man detta beräknade värde med laddningen på en enda elektron (1.6022 × 10-19 C) finner vi att laddningen på Cl-atomen i en HCl-molekyl är ca -0,18, vilket motsvarar ca 0,18 e-:
Ekvation 8.19
2,901 × 10 -20 C 1,6022 × 10 -19 C /e – = 0,1811 e –
För att bilda en neutral förening måste laddningen på H-atomen vara lika men motsatt. Det uppmätta dipolmomentet hos HCl indikerar således att H-Cl-bindningen har ungefär 18 % jonisk karaktär (0,1811 × 100) eller 82 % kovalent karaktär. Istället för att skriva HCl som Hδ+-Clδ- kan vi därför ange laddningsseparationen kvantitativt som
H 0 .18 δ + – Cl 0 .18 δ –
Våra beräknade resultat stämmer överens med elektronegativitetsskillnaden mellan väte och klor χH = 2,20; χCl = 3,16, χCl – χH = 0,96), ett värde som ligger väl inom området för polära kovalenta bindningar. Vi anger dipolmomentet genom att skriva en pil ovanför molekylen. matematiskt sett är dipolmoment vektorer, och de har både en storlek och en riktning. En molekyls dipolmoment är vektorsumman av de enskilda bindningarnas dipoler. I HCl, till exempel, anges dipolmomentet på följande sätt:
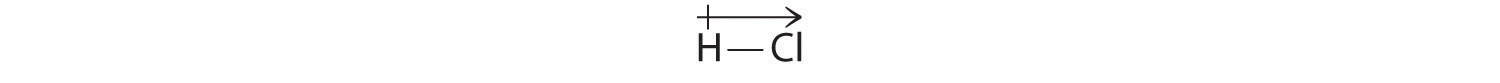
Pilen visar elektronflödets riktning genom att peka mot den mer elektronegativa atomen.
Laddningen på atomerna i många ämnen i gasfasen kan beräknas med hjälp av uppmätta dipolmoment och bindningsavstånd. Figur 8.14 ”A Plot of the Percent Ionic Character of a Bond as Determined from Measured Dipole Moments versus the Difference in Electronegativity of the Bonded Atoms” visar en plott av den procentuella joniska karaktären hos en bindning som bestäms från uppmätta dipolmoment kontra skillnaden i elektronegativitet hos de bundna atomerna för flera ämnen. Enligt diagrammet är bindningarna i ämnen som NaCl(g) och CsF(g) väsentligt mindre än 100 % joniska till sin karaktär. När gasen kondenseras till ett fast ämne ökar dock dipol-dipolinteraktionerna mellan polariserade arter laddningsseparationerna. I kristallen överförs därför en elektron från metallen till icke-metallen, och dessa ämnen beter sig som klassiska joniska föreningar. Data i figur 8.14 ”A Plot of the Percent Ionic Character of a Bond as Determined from Measured Dipole Moments versus the Difference in Electronegativity of the Bonded Atoms” visar att diatomära arter med en elektronegativitetsskillnad på mindre än 1,5 är mindre än 50 % joniska till sin karaktär, vilket stämmer överens med vår tidigare beskrivning av att dessa arter innehåller polära kovalenta bindningar. Användningen av dipolmoment för att bestämma den joniska karaktären hos en polär bindning illustreras i exempel 11.
Figur 8.14 En plott av den procentuella joniska karaktären hos en bindning som bestäms av uppmätta dipolmoment mot skillnaden i elektronegativitet hos de bundna atomerna
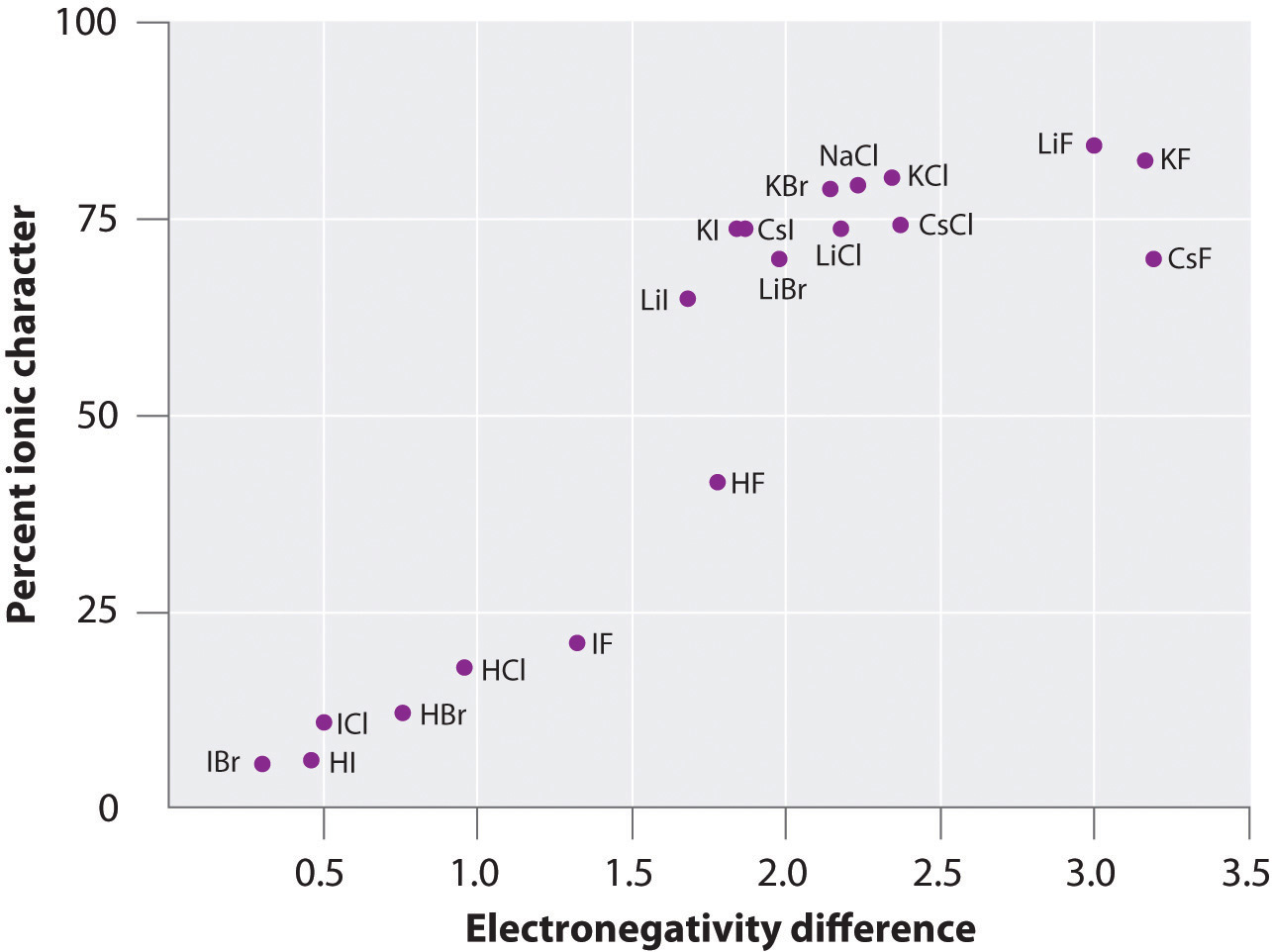
I gasfasen är inte ens CsF, som har den största möjliga skillnaden i elektronegativitet mellan atomerna, 100 % jonisk. Fast CsF betraktas dock bäst som 100 % joniskt på grund av de extra elektrostatiska interaktionerna i gittret.
Exempel 11
I gasfasen har NaCl ett dipolmoment på 9,001 D och ett Na-Cl-avstånd på 236,1 pm. Beräkna den procentuella jonkaraktären i NaCl.
Givet: kemisk art, dipolmoment och avstånd mellan kärnorna
Sökt: procentuell jonkaraktär
Strategi:
A Beräkna laddningen på varje atom med hjälp av den givna informationen och ekvation 8.16.
B Hitta den procentuella jonkaraktären utifrån förhållandet mellan den faktiska laddningen och laddningen av en enskild elektron.
Lösning: Lösningen är: Den procentuella jonkaraktären är en kombination av de olika ämnena:
A Laddningen på varje atom ges av
Q = μ r = 9,001 D ( 3,3356 × 10 -30 C – m 1 D ) ( 1 236,1 pm ) ( 1 pm 10 -12 m ) = 1 . 2 7 2 × 1 0 -19 C
Det innebär att NaCl beter sig som om det hade laddningar på 1,272 × 10-19 C på varje atom som är separerade med 236,1 pm.
B Den procentuella joniska karaktären ges av förhållandet mellan den faktiska laddningen och laddningen av en enda elektron (den laddning som förväntas för en fullständig överföring av en elektron):
% jonisk karaktär = ( 1.272 × 10 -19 C 1,6022 × 10 -19 C ) ( 100 ) = 79,39 % ≃ 79 %
Övning
I gasfasen har silverklorid (AgCl) ett dipolmoment på 6,08 D och ett Ag-Cl-avstånd på 228,1 pm. Vad är den procentuella jonkaraktären i silverklorid?
Svar: 55,5 %
Sammanfattning
Föreningar med polära kovalenta bindningar har elektroner som delas ojämnt mellan de bundna atomerna. Polariteten hos en sådan bindning bestäms till stor del av de bundna atomernas relativa elektronegativitet. Den asymmetriska laddningsfördelningen i ett polärt ämne ger upphov till ett dipolmoment, som är produkten av de partiella laddningarna på de bundna atomerna och avståndet mellan dem.
Nyckeluppfattning
- Bindningspolaritet och jonisk karaktär ökar med en ökande skillnad i elektronegativitet.
Nyckelekvation
Dipolmoment
Ekvation 8.16: µ = Qr
Konceptuella problem
-
Varför uppvisar joniska föreningar som KI betydligt mindre än 100 % jonisk karaktär i gasfasen?
-
Vad skulle du förvänta dig att av föreningarna LiI och LiF beter sig mer som en klassisk jonisk förening? Vilken skulle ha det större dipolmomentet i gasfasen? Förklara dina svar.
Numeriska problem
-
Förutsäg om varje förening är rent kovalent, rent jonisk eller polärt kovalent.
- RbCl
- S8
- TiCl2
- SbCl3
- LiI
- Br2
-
Baserad på relativa elektronegativiteter, klassificera bindningarna i varje förening som joniska, kovalenta eller polära kovalenta. Ange bindningsdipolens riktning för varje polär kovalent bindning.
- NO
- HF
- MgO
- AlCl3
- SiO2
- C=O-bindningen. i aceton
- O3
-
Baserat på relativa elektronegativiteter, klassificera bindningarna i varje förening som joniska, kovalenta eller polära kovalenta. Ange bindningsdipolens riktning för varje polär kovalent bindning.
- NaBr
- OF2
- BCl3
- S-S-bindningen i CH3CH2SSCH2CH3
- C-Cl-bindningen i CH2Cl2
- O-H-bindningen i CH3OH
- PtCl42-
-
Indela varje art som har 0-40 % jonisk karaktär, 40%-60% jonisk karaktär, eller 60%-100% jonisk karaktär baserat på den typ av bindning som du kan förvänta dig. Motivera ditt resonemang.
- CaO
- S8
- AlBr3
- ICl
- Na2S
- SiO2
- LiBr
-
Om bindningsavståndet i HCl (dipolmoment = 1.109 D) var dubbelt så stort som det faktiska värdet 127,46 pm, vad skulle då effekten bli på den laddning som är lokaliserad på varje atom? Vad skulle vara den procentuella negativa laddningen på Cl? Vid det faktiska bindningsavståndet, hur skulle en fördubbling av laddningen på varje atom påverka dipolmomentet? Skulle detta representera mer jonisk eller kovalent karaktär?
-
Beräkna den procentuella joniska karaktären hos HF (dipolmoment = 1.826 D) om avståndet mellan H och F-bindningarna är 92 pm.
-
Beräkna den procentuella joniska karaktären hos CO (dipolmoment = 0,110 D) om C-O-avståndet är 113 pm.
-
Beräkna den procentuella jonkaraktären för PbS och PbO i gasfasen, med tanke på följande information: För PbS är r = 228,69 pm och µ = 3.59 D; för PbO, r = 192,18 pm och µ = 4,64 D. Skulle du klassificera dessa föreningar som föreningar med kovalenta eller polära kovalenta bindningar i fast tillstånd?