Momenty dipolowe
Asymetryczny rozkład ładunków w substancji polarnej, takiej jak HCl, wytwarza moment dipolowyIloczyn ładunku cząstkowego Q na związanych atomach i odległości r między ładunkami cząstkowymi: µ=Qr, gdzie Q jest mierzone w kulombach (C), a r w metrach (m), oznaczany skrótem greckiej litery mu (µ). Moment dipolowy definiuje się jako iloczyn ładunku cząstkowego Q na związanych atomach i odległości r między ładunkami cząstkowymi:
Równanie 8.16
µ = Qr
gdzie Q jest mierzone w kulombach (C), a r w metrach. Jednostką dla momentów dipolowych jest debye (D):
Równanie 8.17
1 D = 3.3356 × 10-30 C-m
Gdy cząsteczka z momentem dipolowym jest umieszczona w polu elektrycznym, ma tendencję do orientowania się zgodnie z polem elektrycznym z powodu niesymetrycznego rozkładu ładunku (Rysunek 8.13 „Molecules That Possess a Dipole Moment Partially Align Themselves with an Applied Electric Field”).
Figure 8.13 Molecules That Possess a Dipole Moment Partially Align Themselves with an Applied Electric Field
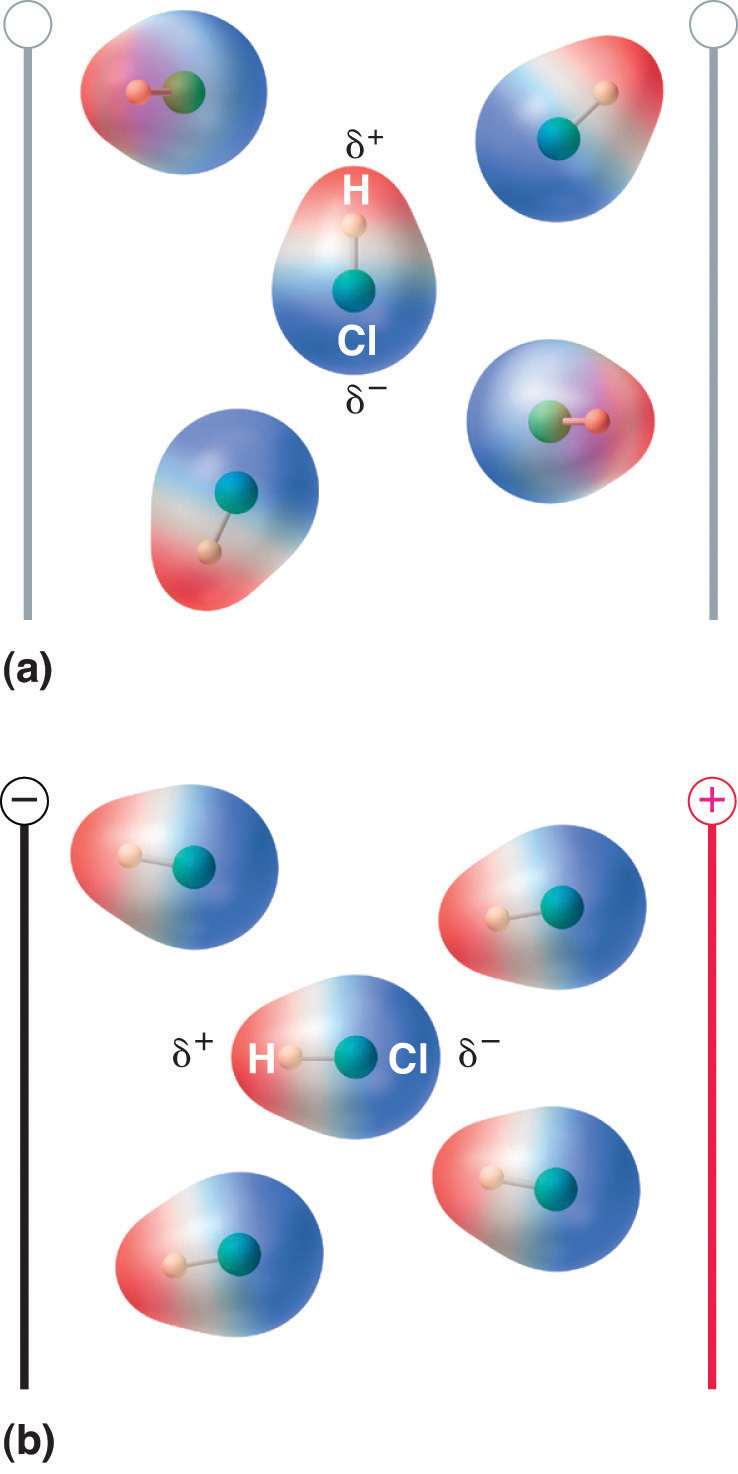
W przypadku braku pola (a), cząsteczki HCl są losowo zorientowane. Gdy przyłożone jest pole elektryczne (b), cząsteczki mają tendencję do ustawiania się zgodnie z polem, tak że dodatni koniec dipola molekularnego wskazuje w kierunku ujemnego końca i odwrotnie.
Możemy zmierzyć ładunki cząstkowe na atomach w cząsteczce takiej jak HCl używając równania 8.16. Gdyby wiązanie w HCl było czysto jonowe, elektron zostałby przeniesiony z H na Cl, więc na atomie H byłby pełny ładunek +1, a na atomie Cl pełny ładunek -1. Moment dipolowy HCl wynosi 1,109 D, jak określono przez pomiar stopnia jego ułożenia w polu elektrycznym, a podawana w fazie gazowej odległość H-Cl wynosi 127,5 pm. Stąd ładunek na każdym atomie wynosi
Równanie 8.18
Q = μ r = 1,109 D ( 3,3356 × 10 -30 C – m 1 D ) ( 1 127,5 pm ) ( 1 pm 10 -12 m ) = 2,901 × 10 -20 C
Podzielenie tej obliczonej wartości przez ładunek na pojedynczym elektronie (1.6022 × 10-19 C), stwierdzamy, że ładunek na atomie Cl cząsteczki HCl wynosi około -0,18, co odpowiada około 0,18 e-:
Równanie 8.19
2,901 × 10 -20 C 1,6022 × 10 -19 C /e – = 0,1811 e –
Aby utworzyć związek obojętny, ładunek na atomie H musi być równy, ale przeciwny. Tak więc zmierzony moment dipolowy HCl wskazuje, że wiązanie H-Cl ma około 18% charakter jonowy (0,1811 × 100), lub 82% charakter kowalencyjny. Zamiast pisać HCl jako Hδ+-Clδ- możemy zatem wskazać separację ładunków ilościowo jako
H 0 .18 δ + – Cl 0 .18 δ –
Obliczone przez nas wyniki zgadzają się z różnicą elektroujemności pomiędzy wodorem i chlorem χH = 2.20; χCl = 3.16, χCl – χH = 0.96), wartością mieszczącą się w zakresie dla polarnych wiązań kowalencyjnych. Moment dipolowy oznaczamy pisząc strzałkę nad cząsteczką.Matematycznie momenty dipolowe są wektorami i posiadają zarówno wielkość jak i kierunek. Moment dipolowy cząsteczki jest sumą wektorową dipoli poszczególnych wiązań. Na przykład w HCl moment dipolowy przedstawia się następująco:
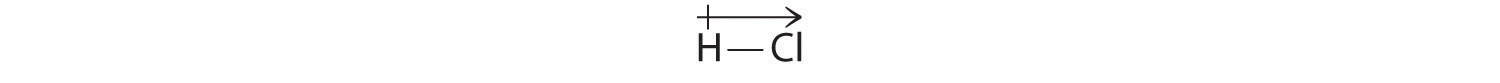
Strzałka wskazuje kierunek przepływu elektronów, kierując się w stronę bardziej elektroujemnego atomu.
Ładunek na atomach wielu substancji w fazie gazowej można obliczyć, wykorzystując zmierzone momenty dipolowe i odległości między wiązaniami. Rysunek 8.14 „A Plot of the Percent Ionic Character of a Bond as Determined from Measured Dipole Moments versus the Difference in Electronegativity of the Bonded Atoms” pokazuje wykres procentowego charakteru jonowego w stosunku do różnicy w elektronegatywności atomów wiązanych dla kilku substancji. Zgodnie z wykresem, wiązanie w takich gatunkach jak NaCl(g) i CsF(g) jest znacznie mniejsze niż 100% charakteru jonowego. Jednak w miarę kondensacji gazu w ciało stałe, oddziaływania dipolowo-dipolowe pomiędzy spolaryzowanymi gatunkami zwiększają separację ładunków. W krysztale zatem elektron jest przenoszony z metalu na niemetal, a substancje te zachowują się jak klasyczne związki jonowe. Dane na Rysunku 8.14 „Wykres procentowego charakteru jonowego wiązania określonego na podstawie zmierzonych momentów dipolowych w stosunku do różnicy elektroujemności związanych atomów” pokazują, że gatunki dwuatomowe o różnicy elektroujemności mniejszej niż 1,5 mają charakter jonowy w mniej niż 50%, co jest zgodne z naszym wcześniejszym opisem tych gatunków jako zawierających polarne wiązania kowalencyjne. Zastosowanie momentów dipolowych do określenia jonowego charakteru wiązania polarnego zilustrowano w przykładzie 11.
Figure 8.14 A Plot of the Percent Ionic Character of a Bond as Determined from Measured Dipole Moments versus the Difference in Electronegativity of the Bonded Atoms
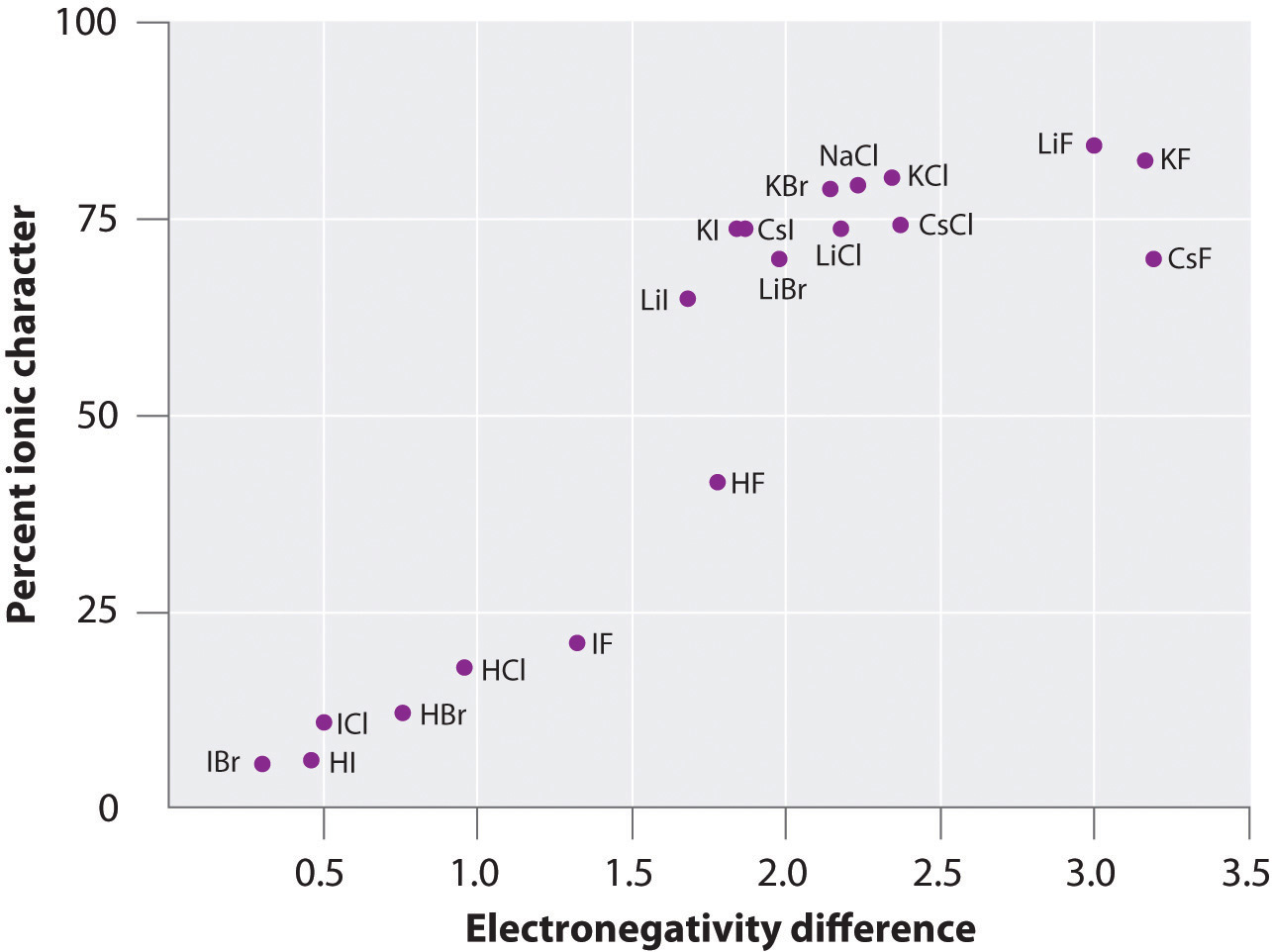
W fazie gazowej, nawet CsF, który ma największą możliwą różnicę w elektronegatywności pomiędzy atomami, nie jest w 100% jonowy. CsF w stanie stałym jest jednak najlepiej postrzegany jako 100% jonowy ze względu na dodatkowe oddziaływania elektrostatyczne w sieci.
Przykład 11
W fazie gazowej NaCl ma moment dipolowy równy 9,001 D i odległość Na-Cl równą 236,1 pm. Oblicz procentowy charakter jonowy w NaCl.
Dane: gatunek chemiczny, moment dipolowy i odległość międzyjądrowa
Pytanie o: procentowy charakter jonowy
Strategia:
A Oblicz ładunek każdego atomu korzystając z podanych informacji i równania 8.16.
B Znajdź procentowy charakter jonowy na podstawie stosunku ładunku rzeczywistego do ładunku pojedynczego elektronu.
Rozwiązanie:
A Ładunek na każdym atomie jest dany przez
Q = μ r = 9,001 D ( 3,3356 × 10 -30 C – m 1 D ) ( 1 236,1 pm ) ( 1 pm 10 -12 m ) = 1 . 2 7 2 × 1 0 -19 C
Tak więc NaCl zachowuje się tak, jakby na każdym atomie oddzielonym o 236,1 pm miał ładunki 1,272 × 10-19 C.
B Procentowy charakter jonowy jest dany przez stosunek rzeczywistego ładunku do ładunku pojedynczego elektronu (ładunek oczekiwany dla całkowitego przeniesienia jednego elektronu):
% charakter jonowy = ( 1.272 × 10 -19 C 1,6022 × 10 -19 C ) ( 100 ) = 79,39 % ≃ 79 %
Ćwiczenie
W fazie gazowej chlorek srebra (AgCl) ma moment dipolowy 6,08 D i odległość Ag-Cl 228,1 pm. Jaki jest procentowy udział jonów w chlorku srebra?
Odpowiedź: 55,5%
Podsumowanie
Związki z polarnymi wiązaniami kowalencyjnymi mają elektrony, które są dzielone nierównomiernie między związane atomy. Polarność takiego wiązania jest określona w dużej mierze przez względne elektronegativites połączonych atomów. Asymetryczny rozkład ładunków w substancji polarnej powoduje powstanie momentu dipolowego, który jest iloczynem ładunków cząstkowych na związanych atomach i odległości między nimi.
Key Takeaway
- Polaryzacja wiązań i charakter jonowy wzrastają wraz z rosnącą różnicą w elektroujemności.
Key Equation
Moment dipolowy
Równanie 8.16: µ = Qr
Problemy pojęciowe
-
Dlaczego związki jonowe takie jak KI wykazują znacznie mniej niż 100% charakteru jonowego w fazie gazowej?
-
Spośród związków LiI i LiF, który z nich powinien zachowywać się bardziej jak klasyczny związek jonowy? Który z nich miałby większy moment dipolowy w fazie gazowej? Wyjaśnij swoje odpowiedzi.
Problemy numeryczne
-
Przewidź, czy każdy związek jest czysto kowalencyjny, czysto jonowy, czy kowalencyjny polarny.
- RbCl
- S8
- TiCl2
- SbCl3
- LiI
- Br2
-
Na podstawie względnych elektronegatywów, sklasyfikuj wiązanie w każdym związku jako jonowe, kowalencyjne lub kowalencyjne polarne. Wskaż kierunek dipola wiązania dla każdego polarnego wiązania kowalencyjnego.
- NO
- HF
- MgO
- AlCl3
- SiO2
- wiązanie C=O w acetonie
- O3
-
W oparciu o względne elektronegatywy, sklasyfikuj wiązanie w każdym związku jako jonowe, kowalencyjne lub kowalencyjne polarne. Wskaż kierunek dipola wiązania dla każdego polarnego wiązania kowalencyjnego.
- NaBr
- OF2
- BCl3
- wiązanie S-S w CH3CH2SSCH2CH3
- wiązanie C-Cl w CH2Cl2
- wiązanie O-H w CH3OH
- PtCl42-
-
Sklasyfikuj każdy gatunek jako posiadający 0%-40% charakter jonowy, 40%-60% charakter jonowy, lub 60%-100% charakter jonowy w oparciu o typ wiązania, którego można się spodziewać. Uzasadnij swoje rozumowanie.
- CaO
- S8
- AlBr3
- ICl
- Na2S
- SiO2
- LiBr
-
Gdyby odległość wiązań w HCl (moment dipolowy = 1.109 D) była dwukrotnie większa od rzeczywistej wartości 127.46 pm, jaki byłby wpływ na ładunek zlokalizowany na każdym atomie? Ile wynosiłby procentowy ładunek ujemny na Cl? Przy rzeczywistej odległości wiązań, jak podwojenie ładunku na każdym atomie wpłynęłoby na moment dipolowy? Czy reprezentowałoby to bardziej jonowy czy kowalencyjny charakter?
-
Oblicz procentowy jonowy charakter HF (moment dipolowy = 1.826 D), jeśli odległość wiązania H-F wynosi 92 pm.
-
Oblicz procentowy charakter jonowy CO (moment dipolowy = 0,110 D), jeśli odległość C-O wynosi 113 pm.
-
Oblicz procentowy charakter jonowy PbS i PbO w fazie gazowej, biorąc pod uwagę następujące informacje: dla PbS, r = 228.69 pm i µ = 3.59 D; dla PbO, r = 192.18 pm i µ = 4.64 D. Czy sklasyfikowałbyś te związki jako posiadające kowalencyjne lub polarne wiązania kowalencyjne w stanie stałym?
.