Obiettivi di apprendimento
Al termine di questa sezione, sarai in grado di:
- Descrivere la materia e gli elementi
- Descrivere l’interrelazione tra protoni, neutroni ed elettroni, e i modi in cui gli elettroni possono essere donati o condivisi tra gli atomi
Al suo livello più fondamentale, la vita è fatta di materia. La materia occupa spazio e ha massa. Tutta la materia è composta da elementi, sostanze che non possono essere scomposte o trasformate chimicamente in altre sostanze. Ogni elemento è fatto di atomi, ognuno con un numero costante di protoni e proprietà uniche. Un totale di 118 elementi è stato definito; tuttavia, solo 92 si trovano in natura e meno di 30 si trovano nelle cellule viventi. I restanti 26 elementi sono instabili e, quindi, non esistono per molto tempo o sono teorici e devono ancora essere rilevati.
Ogni elemento è designato dal suo simbolo chimico (come H, N, O, C e Na) e possiede proprietà uniche. Queste proprietà uniche permettono agli elementi di combinarsi e di legarsi tra loro in modi specifici.
Atomi
Un atomo è il più piccolo componente di un elemento che conserva tutte le proprietà chimiche di quell’elemento. Per esempio, un atomo di idrogeno ha tutte le proprietà dell’elemento idrogeno, come ad esempio esiste come gas a temperatura ambiente e si lega con l’ossigeno per creare una molecola d’acqua. Gli atomi di idrogeno non possono essere scomposti in qualcosa di più piccolo pur mantenendo le proprietà dell’idrogeno. Se un atomo di idrogeno fosse scomposto in particelle subatomiche, non avrebbe più le proprietà dell’idrogeno.
Al livello più elementare, tutti gli organismi sono fatti di una combinazione di elementi. Contengono atomi che si combinano insieme per formare molecole. Negli organismi multicellulari, come gli animali, le molecole possono interagire per formare cellule che si combinano per formare tessuti, che costituiscono gli organi. Queste combinazioni continuano fino a formare interi organismi multicellulari.

Figura 1. Gli atomi sono costituiti da protoni e neutroni situati all’interno del nucleo e da elettroni che circondano il nucleo.
Tutti gli atomi contengono protoni, elettroni e neutroni (Figura 1). L’unica eccezione è l’idrogeno (H), che è fatto di un protone e un elettrone. Un protone è una particella con carica positiva che risiede nel nucleo (il cuore dell’atomo) di un atomo e ha una massa di 1 e una carica di +1. Un elettrone è una particella con carica negativa che viaggia nello spazio intorno al nucleo. In altre parole, risiede al di fuori del nucleo. Ha una massa trascurabile e una carica di -1.
I neutroni, come i protoni, risiedono nel nucleo di un atomo. Hanno una massa di 1 e nessuna carica. Le cariche positive (protoni) e negative (elettroni) si bilanciano a vicenda in un atomo neutro, che ha una carica netta nulla.
Perché protoni e neutroni hanno ciascuno una massa di 1, la massa di un atomo è uguale al numero di protoni e neutroni di quell’atomo. Il numero di elettroni non incide sulla massa complessiva, perché la loro massa è così piccola.
Come detto prima, ogni elemento ha le sue proprietà uniche. Ognuno contiene un numero diverso di protoni e neutroni, che gli danno il proprio numero atomico e numero di massa. Il numero atomico di un elemento è uguale al numero di protoni che contiene. Il numero di massa è il numero di protoni più il numero di neutroni di quell’elemento. Pertanto, è possibile determinare il numero di neutroni sottraendo il numero atomico dal numero di massa.
Questi numeri forniscono informazioni sugli elementi e su come reagiranno se combinati. Diversi elementi hanno diversi punti di fusione e di ebollizione, e sono in diversi stati (liquido, solido o gas) a temperatura ambiente. Si combinano anche in modi diversi. Alcuni formano tipi specifici di legami, mentre altri no. Il modo in cui si combinano si basa sul numero di elettroni presenti. A causa di queste caratteristiche, gli elementi sono organizzati nella tavola periodica degli elementi, un grafico degli elementi che include il numero atomico e la massa atomica relativa di ogni elemento. La tavola periodica fornisce anche informazioni chiave sulle proprietà degli elementi (Figura 2), spesso indicate da un codice colore. La disposizione della tavola mostra anche come sono organizzati gli elettroni in ogni elemento e fornisce importanti dettagli su come gli atomi reagiscono tra loro per formare molecole.
Gli isotopi sono forme diverse dello stesso elemento che hanno lo stesso numero di protoni, ma un diverso numero di neutroni. Alcuni elementi, come il carbonio, il potassio e l’uranio, hanno isotopi naturali. Il carbonio-12, l’isotopo più comune del carbonio, contiene sei protoni e sei neutroni. Pertanto, ha un numero di massa di 12 (sei protoni e sei neutroni) e un numero atomico di 6 (che lo rende carbonio). Il carbonio-14 contiene sei protoni e otto neutroni. Pertanto, ha un numero di massa di 14 (sei protoni e otto neutroni) e un numero atomico di 6, il che significa che è ancora l’elemento carbonio. Queste due forme alternative di carbonio sono isotopi. Alcuni isotopi sono instabili e perderanno protoni, altre particelle subatomiche o energia per formare elementi più stabili. Questi sono chiamati isotopi radioattivi o radioisotopi.
Art Connection

Figura 2. Disposta in colonne e righe in base alle caratteristiche degli elementi, la tavola periodica fornisce informazioni chiave sugli elementi e su come potrebbero interagire tra loro per formare molecole. La maggior parte delle tavole periodiche fornisce una chiave o una legenda delle informazioni che contengono.
Quanti neutroni hanno (K) il potassio-39 e il potassio-40, rispettivamente?
Evoluzione in azione
Datazione al carbonio

Figura 3. L’età dei resti che contengono carbonio e che hanno meno di circa 50.000 anni, come questo mammut pigmeo, può essere determinata usando la datazione al carbonio. (credit: Bill Faulkner/NPS)
Il carbonio-14 (14C) è un radioisotopo naturale che viene creato nell’atmosfera dai raggi cosmici. Questo è un processo continuo, quindi si crea sempre più 14C. Quando un organismo vivente si sviluppa, il livello relativo di 14C nel suo corpo è uguale alla concentrazione di 14C nell’atmosfera. Quando un organismo muore, non ingerisce più 14C, quindi il rapporto diminuisce. Il 14C decade in 14N per un processo chiamato decadimento beta; emette energia in questo lento processo.
Dopo circa 5.730 anni, solo la metà della concentrazione iniziale di 14C sarà stata convertita in 14N. Il tempo necessario alla metà della concentrazione originale di un isotopo per decadere nella sua forma più stabile è chiamato il suo tempo di dimezzamento. Poiché l’emivita del 14C è lunga, viene usata per invecchiare oggetti precedentemente viventi, come i fossili. Usando il rapporto tra la concentrazione di 14C trovata in un oggetto e la quantità di 14C rilevata nell’atmosfera, si può determinare la quantità di isotopo che non è ancora decaduto. Sulla base di questa quantità, l’età del fossile può essere calcolata a circa 50.000 anni (Figura 3). Gli isotopi con emivite più lunghe, come il potassio-40, sono usati per calcolare l’età dei fossili più vecchi. Attraverso l’uso della datazione al carbonio, gli scienziati possono ricostruire l’ecologia e la biogeografia degli organismi vissuti negli ultimi 50.000 anni.
Concept in Action
Questa simulazione ti mostra di più su atomi e isotopi, e come puoi distinguere un isotopo da un altro.
Legami chimici
Il modo in cui gli elementi interagiscono tra loro dipende da come sono disposti i loro elettroni e da quante aperture per gli elettroni esistono nella regione più esterna dove sono presenti gli elettroni in un atomo. Gli elettroni esistono a livelli di energia che formano gusci intorno al nucleo. Il guscio più vicino può contenere fino a due elettroni. Il guscio più vicino al nucleo viene sempre riempito per primo, prima che qualsiasi altro guscio possa essere riempito. L’idrogeno ha un solo elettrone, quindi ha un solo posto occupato nel guscio più basso. L’elio ha due elettroni, quindi può riempire completamente il guscio più basso con i suoi due elettroni. Se guardi la tavola periodica, vedrai che l’idrogeno e l’elio sono gli unici due elementi nella prima fila. Questo perché hanno solo elettroni nel loro primo guscio. L’idrogeno e l’elio sono gli unici due elementi che hanno il guscio più basso e nessun altro guscio.
I livelli energetici secondo e terzo possono contenere fino a otto elettroni. Gli otto elettroni sono disposti in quattro coppie e una posizione in ogni coppia è riempita con un elettrone prima che qualsiasi coppia sia completata.
Guardando ancora la tavola periodica (Figura 2), noterai che ci sono sette righe. Queste righe corrispondono al numero di gusci che gli elementi all’interno di quella riga hanno. Gli elementi all’interno di una particolare riga hanno un numero crescente di elettroni man mano che le colonne procedono da sinistra a destra. Anche se ogni elemento ha lo stesso numero di gusci, non tutti i gusci sono completamente pieni di elettroni. Se guardi la seconda fila della tavola periodica, troverai litio (Li), berillio (Be), boro (B), carbonio (C), azoto (N), ossigeno (O), fluoro (F) e neon (Ne). Tutti questi hanno elettroni che occupano solo il primo e il secondo guscio. Il litio ha solo un elettrone nel suo guscio più esterno, il berillio ha due elettroni, il boro ne ha tre, e così via, fino a quando l’intero guscio è riempito con otto elettroni, come nel caso del neon.
Non tutti gli elementi hanno abbastanza elettroni per riempire i loro gusci più esterni, ma un atomo è più stabile quando tutte le posizioni degli elettroni nel guscio più esterno sono riempite. A causa di questi vuoti nei gusci più esterni, assistiamo alla formazione di legami chimici, o interazioni tra due o più elementi uguali o diversi che portano alla formazione di molecole. Per ottenere una maggiore stabilità, gli atomi tenderanno a riempire completamente i loro gusci esterni e si legheranno con altri elementi per raggiungere questo obiettivo condividendo elettroni, accettando elettroni da un altro atomo o donando elettroni ad un altro atomo. Poiché i gusci più esterni degli elementi con basso numero atomico (fino al calcio, con numero atomico 20) possono contenere otto elettroni, si parla di regola dell’ottetto. Un elemento può donare, accettare o condividere elettroni con altri elementi per riempire il suo guscio esterno e soddisfare la regola dell’ottetto.

Figura 4. Gli elementi tendono a riempire i loro gusci più esterni con elettroni. Per fare questo, possono donare o accettare elettroni da altri elementi.
Quando un atomo non contiene un numero uguale di protoni ed elettroni, è chiamato ione. Poiché il numero di elettroni non è uguale al numero di protoni, ogni ione ha una carica netta. Gli ioni positivi si formano perdendo elettroni e sono chiamati cationi. Gli ioni negativi si formano guadagnando elettroni e sono chiamati anioni. I nomi degli elementi anionici sono cambiati per finire in -ide.
Per esempio, il sodio ha solo un elettrone nel suo guscio più esterno. Ci vuole meno energia per il sodio per donare quell’unico elettrone che per accettare altri sette elettroni per riempire il guscio esterno. Se il sodio perde un elettrone, ora ha 11 protoni e solo 10 elettroni, lasciandolo con una carica complessiva di +1. Ora è chiamato ione sodio.
L’atomo di cloro ha sette elettroni nel suo guscio esterno. Di nuovo, è più efficiente dal punto di vista energetico per il cloro guadagnare un elettrone che perderne sette. Pertanto, tende a guadagnare un elettrone per creare uno ione con 17 protoni e 18 elettroni, dandogli una carica netta negativa (-1). Ora è chiamato ione cloruro. Questo movimento di elettroni da un elemento all’altro è chiamato trasferimento di elettroni. Come illustra la figura 4, un atomo di sodio (Na) ha solo un elettrone nel suo guscio più esterno, mentre un atomo di cloro (Cl) ha sette elettroni nel suo guscio più esterno. Un atomo di sodio donerà il suo unico elettrone per svuotare il suo guscio, e un atomo di cloro accetterà quell’elettrone per riempire il suo guscio, diventando cloruro. Entrambi gli ioni ora soddisfano la regola dell’ottetto e hanno gusci esterni completi. Poiché il numero di elettroni non è più uguale al numero di protoni, ognuno è ora uno ione e ha una carica +1 (sodio) o -1 (cloruro).
Legami ionici
Ci sono quattro tipi di legami o interazioni: ionici, covalenti, legami idrogeno e interazioni di van der Waals. I legami ionici e covalenti sono interazioni forti che richiedono un input di energia maggiore per rompersi. Quando un elemento dona un elettrone dal suo guscio esterno, come nell’esempio dell’atomo di sodio sopra, si forma uno ione positivo. L’elemento che accetta l’elettrone è ora caricato negativamente. Poiché le cariche positive e negative si attraggono, questi ioni stanno insieme e formano un legame ionico, o un legame tra ioni. Gli elementi si legano insieme con l’elettrone di un elemento che rimane prevalentemente con l’altro elemento. Quando gli ioni Na+ e Cl- si combinano per produrre NaCl, un elettrone di un atomo di sodio rimane con gli altri sette dell’atomo di cloro, e gli ioni di sodio e cloruro si attraggono a vicenda in un reticolo di ioni con una carica netta zero.
Legami covalenti
Un altro tipo di legame chimico forte tra due o più atomi è un legame covalente. Questi legami si formano quando un elettrone è condiviso tra due elementi e sono la forma più forte e comune di legame chimico negli organismi viventi. I legami covalenti si formano tra gli elementi che compongono le molecole biologiche nelle nostre cellule. A differenza dei legami ionici, i legami covalenti non si dissociano in acqua.
Gli atomi di idrogeno e ossigeno che si combinano per formare le molecole d’acqua sono legati insieme da legami covalenti. L’elettrone dell’atomo di idrogeno si divide tra il guscio esterno dell’atomo di idrogeno e il guscio esterno incompleto dell’atomo di ossigeno. Per riempire completamente il guscio esterno di un atomo di ossigeno, sono necessari due elettroni da due atomi di idrogeno, da cui il pedice “2” in H2O. Gli elettroni sono condivisi tra gli atomi, dividendosi tra loro per “riempire” il guscio esterno di ciascuno. Questa condivisione è uno stato di energia più bassa per tutti gli atomi coinvolti che se esistessero senza i loro gusci esterni riempiti.
Ci sono due tipi di legami covalenti: polari e non polari. I legami covalenti non polari si formano tra due atomi dello stesso elemento o tra elementi diversi che condividono equamente gli elettroni. Per esempio, un atomo di ossigeno può legarsi con un altro atomo di ossigeno per riempire i loro gusci esterni. Questa associazione è non polare perché gli elettroni saranno equamente distribuiti tra ogni atomo di ossigeno. Due legami covalenti si formano tra i due atomi di ossigeno perché l’ossigeno richiede due elettroni condivisi per riempire il suo guscio più esterno. Gli atomi di azoto formeranno tre legami covalenti (chiamati anche tripli covalenti) tra due atomi di azoto perché ogni atomo di azoto ha bisogno di tre elettroni per riempire il suo guscio più esterno. Un altro esempio di legame covalente non polare si trova nella molecola di metano (CH4). L’atomo di carbonio ha quattro elettroni nel suo guscio più esterno e ha bisogno di altri quattro per riempirlo. Ottiene questi quattro da quattro atomi di idrogeno, ogni atomo ne fornisce uno. Questi elementi condividono tutti equamente gli elettroni, creando quattro legami covalenti non polari (Figura 5).
In un legame covalente polare, gli elettroni condivisi dagli atomi passano più tempo vicino a un nucleo che all’altro nucleo. A causa della distribuzione ineguale degli elettroni tra i diversi nuclei, si sviluppa una carica leggermente positiva (δ+) o leggermente negativa (δ-). I legami covalenti tra gli atomi di idrogeno e ossigeno nell’acqua sono legami covalenti polari. Gli elettroni condivisi passano più tempo vicino al nucleo dell’ossigeno, dandogli una piccola carica negativa, di quanto ne passino vicino ai nuclei dell’idrogeno, dando a queste molecole una piccola carica positiva.

Figura 5. La molecola dell’acqua (a sinistra) rappresenta un legame polare con una carica leggermente positiva sugli atomi di idrogeno e una carica leggermente negativa sull’ossigeno. Esempi di legami non polari sono il metano (al centro) e l’ossigeno (a destra).
Legami idrogeno
I legami ionici e covalenti sono legami forti che richiedono una notevole energia per essere spezzati. Tuttavia, non tutti i legami tra gli elementi sono legami ionici o covalenti. Si possono formare anche legami più deboli. Questi sono attrazioni che si verificano tra cariche positive e negative che non richiedono molta energia per rompersi. Due legami deboli che si verificano frequentemente sono i legami a idrogeno e le interazioni di van der Waals. Questi legami danno origine alle proprietà uniche dell’acqua e alle strutture uniche del DNA e delle proteine.
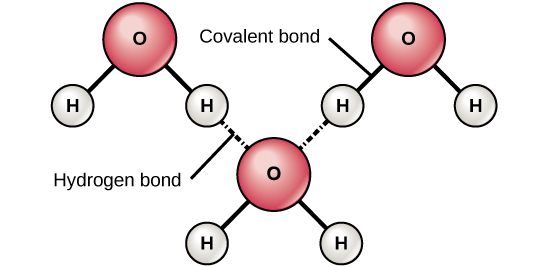
Figura 6. I legami idrogeno si formano tra cariche leggermente positive (δ+) e leggermente negative (δ-) di molecole covalenti polari, come l’acqua.
Quando si formano legami covalenti polari contenenti un atomo di idrogeno, l’atomo di idrogeno in quel legame ha una carica leggermente positiva. Questo perché l’elettrone condiviso è tirato più fortemente verso l’altro elemento e lontano dal nucleo dell’idrogeno. Poiché l’atomo di idrogeno è leggermente positivo (δ+), sarà attratto dalle cariche parziali negative vicine (δ-). Quando questo accade, si verifica una debole interazione tra la carica δ+ dell’atomo di idrogeno di una molecola e la carica δ- dell’altra molecola. Questa interazione è chiamata legame a idrogeno. Questo tipo di legame è comune; per esempio, la natura liquida dell’acqua è causata dai legami a idrogeno tra le molecole d’acqua (Figura 6). I legami a idrogeno danno all’acqua le proprietà uniche che sostengono la vita. Se non fosse per i legami a idrogeno, l’acqua sarebbe un gas piuttosto che un liquido a temperatura ambiente.
I legami a idrogeno possono formarsi tra diverse molecole e non devono sempre includere una molecola d’acqua. Gli atomi di idrogeno in legami polari all’interno di qualsiasi molecola possono formare legami con altre molecole adiacenti. Per esempio, i legami a idrogeno tengono insieme due lunghi filamenti di DNA per dare alla molecola di DNA la sua caratteristica struttura a doppio filamento. I legami idrogeno sono anche responsabili di parte della struttura tridimensionale delle proteine.
Interazioni di van der Waals
Come i legami idrogeno, le interazioni di van der Waals sono deboli attrazioni o interazioni tra molecole. Si verificano tra atomi polari, legati covalentemente, in molecole diverse. Alcune di queste attrazioni deboli sono causate da cariche parziali temporanee formate quando gli elettroni si muovono intorno a un nucleo. Queste interazioni deboli tra le molecole sono importanti nei sistemi biologici.
Riassunto della sezione
La materia è tutto ciò che occupa spazio e ha massa. È composta da atomi di diversi elementi. Tutti i 92 elementi presenti in natura hanno qualità uniche che permettono loro di combinarsi in vari modi per creare composti o molecole. Gli atomi, che consistono di protoni, neutroni ed elettroni, sono le più piccole unità di un elemento che conservano tutte le proprietà di quell’elemento. Gli elettroni possono essere donati o condivisi tra gli atomi per creare legami, compresi quelli ionici, covalenti e a idrogeno, nonché le interazioni di van der Waals.
Esercizi supplementari di autoverifica
1. Guarda la figura 2: quanti neutroni hanno (K) il potassio-39 e il potassio-40, rispettivamente?
2. Perché i legami a idrogeno e le interazioni di van der Waals sono necessari per le cellule?
Risposte
1. Il potassio-39 ha venti neutroni. Il potassio-40 ha ventuno neutroni.
2. I legami idrogeno e le interazioni di van der Waals formano associazioni deboli tra diverse molecole. Forniscono la struttura e la forma necessarie alle proteine e al DNA all’interno delle cellule in modo che funzionino correttamente. I legami a idrogeno danno anche all’acqua le sue proprietà uniche, che sono necessarie per la vita.