Tanulmányi célok
A szakasz végére képes leszel:
- Az anyag és az elemek leírása
- A protonok, neutronok és elektronok közötti kapcsolat, valamint az elektronok atomok közötti adományozásának vagy megosztásának módjai
A legalapvetőbb szinten az élet anyagból áll. Az anyag helyet foglal és tömeggel rendelkezik. Minden anyag elemekből áll, olyan anyagokból, amelyek kémiailag nem bonthatók vagy alakíthatók át más anyagokká. Minden elem atomokból áll, amelyek mindegyike állandó protonszámmal és egyedi tulajdonságokkal rendelkezik. Összesen 118 elemet határoztak meg; a természetben azonban csak 92 fordul elő, és kevesebb mint 30 elem található meg az élő sejtekben. A fennmaradó 26 elem instabil, ezért nem léteznek túl sokáig, vagy elméleti jellegűek, és még nem mutatták ki őket.
Minden elemet a kémiai jelével jelölünk (például H, N, O, C és Na), és egyedi tulajdonságokkal rendelkezik. Ezek az egyedi tulajdonságok teszik lehetővé, hogy az elemek különleges módon egyesüljenek és kötődjenek egymáshoz.
Atomok
Az atom egy elem legkisebb alkotóeleme, amely megtartja az elem összes kémiai tulajdonságát. Például egy hidrogénatom rendelkezik a hidrogén elem minden tulajdonságával, például szobahőmérsékleten gázként létezik, és oxigénnel kötődve vízmolekulát hoz létre. A hidrogénatomokat nem lehet kisebbekre bontani, miközben a hidrogén tulajdonságai megmaradnak. Ha egy hidrogénatomot szubatomi részecskékre bontanánk, akkor már nem rendelkezne a hidrogén tulajdonságaival.
A legalapvetőbb szinten minden szervezet elemek kombinációjából áll. Olyan atomokat tartalmaznak, amelyek molekulákká egyesülnek. A többsejtű szervezetekben, például az állatokban, a molekulák kölcsönhatásba léphetnek egymással, hogy sejteket alkossanak, amelyek szövetekké egyesülnek, és ezek alkotják a szerveket. Ezek a kombinációk addig folytatódnak, amíg teljes többsejtű szervezetek nem alakulnak ki.

1. ábra. Az atomok az atommagban található protonokból és neutronokból, valamint az atommagot körülvevő elektronokból állnak.
Minden atom tartalmaz protonokat, elektronokat és neutronokat (1. ábra). Az egyetlen kivétel a hidrogén (H), amely egy protonból és egy elektronból áll. A proton egy pozitív töltésű részecske, amely az atom magjában (az atom magjában) található, tömege 1, töltése pedig +1. Az elektron egy negatív töltésű részecske, amely az atommagot körülvevő térben mozog. Más szóval, az atommagon kívül tartózkodik. Tömege elhanyagolható, töltése -1.
A neutronok, akárcsak a protonok, az atommagban tartózkodnak. Tömegük 1, és nincs töltésük. A pozitív (protonok) és negatív (elektronok) töltések kiegyenlítik egymást a semleges atomban, amelynek nettó töltése nulla.
Mivel a protonok és neutronok tömege egyenként 1, az atom tömege megegyezik az atom protonjainak és neutronjainak számával. Az elektronok száma nem számít bele az össztömegbe, mert tömegük olyan kicsi.
Amint korábban említettük, minden elemnek megvannak a maga egyedi tulajdonságai. Mindegyik más és más számú protont és neutront tartalmaz, ami saját atomszámot és tömegszámot ad neki. Egy elem atomszáma megegyezik az adott elem által tartalmazott protonok számával. A tömegszám az adott elem protonjainak és neutronjainak száma. Ezért a neutronok számát úgy lehet meghatározni, hogy az atomszámot kivonjuk a tömegszámból.
Ezek a számok információt adnak az elemekről, és arról, hogyan fognak reagálni, ha egyesülnek. A különböző elemeknek különböző olvadási és forráspontjuk van, és szobahőmérsékleten különböző állapotúak (folyékony, szilárd vagy gáz halmazállapotúak). Emellett különböző módon kapcsolódnak össze. Egyesek meghatározott típusú kötéseket képeznek, míg mások nem. Az, hogy hogyan egyesülnek, a jelen lévő elektronok számától függ. E tulajdonságok miatt az elemeket az elemek periódusos rendszerébe, az elemek táblázatába rendezték, amely tartalmazza az egyes elemek atomszámát és relatív atomtömegét. A periódusos rendszer az elemek tulajdonságairól is tartalmaz kulcsfontosságú információkat (2. ábra) – gyakran színkódolással jelezve. A táblázat elrendezése azt is megmutatja, hogy az egyes elemek elektronjai hogyan szerveződnek, és fontos részleteket közöl arról, hogy az atomok hogyan reagálnak egymással, hogy molekulákat alkossanak.
Az izotópok ugyanannak az elemnek különböző formái, amelyeknek ugyanannyi protonjuk van, de különböző számú neutronjuk. Néhány elemnek, például a szénnek, a káliumnak és az uránnak vannak a természetben előforduló izotópjai. A szén-12, a szén leggyakoribb izotópja hat protont és hat neutront tartalmaz. Ezért tömegszáma 12 (hat proton és hat neutron), atomszáma pedig 6 (tehát szén). A szén-14 hat protont és nyolc neutront tartalmaz. Ezért tömegszáma 14 (hat proton és nyolc neutron) és atomi száma 6, vagyis még mindig a szén elem. A szén e két váltakozó formája izotóp. Egyes izotópok instabilak, és protonokat, más szubatomi részecskéket vagy energiát veszítenek, hogy stabilabb elemeket alkossanak. Ezeket radioaktív izotópoknak vagy radioizotópoknak nevezik.
Art Connection

2. ábra. Az elemek tulajdonságai alapján oszlopokba és sorokba rendezett periódusos rendszer kulcsfontosságú információkat nyújt az elemekről és arról, hogyan léphetnek kölcsönhatásba egymással, hogy molekulákat alkossanak. A legtöbb periódusos rendszer kulcsot vagy legendát ad a benne található információkhoz.
Hány neutronja van a (K) kálium-39-nek, illetve a kálium-40-nek?
Evolúció működés közben
Szén datálás

3. ábra. A szenet tartalmazó, körülbelül 50 000 évesnél fiatalabb maradványok, mint például ez a törpemamut, korát szénkormeghatározással lehet meghatározni. (hitel: Bill Faulkner/NPS)
A szén-14 (14C) a természetben előforduló radioizotóp, amely a légkörben a kozmikus sugárzás hatására jön létre. Ez egy folyamatos folyamat, így mindig több 14C keletkezik. Ahogy egy élő szervezet fejlődik, a 14C relatív szintje a testében megegyezik a légkör 14C koncentrációjával. Amikor egy szervezet meghal, már nem vesz fel 14C-t, így az arány csökken. A 14C egy béta-bomlásnak nevezett folyamat során 14N-re bomlik; e lassú folyamat során energiát ad le.
Körülbelül 5730 év elteltével a 14C kiindulási koncentrációjának csak a fele alakul át 14N-vé. Azt az időt, amely alatt egy izotóp eredeti koncentrációjának fele a stabilabb formájára bomlik, felezési időnek nevezzük. Mivel a 14C felezési ideje hosszú, a korábban élő tárgyak, például a fosszíliák kormeghatározására használják. A tárgyban talált 14C-koncentráció és a légkörben kimutatott 14C mennyiségének arányát felhasználva meghatározható a még nem bomlott izotóp mennyisége. E mennyiség alapján a fosszília korát körülbelül 50 000 évre lehet kiszámítani (3. ábra). A hosszabb felezési idejű izotópokat, mint például a kálium-40, az idősebb fosszíliák korának kiszámításához használják. A szén kormeghatározás segítségével a tudósok rekonstruálni tudják az elmúlt 50 000 évben élt szervezetek ökológiáját és biogeográfiáját.
Koncepció működésben
Ez a szimuláció többet mutat az atomokról és izotópokról, valamint arról, hogyan lehet megkülönböztetni az egyik izotópot a másiktól.
Kémiai kötések
Az, hogy az elemek hogyan lépnek kölcsönhatásba egymással, attól függ, hogyan helyezkednek el az elektronjaik, és hány elektronnyílás van a legkülső területen, ahol az atomban elektronok vannak. Az elektronok olyan energiaszinteken léteznek, amelyek héjakat alkotnak az atommag körül. A legközelebbi héj akár két elektront is tartalmazhat. Az atommaghoz legközelebbi héj mindig először töltődik fel, mielőtt bármely más héj feltöltődhetne. A hidrogénnek egy elektronja van, ezért a legalsó héjon belül csak egy hely van betöltve. A héliumnak két elektronja van; ezért a legalsó héjat teljesen ki tudja tölteni a két elektronjával. Ha megnézzük a periódusos rendszert, láthatjuk, hogy a hidrogén és a hélium az egyetlen két elem az első sorban. Ez azért van így, mert csak az első héjukban vannak elektronjaik. A hidrogén és a hélium az egyetlen olyan elem, amelynek a legalacsonyabb héja van, és nincs más héj.
A második és a harmadik energiaszint akár nyolc elektront is tartalmazhat. A nyolc elektron négy párba rendeződik, és minden párban egy pozíciót betölt egy elektron, mielőtt bármelyik pár kiteljesedne.
Még egyszer megnézve a periódusos rendszert (2. ábra), észrevehetjük, hogy hét sor van. Ezek a sorok megfelelnek a héjak számának, amelyekkel az adott sorban lévő elemek rendelkeznek. Egy adott soron belül az elemek egyre több elektronnal rendelkeznek, ahogy az oszlopok balról jobbra haladnak. Bár minden elemnek ugyanannyi héja van, nem minden héj van teljesen tele elektronokkal. Ha a periódusos rendszer második sorát nézzük, a lítium (Li), berillium (Be), bór (B), szén (C), nitrogén (N), oxigén (O), fluor (F) és neon (Ne) található. Ezek mind olyan elektronokkal rendelkeznek, amelyek csak az első és a második héjat foglalják el. A lítiumnak csak egy elektron van a legkülső héjában, a berilliumnak két elektronja van, a bórnak három, és így tovább, amíg a teljes héj ki nem telik nyolc elektronnal, mint a neon esetében.
Nem minden elemnek van annyi elektronja, hogy kitöltse a legkülső héját, de egy atom akkor a legstabilabb, ha a legkülső héj összes elektronhelye betöltött. A legkülső héjakban lévő üres helyek miatt alakulnak ki kémiai kötések, vagyis két vagy több azonos vagy különböző elem közötti kölcsönhatások, amelyek molekulák kialakulását eredményezik. A nagyobb stabilitás elérése érdekében az atomok arra törekszenek, hogy teljesen kitöltsék külső héjukat, és e cél elérése érdekében más elemekkel kötődnek azáltal, hogy elektronokat osztanak meg, elektronokat vesznek át egy másik atomtól, vagy elektronokat adnak egy másik atomnak. Mivel az alacsony atomszámú elemek (egészen a 20-as atomszámú kalciumig) legkülső héjai nyolc elektront képesek befogadni, ezt nevezik oktett-szabálynak. Egy elem adhat, elfogadhat vagy megoszthat elektronokat más elemekkel, hogy kitöltse a külső héját, és megfeleljen a nyolcados szabálynak.

4. ábra. Az elemek hajlamosak arra, hogy a legkülső héjukat elektronokkal töltsék meg. Ehhez vagy elektronokat adományoznak, vagy elektronokat fogadnak el más elemektől.
Ha egy atom nem tartalmaz egyenlő számú protont és elektront, akkor ionnak nevezzük. Mivel az elektronok száma nem egyenlő a protonok számával, minden ionnak nettó töltése van. A pozitív ionok elektronok elvesztésével keletkeznek, és kationoknak nevezzük őket. A negatív ionok elektronok felvételével keletkeznek, és anionoknak nevezzük őket. Az elemek anionnevei úgy módosulnak, hogy -ide végződésűek legyenek.
A nátriumnak például csak egy elektronja van a legkülső héjában. A nátriumnak kevesebb energiára van szüksége ahhoz, hogy leadja ezt az egy elektront, mint ahhoz, hogy további hét elektront vegyen fel a külső héj kitöltéséhez. Ha a nátrium elveszít egy elektront, akkor már 11 protonja van, és csak 10 elektronja, így össztöltése +1. Ezután nátriumionnak nevezzük.
A klóratomnak hét elektronja van a külső héjában. A klór számára ismét energiahatékonyabb, ha egy elektront nyer, mint ha hetet veszít. Ezért hajlamos egy elektront nyerni, hogy egy 17 protonból és 18 elektronból álló iont hozzon létre, ami nettó negatív (-1) töltést ad neki. Ezt nevezzük most kloridionnak. Az elektronoknak ezt az egyik elemről a másikra történő mozgását elektronátvitelnek nevezzük. Amint a 4. ábra mutatja, a nátriumatomnak (Na) csak egy elektron van a legkülső héjában, míg a klóratomnak (Cl) hét elektron van a legkülső héjában. A nátriumatom leadja az egy elektronját, hogy kiürítse a héját, a klóratom pedig elfogadja az elektront, hogy feltöltse a héját, és kloriddá alakuljon. Most már mindkét ion megfelel a nyolcas szabálynak, és teljes külső héjjal rendelkezik. Mivel az elektronok száma már nem egyenlő a protonok számával, most már mindegyik ion, és +1 (nátrium) vagy -1 (klorid) töltéssel rendelkezik.
Ionkötések
Négyféle kötés vagy kölcsönhatás létezik: ionos, kovalens, hidrogénkötés és van der Waals kölcsönhatás. Az ionos és kovalens kötések erős kölcsönhatások, amelyek felbontásához nagyobb energiabefektetés szükséges. Amikor egy elem egy elektront ad le a külső héjából, mint a fenti nátriumatom példában, pozitív ion keletkezik. Az elektront átvevő elem most negatív töltésű. Mivel a pozitív és negatív töltések vonzzák egymást, ezek az ionok együtt maradnak, és ionos kötést, azaz ionok közötti kötést alkotnak. Az elemek úgy kötődnek egymáshoz, hogy az egyik elem elektronja túlnyomórészt a másik elemmel marad. Amikor Na+ és Cl- ionok egyesülnek, hogy NaCl-t hozzanak létre, a nátriumatom egyik elektronja a klóratom másik hét elektronjával marad, és a nátrium- és kloridionok vonzzák egymást egy olyan ionrácsban, amelynek nettó töltése nulla.
Kovalens kötés
A két vagy több atom közötti erős kémiai kötés másik típusa a kovalens kötés. Ezek a kötések akkor jönnek létre, amikor két elem között egy elektron megoszlik, és az élő szervezetekben a kémiai kötés legerősebb és leggyakoribb formája. A kovalens kötések a sejtjeink biológiai molekuláit alkotó elemek között alakulnak ki. Az ionos kötésekkel ellentétben a kovalens kötések nem disszociálnak a vízben.
A vízmolekulákat alkotó hidrogén- és oxigénatomokat kovalens kötések kötik össze. A hidrogénatom elektronja megosztja idejét a hidrogénatom külső héja és az oxigénatom nem teljes külső héja között. Az oxigénatom külső héjának teljes kitöltéséhez két hidrogénatom két elektronjára van szükség, ezért van a H2O-ban a “2” index. Az elektronok megoszlanak az atomok között, megosztva az idejüket egymás között, hogy “kitöltsék” mindegyikük külső héját. Ez a megosztás az összes érintett atom számára alacsonyabb energiaállapotot jelent, mintha a külső héjak betöltése nélkül léteznének.
A kovalens kötéseknek két típusa van: a poláros és a nem poláros. A nem poláris kovalens kötések ugyanannak az elemnek két atomja vagy különböző elemek között jönnek létre, amelyek egyenlően osztoznak az elektronokon. Például egy oxigénatom kötődhet egy másik oxigénatomhoz, hogy kitöltsék külső héjukat. Ez a kötés azért nem poláris, mert az elektronok egyenlően oszlanak meg az egyes oxigénatomok között. A két oxigénatom között két kovalens kötés jön létre, mert az oxigénnek két megosztott elektronra van szüksége a legkülső héj kitöltéséhez. A nitrogénatomok három kovalens kötést (más néven hármas kovalens kötést) képeznek két nitrogénatom között, mivel minden nitrogénatomnak három elektronra van szüksége a legkülső héj kitöltéséhez. Egy másik példa a nem poláris kovalens kötésre a metán (CH4) molekulában található. A szénatomnak négy elektron van a legkülső héjában, és további négy elektronra van szüksége, hogy kitöltse azt. Ezt a négyet négy hidrogénatomtól kapja, mindegyik atom egyet. Ezek az elemek egyenlően osztoznak az elektronokon, így négy nem poláris kovalens kötés jön létre (5. ábra).
Egy poláris kovalens kötésben az atomok által megosztott elektronok több időt töltenek közelebb az egyik atommaghoz, mint a másik atommaghoz. Az elektronok egyenlőtlen eloszlása miatt a különböző atommagok között enyhén pozitív (δ+) vagy enyhén negatív (δ-) töltés alakul ki. A vízben lévő hidrogén- és oxigénatomok közötti kovalens kötések poláros kovalens kötések. A megosztott elektronok több időt töltenek az oxigénmag közelében, ami egy kis negatív töltést ad neki, mint a hidrogénmagok közelében, ami ezeknek a molekuláknak egy kis pozitív töltést ad.

5. ábra. A vízmolekula (balra) poláris kötést ábrázol, a hidrogénatomok enyhén pozitív, az oxigén pedig enyhén negatív töltéssel. A nem poláris kötésekre példa a metán (középen) és az oxigén (jobbra).
Hidrogénkötések
Az ionos és kovalens kötések olyan erős kötések, amelyek felbontása jelentős energiát igényel. Azonban nem minden kötés az elemek között ionos vagy kovalens kötés. Gyengébb kötések is kialakulhatnak. Ezek olyan vonzások, amelyek pozitív és negatív töltések között jönnek létre, és amelyek felbontásához nincs szükség nagy energiára. Két gyakran előforduló gyenge kötés a hidrogénkötés és a van der Waals kölcsönhatás. Ezek a kötések adják a víz egyedi tulajdonságait, valamint a DNS és a fehérjék egyedi szerkezetét.
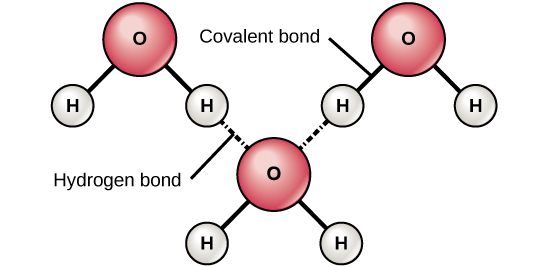
6. ábra. A hidrogénkötések poláros kovalens molekulák, például a víz enyhén pozitív (δ+) és enyhén negatív (δ-) töltései között jönnek létre.
Amikor egy hidrogénatomot tartalmazó poláros kovalens kötések jönnek létre, a kötésben lévő hidrogénatom enyhén pozitív töltéssel rendelkezik. Ez azért van, mert a közös elektron erősebben húzódik a másik elem felé, és távolodik a hidrogénmagtól. Mivel a hidrogénatom enyhén pozitív (δ+), a szomszédos negatív részleges töltések (δ-) vonzzák. Ilyenkor gyenge kölcsönhatás jön létre az egyik molekula hidrogénatomjának δ+ töltése és a másik molekula δ- töltése között. Ezt a kölcsönhatást hidrogénkötésnek nevezzük. Ez a fajta kötés gyakori; például a víz folyékony jellegét a vízmolekulák közötti hidrogénkötések okozzák (6. ábra). A hidrogénkötések adják a víz egyedi tulajdonságait, amelyek fenntartják az életet. Ha nem lenne hidrogénkötés, a víz szobahőmérsékleten nem folyadék, hanem gáz lenne.
A hidrogénkötések különböző molekulák között is kialakulhatnak, és nem kell mindig vízmolekulát tartalmazniuk. Bármely molekulán belül a poláris kötésben lévő hidrogénatomok más szomszédos molekulákkal is képezhetnek kötéseket. Például a hidrogénkötések tartják össze a DNS két hosszú szálát, így a DNS-molekula jellegzetes, két szálból álló szerkezetét. A hidrogénkötések felelősek a fehérjék háromdimenziós szerkezetének egy részéért is.
van der Waals kölcsönhatások
A hidrogénkötésekhez hasonlóan a van der Waals kölcsönhatások is gyenge vonzások vagy kölcsönhatások a molekulák között. Ezek különböző molekulák poláris, kovalens kötésű atomjai között lépnek fel. E gyenge vonzások némelyikét az elektronok mag körüli mozgása során keletkező ideiglenes részleges töltések okozzák. Ezek a molekulák közötti gyenge kölcsönhatások fontosak a biológiai rendszerekben.
Szakasz összefoglalása
Az anyag minden, ami helyet foglal és tömeggel rendelkezik. Különböző elemek atomjaiból áll. A természetben előforduló 92 elem mindegyike egyedi tulajdonságokkal rendelkezik, amelyek lehetővé teszik, hogy különböző módon egyesülve vegyületeket vagy molekulákat hozzanak létre. Az atomok, amelyek protonokból, neutronokból és elektronokból állnak, egy elem legkisebb egységei, amelyek megtartják az adott elem összes tulajdonságát. Az atomok között elektronok adhatók vagy oszthatók meg kötések létrehozásához, beleértve az ionos, kovalens és hidrogénkötéseket, valamint a van der Waals kölcsönhatásokat.
Kiegészítő önellenőrző gyakorlatok
1. Nézd meg a 2. ábrát: Hány neutronja van a (K) kálium-39-nek, illetve a kálium-40-nek?
2. Miért van szükség a sejtekhez hidrogénkötésekre és van der Waals kölcsönhatásokra?
Answers
1. A kálium-39-nek húsz neutronja van. A kálium-40-nek huszonegy neutronja van.
2. A hidrogénkötések és a van der Waals kölcsönhatások gyenge társulásokat képeznek különböző molekulák között. Ezek biztosítják a sejteken belül a fehérjék és a DNS számára a megfelelő működéshez szükséges szerkezetet és alakot. A hidrogénkötések adják a víz egyedi tulajdonságait is, amelyek az élethez szükségesek.