Cíle učení
Na konci této části budete umět:
- Popsat hmotu a prvky
- Popsat vzájemný vztah mezi protony, neutrony a elektrony a způsoby, jakými mohou být elektrony darovány nebo sdíleny mezi atomy
Život se na své nejzákladnější úrovni skládá z hmoty. Hmota zaujímá prostor a má hmotnost. Veškerá hmota se skládá z prvků, látek, které nelze rozložit nebo chemicky přeměnit na jiné látky. Každý prvek se skládá z atomů, z nichž každý má konstantní počet protonů a jedinečné vlastnosti. Bylo definováno celkem 118 prvků; v přírodě se jich však vyskytuje pouze 92 a méně než 30 se nachází v živých buňkách. Zbývajících 26 prvků je nestabilních, a proto neexistují příliš dlouho, nebo jsou teoretické a dosud nebyly objeveny.
Každý prvek se označuje chemickou značkou (například H, N, O, C a Na) a má jedinečné vlastnosti. Tyto jedinečné vlastnosti umožňují prvkům kombinovat se a vázat se mezi sebou specifickými způsoby.
Atomy
Atom je nejmenší součást prvku, která si zachovává všechny chemické vlastnosti tohoto prvku. Například jeden atom vodíku má všechny vlastnosti prvku vodík, například existuje jako plyn při pokojové teplotě a váže se s kyslíkem za vzniku molekuly vody. Atomy vodíku nelze rozložit na nic menšího a přitom si zachovat vlastnosti vodíku. Kdyby se atom vodíku rozpadl na subatomární částice, už by neměl vlastnosti vodíku.
Na nejzákladnější úrovni jsou všechny organismy tvořeny kombinací prvků. Obsahují atomy, které se spojují do molekul. U mnohobuněčných organismů, jako jsou živočichové, mohou molekuly vzájemně působit a vytvářet buňky, které se spojují do tkání, z nichž se skládají orgány. Tyto kombinace pokračují, dokud se nevytvoří celé mnohobuněčné organismy.

Obrázek 1. Atomy se skládají z protonů a neutronů umístěných v jádře a elektronů obklopujících jádro.
Všechny atomy obsahují protony, elektrony a neutrony (obrázek 1). Jedinou výjimkou je vodík (H), který se skládá z jednoho protonu a jednoho elektronu. Proton je kladně nabitá částice, která se nachází v jádře (jádru atomu) atomu a má hmotnost 1 a náboj +1. V jádře atomu je proton. Elektron je záporně nabitá částice, která se pohybuje v prostoru kolem jádra. Jinými slovy, nachází se mimo jádro. Má zanedbatelnou hmotnost a náboj -1.
Neutrony, stejně jako protony, sídlí v jádře atomu. Mají hmotnost 1 a žádný náboj. Kladné (protony) a záporné (elektrony) náboje se vzájemně vyrovnávají v neutrálním atomu, který má čistý nulový náboj.
Protože protony a neutrony mají hmotnost 1, je hmotnost atomu rovna počtu protonů a neutronů tohoto atomu. Počet elektronů se do celkové hmotnosti nezapočítává, protože jejich hmotnost je tak malá.
Jak již bylo řečeno, každý prvek má své jedinečné vlastnosti. Každý obsahuje jiný počet protonů a neutronů, což mu dává vlastní atomové číslo a hmotnostní číslo. Atomové číslo prvku se rovná počtu protonů, které daný prvek obsahuje. Hmotnostní číslo je počet protonů plus počet neutronů daného prvku. Proto je možné určit počet neutronů odečtením atomového čísla od hmotnostního čísla.
Tato čísla poskytují informace o prvcích a o tom, jak budou reagovat při jejich spojení. Různé prvky mají různé teploty tání a varu a při pokojové teplotě jsou v různém stavu (kapalném, pevném nebo plynném). Různě se také kombinují. Některé vytvářejí specifické typy vazeb, zatímco jiné ne. Způsob jejich slučování závisí na počtu přítomných elektronů. Kvůli těmto vlastnostem jsou prvky uspořádány do periodické tabulky prvků, což je tabulka prvků, která obsahuje atomové číslo a relativní atomovou hmotnost každého prvku. Periodická tabulka také poskytuje klíčové informace o vlastnostech prvků (obrázek 2) – často jsou označeny barevným kódováním. Uspořádání tabulky také ukazuje, jak jsou uspořádány elektrony v jednotlivých prvcích, a poskytuje důležité údaje o tom, jak spolu budou atomy reagovat za vzniku molekul.
Izotopy jsou různé formy téhož prvku, které mají stejný počet protonů, ale jiný počet neutronů. Některé prvky, například uhlík, draslík a uran, mají přirozeně se vyskytující izotopy. Uhlík-12, nejběžnější izotop uhlíku, obsahuje šest protonů a šest neutronů. Má tedy hmotnostní číslo 12 (šest protonů a šest neutronů) a atomové číslo 6 (což z něj činí uhlík). Uhlík-14 obsahuje šest protonů a osm neutronů. Má tedy hmotnostní číslo 14 (šest protonů a osm neutronů) a atomové číslo 6, což znamená, že se stále jedná o prvek uhlík. Tyto dvě alternativní formy uhlíku jsou izotopy. Některé izotopy jsou nestabilní a ztrácejí protony, jiné subatomární částice nebo energii a vytvářejí stabilnější prvky. Těmto izotopům se říká radioaktivní izotopy nebo radioizotopy.
Připojení k umění

Obrázek 2. Uhlíkové izotopy. Periodická tabulka uspořádaná do sloupců a řádků podle vlastností prvků poskytuje klíčové informace o prvcích a o tom, jak na sebe mohou vzájemně působit a vytvářet molekuly. Většina periodických tabulek obsahuje klíč nebo legendu k informacím, které obsahují.
Kolik neutronů má (K) draslík-39, respektive draslík-40?
Evoluce v akci
Datování uhlíku

Obrázek 3. Jaký je počet neutronů? Stáří pozůstatků, které obsahují uhlík a jsou mladší než přibližně 50 000 let, jako je tento mamut trpasličí, lze určit pomocí uhlíkového datování. (kredit: Bill Faulkner/NPS)
Uhlík-14 (14C) je přirozeně se vyskytující radioizotop, který vzniká v atmosféře působením kosmického záření. Jedná se o nepřetržitý proces, takže stále vzniká další 14C. Jak se živý organismus vyvíjí, relativní hladina 14C v jeho těle se rovná koncentraci 14C v atmosféře. Když organismus zemře, již nepřijímá 14C, takže se poměr sníží. 14C se rozpadá na 14N procesem zvaným rozpad beta; při tomto pomalém procesu odevzdává energii.
Přibližně po 5730 letech se na 14N přemění pouze polovina výchozí koncentrace 14C. Doba, za kterou se polovina původní koncentrace izotopu rozpadne na stabilnější formu, se nazývá poločas rozpadu. Protože poločas rozpadu 14C je dlouhý, používá se ke stárnutí dříve živých objektů, například fosilií. Pomocí poměru koncentrace 14C nalezené v objektu a množství 14C zjištěného v atmosféře lze určit množství izotopu, který se ještě nerozpadl. Na základě tohoto množství lze vypočítat stáří fosilie přibližně na 50 000 let (obrázek 3). Izotopy s delším poločasem rozpadu, jako je draslík-40, se používají k výpočtu stáří starších fosilií. Pomocí datování pomocí uhlíku mohou vědci rekonstruovat ekologii a biogeografii organismů žijících v posledních 50 000 letech.
Pojmy v akci
Tato simulace vám ukáže více o atomech a izotopech a o tom, jak lze rozeznat jeden izotop od druhého.
Chemické vazby
Jak na sebe prvky vzájemně působí, závisí na tom, jak jsou uspořádány jejich elektrony a kolik otvorů pro elektrony existuje v nejvzdálenější oblasti, kde jsou v atomu přítomny elektrony. Elektrony existují na energetických hladinách, které tvoří slupky kolem jádra. Nejbližší slupka může obsahovat až dva elektrony. Nejbližší slupka k jádru je vždy zaplněna jako první a teprve poté může být zaplněna jakákoli jiná slupka. Vodík má jeden elektron, proto má v nejnižší slupce obsazeno pouze jedno místo. Helium má dva elektrony, proto může svými dvěma elektrony zcela zaplnit nejnižší slupku. Pokud se podíváte na periodickou tabulku prvků, zjistíte, že vodík a helium jsou jediné dva prvky v první řadě. Je to proto, že mají elektrony pouze v první slupce. Vodík a helium jsou jediné dva prvky, které mají nejnižší slupku a žádné další slupky.
Druhá a třetí energetická hladina mohou obsahovat až osm elektronů. Těchto osm elektronů je uspořádáno do čtyř párů a jedna pozice v každém páru je obsazena elektronem dříve, než je některý pár doplněn.
Podíváte-li se znovu na periodickou tabulku (obrázek 2), všimnete si, že je zde sedm řádků. Tyto řádky odpovídají počtu slupek, které mají prvky v daném řádku. Prvky v rámci určitého řádku mají rostoucí počet elektronů, jak sloupce postupují zleva doprava. Ačkoli má každý prvek stejný počet slupek, ne všechny slupky jsou zcela zaplněny elektrony. Pokud se podíváte na druhou řadu periodické tabulky, najdete v ní lithium (Li), berylium (Be), bor (B), uhlík (C), dusík (N), kyslík (O), fluor (F) a neon (Ne). Ty všechny mají elektrony, které zaujímají pouze první a druhou slupku. Lithium má v nejvzdálenější slupce pouze jeden elektron, beryllium dva elektrony, bór tři a tak dále, dokud není celá slupka zaplněna osmi elektrony, jako je tomu u neonu.
Ne všechny prvky mají dostatek elektronů k zaplnění svých nejvzdálenějších slupek, ale atom je nejstabilnější, když jsou zaplněny všechny pozice elektronů v nejvzdálenější slupce. Kvůli těmto volným místům v nejvzdálenějších slupkách pozorujeme vznik chemických vazeb neboli interakcí mezi dvěma nebo více stejnými nebo různými prvky, které vedou ke vzniku molekul. Aby dosáhly větší stability, budou mít atomy tendenci zcela zaplnit své vnější slupky a k dosažení tohoto cíle se budou vázat s jinými prvky sdílením elektronů, přijetím elektronů od jiného atomu nebo darováním elektronů jinému atomu. Protože vnější slupky prvků s nízkými atomovými čísly (až po vápník s atomovým číslem 20) mohou obsahovat osm elektronů, označuje se toto pravidlo jako pravidlo oktetu. Prvek může darovat, přijmout nebo sdílet elektrony s jinými prvky, aby zaplnil svou vnější slupku a splnil oktetové pravidlo.

Obrázek 4: Prvky s atomovými čísly. Prvky mají tendenci zaplňovat své vnější slupky elektrony. Za tímto účelem mohou elektrony buď darovat, nebo přijmout od jiných prvků.
Když atom neobsahuje stejný počet protonů a elektronů, nazývá se iont. Protože se počet elektronů nerovná počtu protonů, má každý iont čistý náboj. Kladné ionty vznikají ztrátou elektronů a nazývají se kationty. Záporné ionty vznikají získáním elektronů a nazývají se anionty. Názvy aniontů prvků se mění tak, aby končily na -id.
Například sodík má v nejvnějším obalu pouze jeden elektron. K odevzdání tohoto jednoho elektronu potřebuje sodík méně energie než k přijetí dalších sedmi elektronů k zaplnění vnější slupky. Pokud sodík ztratí elektron, má nyní 11 protonů a pouze 10 elektronů, takže má celkový náboj +1. Nyní se nazývá sodíkový iont.
Atom chloru má ve své vnější slupce sedm elektronů. Pro chlor je opět energeticky výhodnější získat jeden elektron než ztratit sedm. Proto má tendenci získat jeden elektron a vytvořit tak ion se 17 protony a 18 elektrony, což mu dává čistý záporný (-1) náboj. Nyní se nazývá chloridový iont. Tento pohyb elektronů z jednoho prvku na druhý se označuje jako přenos elektronů. Jak ukazuje obrázek 4, atom sodíku (Na) má ve vnějším obalu pouze jeden elektron, zatímco atom chloru (Cl) má ve vnějším obalu sedm elektronů. Atom sodíku odevzdá svůj jeden elektron, aby vyprázdnil svou slupku, a atom chloru přijme tento elektron, aby zaplnil svou slupku, a stane se chloridem. Oba ionty nyní splňují pravidlo oktetu a mají úplné vnější slupky. Protože počet elektronů již není roven počtu protonů, každý z nich je nyní iontem a má náboj +1 (sodík) nebo -1 (chlorid).
Iontové vazby
Existují čtyři typy vazeb nebo interakcí: iontové, kovalentní, vodíkové a van der Waalsovy interakce. Iontové a kovalentní vazby jsou silné interakce, jejichž rozpad vyžaduje větší energetický vklad. Když prvek daruje elektron ze svého vnějšího obalu, jako ve výše uvedeném příkladu s atomem sodíku, vznikne kladný iont. Prvek přijímající elektron je nyní nabitý záporně. Protože se kladné a záporné náboje přitahují, zůstávají tyto ionty pohromadě a tvoří iontovou vazbu neboli vazbu mezi ionty. Prvky se vážou společně, přičemž elektron z jednoho prvku zůstává převážně u druhého prvku. Když se ionty Na+ a Cl- spojí a vznikne NaCl, elektron z atomu sodíku zůstává s dalšími sedmi z atomu chloru a ionty sodíku a chloridu se vzájemně přitahují v mřížce iontů s čistým nulovým nábojem.
Kovalentní vazby
Dalším typem silné chemické vazby mezi dvěma nebo více atomy je kovalentní vazba. Tyto vazby vznikají při sdílení elektronu mezi dvěma prvky a jsou nejsilnější a nejběžnější formou chemické vazby v živých organismech. Kovalentní vazby vznikají mezi prvky, které tvoří biologické molekuly v našich buňkách. Na rozdíl od iontových vazeb se kovalentní vazby ve vodě nedisociují.
Atomy vodíku a kyslíku, které se spojují do molekul vody, jsou vázány kovalentními vazbami. Elektron z atomu vodíku rozděluje svůj čas mezi vnější obal atomu vodíku a neúplný vnější obal atomu kyslíku. K úplnému zaplnění vnější slupky atomu kyslíku jsou zapotřebí dva elektrony ze dvou atomů vodíku, proto je v H2O uveden index „2“. Elektrony jsou sdíleny mezi atomy a rozdělují se mezi ně, aby „vyplnily“ vnější slupku každého z nich. Toto sdílení znamená pro všechny zúčastněné atomy nižší energetický stav, než kdyby existovaly bez zaplněných vnějších slupek.
Existují dva typy kovalentních vazeb: polární a nepolární. Nepolární kovalentní vazby vznikají mezi dvěma atomy stejného prvku nebo mezi různými prvky, které sdílejí elektrony rovným dílem. Například atom kyslíku se může vázat s jiným atomem kyslíku a vyplnit tak jejich vnější slupky. Tato vazba je nepolární, protože elektrony budou rovnoměrně rozděleny mezi jednotlivé atomy kyslíku. Mezi dvěma atomy kyslíku se vytvoří dvě kovalentní vazby, protože kyslík potřebuje k vyplnění své vnější slupky dva sdílené elektrony. Atomy dusíku vytvoří mezi dvěma atomy dusíku tři kovalentní vazby (nazývané také trojité kovalentní), protože každý atom dusíku potřebuje tři elektrony, aby zaplnil svou vnější slupku. Dalším příkladem nepolární kovalentní vazby je molekula metanu (CH4). Atom uhlíku má ve své nejvzdálenější slupce čtyři elektrony a k jejímu zaplnění potřebuje další čtyři. Tyto čtyři elektrony získá od čtyř atomů vodíku, přičemž každý atom poskytne jeden. Všechny tyto prvky se o elektrony dělí rovným dílem, čímž vznikají čtyři nepolární kovalentní vazby (obrázek 5).
V polární kovalentní vazbě tráví elektrony sdílené atomy více času blíže k jednomu jádru než k jádru druhému. V důsledku nerovnoměrného rozdělení elektronů mezi různá jádra vzniká mírně kladný (δ+) nebo mírně záporný (δ-) náboj. Kovalentní vazby mezi atomy vodíku a kyslíku ve vodě jsou polární kovalentní vazby. Sdílené elektrony tráví více času v blízkosti jádra kyslíku, což mu dává malý záporný náboj, než v blízkosti jader vodíku, což dává těmto molekulám malý kladný náboj.

Obrázek 5. Sdílená elektronová vazba mezi vodíkem a kyslíkem. Molekula vody (vlevo) znázorňuje polární vazbu s mírně kladným nábojem na atomech vodíku a mírně záporným nábojem na atomech kyslíku. Příkladem nepolární vazby je metan (uprostřed) a kyslík (vpravo).
Vazba vodíku
Iontové a kovalentní vazby jsou silné vazby, jejichž přerušení vyžaduje značnou energii. Ne všechny vazby mezi prvky jsou však iontové nebo kovalentní. Mohou vznikat i slabší vazby. Jedná se o přitažlivosti, které vznikají mezi kladnými a zápornými náboji a k jejichž přerušení není zapotřebí mnoho energie. Dvě slabé vazby, které se často vyskytují, jsou vodíkové vazby a van der Waalsovy interakce. Tyto vazby dávají vzniknout jedinečným vlastnostem vody a jedinečným strukturám DNA a bílkovin.
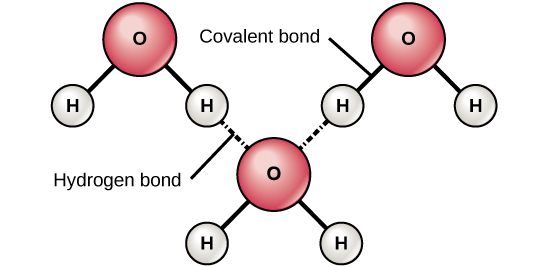
Obrázek 6: Vazby mezi vodou a bílkovinami. Vodíkové vazby vznikají mezi mírně kladnými (δ+) a mírně zápornými (δ-) náboji polárních kovalentních molekul, jako je voda.
Při vzniku polárních kovalentních vazeb obsahujících atom vodíku má atom vodíku v této vazbě mírně kladný náboj. Je to proto, že sdílený elektron je silněji přitahován k druhému prvku a od jádra vodíku. Protože je atom vodíku mírně kladný (δ+), bude přitahován k sousedním záporným dílčím nábojům (δ-). Když k tomu dojde, vznikne slabá interakce mezi nábojem δ+ atomu vodíku jedné molekuly a nábojem δ- druhé molekuly. Tato interakce se nazývá vodíková vazba. Tento typ vazby je běžný; například kapalný charakter vody je způsoben vodíkovými vazbami mezi molekulami vody (obrázek 6). Vodíkové vazby dávají vodě jedinečné vlastnosti, které udržují život. Nebýt vodíkové vazby, byla by voda při pokojové teplotě spíše plynem než kapalinou.
Vodíkové vazby mohou vznikat mezi různými molekulami a nemusí vždy zahrnovat molekulu vody. Atomy vodíku v polárních vazbách uvnitř jakékoli molekuly mohou vytvářet vazby s jinými sousedními molekulami. Vodíkové vazby například drží pohromadě dvě dlouhá vlákna DNA a dávají tak molekule DNA charakteristickou dvouvláknovou strukturu. Vodíkové vazby jsou také zodpovědné za část trojrozměrné struktury bílkovin.
van der Waalsovy interakce
Stejně jako vodíkové vazby jsou van der Waalsovy interakce slabé přitažlivosti nebo interakce mezi molekulami. Vyskytují se mezi polárními, kovalentně vázanými atomy v různých molekulách. Některé z těchto slabých přitažlivostí jsou způsobeny dočasnými částečnými náboji, které vznikají při pohybu elektronů kolem jádra. Tyto slabé interakce mezi molekulami jsou důležité v biologických systémech.
Shrnutí oddílu
Hmota je vše, co zaujímá prostor a má hmotnost. Skládá se z atomů různých prvků. Všech 92 prvků, které se vyskytují v přírodě, má jedinečné vlastnosti, které jim umožňují kombinovat se různými způsoby a vytvářet sloučeniny nebo molekuly. Atomy, které se skládají z protonů, neutronů a elektronů, jsou nejmenší jednotky prvku, které si zachovávají všechny vlastnosti daného prvku. Elektrony mohou být mezi atomy darovány nebo sdíleny za účelem vytvoření vazeb, včetně iontových, kovalentních a vodíkových vazeb, a také van der Waalsových interakcí.
Doplňková cvičení pro vlastní kontrolu
1. Podívejte se na obrázek 2: Kolik neutronů má (K) draslík-39, resp. draslík-40?“
2. Proč jsou pro buňky nezbytné vodíkové vazby a van der Waalsovy interakce?“
Odpovědi
1. Proč jsou pro buňky nezbytné vodíkové vazby a van der Waalsovy interakce? Draslík-39 má dvacet neutronů. Draslík-40 má dvacet jedna neutronů.
2. Vodíkové vazby a van der Waalsovy interakce tvoří slabé vazby mezi různými molekulami. Zajišťují strukturu a tvar nezbytný pro proteiny a DNA v buňkách, aby správně fungovaly. Vodíkové vazby také dávají vodě její jedinečné vlastnosti, které jsou nezbytné pro život.