Oppimistavoitteet
Tämän jakson lopussa osaat:
- Kuvailla ainetta ja alkuaineita
- Kuvailla protonien, neutronien ja elektronien keskinäistä suhdetta sekä tapoja, joilla elektroneja voidaan luovuttaa tai jakaa atomien välillä
Perusteellisimmillaan elämä koostuu aineesta. Aine vie tilaa ja sillä on massaa. Kaikki aine koostuu alkuaineista, aineista, joita ei voi hajottaa tai muuttaa kemiallisesti toisiksi aineiksi. Jokainen alkuaine koostuu atomeista, joilla kullakin on vakio määrä protoneja ja ainutlaatuiset ominaisuudet. Alkuaineita on määritelty yhteensä 118. Luonnossa esiintyy kuitenkin vain 92 alkua, ja elävissä soluissa on alle 30 alkua. Loput 26 alkuainetta ovat epästabiileja, joten niitä ei ole olemassa kovinkaan kauan, tai ne ovat teoreettisia ja niitä ei ole vielä havaittu.
Jokaista alkuainetta nimitetään sen kemiallisella tunnuksella (kuten H, N, O, C ja Na), ja niillä on ainutlaatuisia ominaisuuksia. Näiden ainutlaatuisten ominaisuuksien ansiosta alkuaineet voivat yhdistyä ja sitoutua toisiinsa tietyillä tavoilla.
Atomeja
Atomi on alkuaineen pienin komponentti, joka säilyttää kaikki kyseisen alkuaineen kemialliset ominaisuudet. Esimerkiksi yhdellä vetyatomilla on kaikki alkuaineen vedyn ominaisuudet, kuten se esiintyy kaasuna huoneenlämmössä, ja se sitoutuu hapen kanssa muodostaen vesimolekyylin. Vetyatomia ei voi hajottaa mihinkään pienempään, mutta se säilyttää silti vedyn ominaisuudet. Jos vetyatomi hajotettaisiin subatomisiksi hiukkasiksi, sillä ei enää olisi vedyn ominaisuuksia.
Alkeellisimmillaan kaikki eliöt koostuvat alkuaineiden yhdistelmästä. Ne sisältävät atomeja, jotka yhdistyvät toisiinsa muodostaen molekyylejä. Monisoluisissa eliöissä, kuten eläimissä, molekyylit voivat vuorovaikutuksessa muodostaa soluja, jotka yhdistyvät kudoksiksi, jotka muodostavat elimet. Nämä yhdistymiset jatkuvat, kunnes muodostuu kokonaisia monisoluisia eliöitä.

Kuva 1. Atomit koostuvat protoneista ja neutroneista, jotka sijaitsevat ytimessä, ja elektroneista, jotka ympäröivät ydintä.
Kaikki atomit sisältävät protoneja, elektroneja ja neutroneita (kuva 1). Ainoa poikkeus on vety (H), joka koostuu yhdestä protonista ja yhdestä elektronista. Protonilla on positiivisesti varautunut hiukkanen, joka sijaitsee atomin ytimessä (atomin ytimessä) ja jonka massa on 1 ja varaus +1. Elektroni on negatiivisesti varautunut hiukkanen, joka liikkuu ydintä ympäröivässä tilassa. Toisin sanoen se sijaitsee ytimen ulkopuolella. Sen massa on häviävän pieni, ja sen varaus on -1.
Neutronit, kuten protonitkin, sijaitsevat atomin ytimessä. Niiden massa on 1 eikä niillä ole varausta. Positiiviset (protonit) ja negatiiviset (elektronit) varaukset tasapainottavat toisiaan neutraalissa atomissa, jonka nettovaraus on nolla.
Koska protonien ja neutronien massa on kumpikin 1, atomin massa on yhtä suuri kuin kyseisen atomin protonien ja neutronien lukumäärä. Elektronien määrä ei vaikuta kokonaismassaan, koska niiden massa on niin pieni.
Kuten aiemmin todettiin, jokaisella alkuaineella on omat ainutlaatuiset ominaisuutensa. Jokainen sisältää eri määrän protoneja ja neutroneita, mikä antaa sille oman atomiluvun ja massaluvun. Alkuaineen järjestysluku on yhtä suuri kuin kyseisen alkuaineen sisältämien protonien määrä. Massaluku on kyseisen alkuaineen protonien lukumäärä plus neutronien lukumäärä. Siksi neutronien lukumäärä voidaan määrittää vähentämällä atomiluku massaluvusta.
Nämä luvut antavat tietoa alkuaineista ja siitä, miten ne reagoivat yhdistyessään. Eri alkuaineilla on erilaiset sulamis- ja kiehumispisteet, ja ne ovat eri tiloissa (neste, kiinteä tai kaasu) huoneenlämmössä. Ne myös yhdistyvät eri tavoin. Jotkut muodostavat tietyntyyppisiä sidoksia, toiset taas eivät. Se, miten ne yhdistyvät, perustuu läsnä olevien elektronien määrään. Näiden ominaisuuksien vuoksi alkuaineet on järjestetty alkuaineiden jaksolliseen järjestelmään, joka on alkuaineita kuvaava taulukko, joka sisältää kunkin alkuaineen järjestysluvun ja suhteellisen atomimassan. Jaksollisessa järjestelmässä on myös keskeisiä tietoja alkuaineiden ominaisuuksista (kuva 2), jotka on usein merkitty värikoodein. Taulukon järjestely osoittaa myös, miten kunkin alkuaineen elektronit ovat järjestäytyneet, ja antaa tärkeitä tietoja siitä, miten atomit reagoivat keskenään muodostaen molekyylejä.
Isotoopit ovat saman alkuaineen eri muotoja, joilla on sama määrä protoneja, mutta eri määrä neutroneita. Joillakin alkuaineilla, kuten hiilellä, kaliumilla ja uraanilla, on luonnossa esiintyviä isotooppeja. Hiili-12, hiilen yleisin isotooppi, sisältää kuusi protonia ja kuusi neutronia. Sen massaluku on siis 12 (kuusi protonia ja kuusi neutronia) ja järjestysluku 6 (mikä tekee siitä hiilen). Hiili-14 sisältää kuusi protonia ja kahdeksan neutronia. Sen massaluku on siis 14 (kuusi protonia ja kahdeksan neutronia) ja järjestysluku 6, eli se on edelleen hiili. Nämä kaksi hiilen vaihtoehtoista muotoa ovat isotooppeja. Jotkin isotoopit ovat epävakaita, ja ne menettävät protoneja, muita subatomisia hiukkasia tai energiaa muodostaen vakaampia alkuaineita. Näitä kutsutaan radioaktiivisiksi isotoopeiksi tai radioisotoopeiksi.
Art Connection

Kuva 2. Alkuaineiden ominaisuuksien perusteella sarakkeisiin ja riveihin järjestetty jaksollinen järjestelmä antaa keskeistä tietoa alkuaineista ja siitä, miten ne voivat olla vuorovaikutuksessa toistensa kanssa muodostaen molekyylejä. Useimmissa jaksollisuustaulukoissa on avain tai legenda niiden sisältämille tiedoille.
Miten monta neutronia on (K)kalium-39:llä ja kalium-40:llä?
Evoluutio toiminnassa
Hiiliajoitus

Kuvio 3. Jaksollinen jaksollinen jaksollinen jakso. Hiiltä sisältävien ja alle noin 50 000 vuotta vanhojen jäännösten, kuten tämän kääpiömammutin, ikä voidaan määrittää hiilidatan avulla. (luotto: Bill Faulkner/NPS)
Hiili-14 (14C) on luonnossa esiintyvä radioisotooppi, jota syntyy ilmakehässä kosmisista säteistä. Tämä on jatkuva prosessi, joten 14C:tä syntyy aina lisää. Kun elävä organismi kehittyy, sen elimistön suhteellinen 14C-pitoisuus vastaa ilmakehän 14C-pitoisuutta. Kun organismi kuolee, se ei enää ime 14C:tä, joten suhde pienenee. 14C hajoaa 14N:ksi prosessissa, jota kutsutaan beetahajoamiseksi; se luovuttaa energiaa tässä hitaassa prosessissa.
Noin 5730 vuoden kuluttua vain puolet 14C:n alkupitoisuudesta on muuttunut 14N:ksi. Aikaa, joka kuluu siihen, että puolet isotoopin alkuperäisestä pitoisuudesta hajoaa vakaampaan muotoonsa, kutsutaan isotoopin puoliintumisajaksi. Koska 14C:n puoliintumisaika on pitkä, sitä käytetään entisten elävien esineiden, kuten fossiilien, vanhentamiseen. Käyttämällä esineen 14C-pitoisuuden ja ilmakehässä havaitun 14C:n määrän suhdetta voidaan määrittää isotoopin määrä, joka ei ole vielä hajonnut. Tämän määrän perusteella fossiilin iäksi voidaan laskea noin 50 000 vuotta (kuva 3). Isotooppeja, joiden puoliintumisaika on pidempi, kuten kalium-40:tä, käytetään vanhempien fossiilien iän laskemiseen. Hiiliajoituksen avulla tutkijat voivat rekonstruoida viimeisten 50 000 vuoden aikana eläneiden eliöiden ekologiaa ja biogeografiaa.
Konsepti toiminnassa
Tämässä simulaatiossa opit lisää atomeista ja isotoopeista sekä siitä, miten voit erottaa isotoopin toisesta.
Kemialliset sidokset
Miten alkuaineet ovat vuorovaikutuksessa keskenään, riippuu siitä, miten niiden elektronit ovat järjestäytyneet ja kuinka monta aukkoa elektroneille on uloimmalla alueella, jossa atomissa on elektroneja. Elektronit ovat olemassa energiatasoilla, jotka muodostavat kuoria ytimen ympärille. Lähimpään kuoreen voi mahtua enintään kaksi elektronia. Ydintä lähin kuori täyttyy aina ensin, ennen kuin mikään muu kuori voi täyttyä. Vedyllä on yksi elektroni, joten sillä on vain yksi paikka alimmassa kuoressa. Heliumilla on kaksi elektronia, joten se voi täyttää alimman kuoren kokonaan kahdella elektronillaan. Jos tarkastelet jaksollista järjestelmää, huomaat, että vety ja helium ovat ainoat alkuaineet ensimmäisellä rivillä. Tämä johtuu siitä, että niillä on elektroneja vain ensimmäisellä kuorella. Vety ja helium ovat ainoat alkuaineet, joilla on alin kuori eikä muita kuoria.
Toiselle ja kolmannelle energiatasolle voi mahtua jopa kahdeksan elektronia. Kahdeksan elektronia on järjestetty neljään pariin, ja jokaisen parin yksi paikka täytetään elektronilla ennen kuin yksikään pari on valmis.
Katsomalla jaksollista järjestelmää uudelleen (kuva 2) huomaat, että siinä on seitsemän riviä. Nämä rivit vastaavat kuorien lukumäärää, joka kyseisellä rivillä olevilla alkuaineilla on. Tietyn rivin sisällä olevilla alkuaineilla on yhä enemmän elektroneja, kun sarakkeet etenevät vasemmalta oikealle. Vaikka jokaisella alkuaineella on sama määrä kuoria, kaikki kuoret eivät ole täysin täynnä elektroneja. Jos tarkastelet jaksollisen järjestelmän toista riviä, löydät litiumin (Li), berylliumin (Be), boorin (B), hiilen (C), typen (N), hapen (O), fluorin (F) ja neonin (Ne). Näillä kaikilla on elektroneja, jotka käyttävät vain ensimmäistä ja toista kuorta. Litiumilla on uloimmassa kuoressaan vain yksi elektroni, berylliumilla kaksi elektronia, boorilla kolme ja niin edelleen, kunnes koko kuori on täynnä kahdeksan elektronia, kuten neonilla.
Kaikkeilla alkuaineilla ei ole tarpeeksi elektroneja täyttääkseen uloimmat kuorensa, mutta atomi on stabiilimmillaan silloin, kun kaikki uloimman kuoren elektronipaikat ovat täynnä. Näiden uloimpien kuorien vapaiden paikkojen vuoksi muodostuu kemiallisia sidoksia eli kahden tai useamman saman tai eri alkuaineen välisiä vuorovaikutuksia, jotka johtavat molekyylien muodostumiseen. Saavuttaakseen suuremman vakauden atomit pyrkivät täyttämään uloimmat kuorensa kokonaan ja sitoutuvat muiden alkuaineiden kanssa tämän tavoitteen saavuttamiseksi jakamalla elektroneja, ottamalla vastaan elektroneja toiselta atomilta tai luovuttamalla elektroneja toiselle atomille. Koska matalan järjestysluvun omaavien alkuaineiden (aina kalsiumiin asti, jonka järjestysluku on 20) uloimmille kuorille mahtuu kahdeksan elektronia, tätä kutsutaan oktettisäännöksi. Alkuaine voi luovuttaa, ottaa vastaan tai jakaa elektroneja muiden alkuaineiden kanssa täyttääkseen ulomman kuorensa ja täyttääkseen oktettisäännön.

Kuvio 4. Elektronien luovuttaminen, vastaanottaminen ja jakaminen. Alkuaineilla on taipumus täyttää uloimmat kuorensa elektroneilla. Tätä varten ne voivat joko luovuttaa tai ottaa vastaan elektroneja muilta alkuaineilta.
Kun atomissa ei ole yhtä monta protonia ja elektronia, sitä kutsutaan ioniksi. Koska elektronien määrä ei ole yhtä suuri kuin protonien määrä, jokaisella ionilla on nettovaraus. Positiiviset ionit muodostuvat menettämällä elektroneja, ja niitä kutsutaan kationeiksi. Negatiiviset ionit muodostuvat voittamalla elektroneja, ja niitä kutsutaan anioneiksi. Alkuaineiden anionien nimet muutetaan päättymään -idiin.
Esimerkiksi natriumilla on vain yksi elektroni uloimmassa kuoressaan. Natriumilta kuluu vähemmän energiaa tuon yhden elektronin luovuttamiseen kuin seitsemän uuden elektronin vastaanottamiseen uloimman kuoren täyttämiseksi. Jos natrium menettää elektronin, sillä on nyt 11 protonia ja vain 10 elektronia, jolloin sen kokonaisvaraus on +1. Sitä kutsutaan nyt natriumioniksi.
Klooriatomilla on seitsemän elektronia uloimmassa kuoressaan. Tässäkin tapauksessa kloorille on energiatehokkaampaa saada yksi elektroni kuin menettää seitsemän. Siksi se pyrkii saamaan elektronin luodakseen ionin, jossa on 17 protonia ja 18 elektronia, mikä antaa sille negatiivisen (-1) nettovarauksen. Sitä kutsutaan nyt kloridi-ioniksi. Tätä elektronien siirtymistä alkuaineesta toiseen kutsutaan elektroninsiirroksi. Kuten kuvasta 4 käy ilmi, natriumatomilla (Na) on vain yksi elektroni uloimmassa kuoressaan, kun taas klooriatomilla (Cl) on seitsemän elektronia uloimmassa kuoressaan. Natriumatomi luovuttaa yhden elektroninsa tyhjentääkseen kuorensa, ja klooriatomi ottaa kyseisen elektronin vastaan täyttääkseen kuorensa, jolloin siitä tulee kloridia. Molemmat ionit täyttävät nyt oktettisäännön ja niillä on täydet uloimmat kuoret. Koska elektronien määrä ei ole enää yhtä suuri kuin protonien määrä, kumpikin on nyt ioni ja sillä on +1 (natrium) tai -1 (kloridi) varaus.
Ionisidokset
On olemassa neljänlaisia sidoksia tai vuorovaikutuksia: ionisidoksia, kovalenttisia sidoksia, vetysidoksia ja van der Waalsin vuorovaikutuksia. Ioniset ja kovalenttiset sidokset ovat vahvoja vuorovaikutuksia, jotka vaativat suuremman energiapanoksen hajotakseen. Kun alkuaine luovuttaa elektronin ulommasta kuorestaan, kuten edellä olevassa natriumatomin esimerkissä, muodostuu positiivinen ioni. Elektronin vastaanottava alkuaine on nyt negatiivisesti varautunut. Koska positiiviset ja negatiiviset varaukset vetävät puoleensa, nämä ionit pysyvät yhdessä ja muodostavat ionisidoksen eli ionien välisen sidoksen. Alkuaineet sitoutuvat toisiinsa siten, että yhden alkuaineen elektroni pysyy pääasiassa toisessa alkuaineessa. Kun Na+- ja Cl-ionit yhdistyvät muodostaen NaCl:n, natriumatomin elektroni pysyy klooriatomin toisen seitsemän elektronin kanssa, ja natrium- ja kloridi-ionit vetävät toisiaan puoleensa ioneista koostuvassa hilassa, jossa on nettomääräinen nollavaraus.
Kovalenttiset sidokset
Toinen kahden tai useamman atomin välisen vahvan kemiallisen sidoksen tyyppi on kovalenttinen sidos. Nämä sidokset muodostuvat, kun elektroni jaetaan kahden alkuaineen välillä, ja ne ovat vahvin ja yleisin kemiallisen sidoksen muoto elävissä organismeissa. Kovalenttiset sidokset muodostuvat solujemme biologisten molekyylien muodostavien alkuaineiden välille. Toisin kuin ionisidokset, kovalenttiset sidokset eivät dissosioidu vedessä.
Vety- ja happiatomit, jotka yhdistyvät muodostaen vesimolekyylejä, ovat sitoutuneet toisiinsa kovalenttisilla sidoksilla. Vetyatomin elektroni jakaa aikansa vetyatomin ulkokuoren ja happiatomin epätäydellisen ulkokuoren välillä. Happiatomin ulkokuoren täydelliseen täyttämiseen tarvitaan kaksi elektronia kahdesta vetyatomista, minkä vuoksi H2O:ssa on alaviite ”2”. Elektronit jaetaan atomien kesken, jolloin ne ”täyttävät” kummankin atomin ulkokuoren. Tämä jakaminen on kaikille mukana oleville atomeille alhaisempi energiatila kuin jos ne olisivat olemassa ilman täytettyjä ulkokuoria.
Kovalenttisia sidoksia on kahdenlaisia: polaarisia ja poolittomia. Eipolaariset kovalenttiset sidokset muodostuvat kahden saman alkuaineen atomin tai eri alkuaineiden välillä, jotka jakavat elektronit tasan. Esimerkiksi happiatomi voi sitoutua toisen happiatomin kanssa täyttääkseen niiden ulommat kuoret. Tämä sidos on pooliton, koska elektronit jakautuvat tasaisesti kummankin happiatomin kesken. Kahden happiatomin välille muodostuu kaksi kovalenttista sidosta, koska happi tarvitsee kaksi jaettua elektronia täyttääkseen uloimman kuorensa. Typpiatomit muodostavat kahden typpiatomin välille kolme kovalenttista sidosta (joita kutsutaan myös kolmoiskovalenttisiksi), koska kukin typpiatomi tarvitsee kolme elektronia täyttääkseen uloimman kuorensa. Toinen esimerkki poolittomasta kovalenttisesta sidoksesta on metaanimolekyylissä (CH4). Hiiliatomilla on neljä elektronia uloimmassa kuoressaan, ja se tarvitsee vielä neljä elektronia täyttääkseen sen. Se saa nämä neljä elektronia neljältä vetyatomilta, joista kukin antaa yhden. Nämä alkuaineet jakavat kaikki elektronit tasan, jolloin syntyy neljä ei-polaarista kovalenttista sidosta (kuva 5).
Polaarisessa kovalenttisessa sidoksessa atomien jakamat elektronit viettävät enemmän aikaa lähempänä yhtä ydintä kuin toista ydintä. Koska elektronit jakautuvat epätasaisesti eri ytimien kesken, syntyy hieman positiivinen (δ+) tai hieman negatiivinen (δ-) varaus. Veden vety- ja happiatomien väliset kovalenttiset sidokset ovat polaarisia kovalenttisia sidoksia. Jaetut elektronit viettävät enemmän aikaa hapen ytimen lähellä, mikä antaa sille pienen negatiivisen varauksen, kuin ne viettävät aikaa vedyn ytimien lähellä, mikä antaa näille molekyyleille pienen positiivisen varauksen.

Kuva 5. Vesimolekyyli (vasemmalla) kuvaa polaarista sidosta, jossa vetyatomien varaus on hieman positiivinen ja hapen varaus hieman negatiivinen. Esimerkkejä poolittomista sidoksista ovat metaani (keskellä) ja happi (oikealla).
Vetysidokset
Ioniset ja kovalenttiset sidokset ovat vahvoja sidoksia, joiden katkeaminen vaatii huomattavaa energiaa. Kaikki alkuaineiden väliset sidokset eivät kuitenkaan ole ionisia tai kovalenttisia sidoksia. Myös heikompia sidoksia voi muodostua. Nämä ovat positiivisten ja negatiivisten varausten välisiä vetovoimatekijöitä, joiden katkeaminen ei vaadi paljon energiaa. Kaksi usein esiintyvää heikkoa sidosta ovat vetysidokset ja van der Waalsin vuorovaikutukset. Nämä sidokset synnyttävät veden ainutlaatuiset ominaisuudet ja DNA:n ja proteiinien ainutlaatuiset rakenteet.
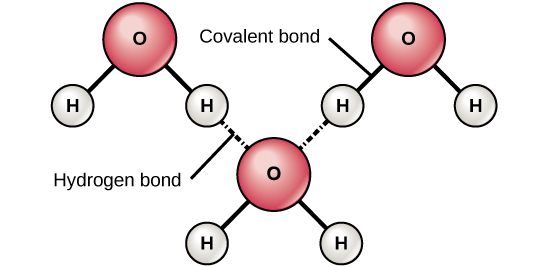
Kuva 6. Veden ainutlaatuiset ominaisuudet. Vetysidokset muodostuvat polaaristen kovalenttisten molekyylien, kuten veden, lievästi positiivisten (δ+) ja lievästi negatiivisten (δ-) varausten välille.
Kun polaariset kovalenttiset sidokset, jotka sisältävät vetyatomin, muodostuvat, sidoksen vetyatomilla on lievästi positiivinen varaus. Tämä johtuu siitä, että jaettu elektroni vetäytyy voimakkaammin kohti toista alkua ja poispäin vetyytimestä. Koska vetyatomi on lievästi positiivinen (δ+), se vetää puoleensa viereisiä negatiivisia osittaisvarauksia (δ-). Kun näin tapahtuu, toisen molekyylin vetyatomin δ+ -varauksen ja toisen molekyylin δ- -varauksen välillä syntyy heikko vuorovaikutus. Tätä vuorovaikutusta kutsutaan vetysidokseksi. Tämäntyyppiset sidokset ovat yleisiä; esimerkiksi veden nestemäinen luonne johtuu vesimolekyylien välisistä vetysidoksista (kuva 6). Vetysidokset antavat vedelle ainutlaatuiset ominaisuudet, jotka ylläpitävät elämää. Ilman vetysidoksia vesi olisi huoneenlämmössä pikemminkin kaasu kuin neste.
Vetysidokset voivat muodostua eri molekyylien välille, eikä niiden tarvitse aina sisältää vesimolekyyliä. Minkä tahansa molekyylin sisällä polaarisissa sidoksissa olevat vetyatomit voivat muodostaa sidoksia muiden viereisten molekyylien kanssa. Vetysidokset pitävät esimerkiksi kaksi pitkää DNA-juostetta yhdessä, mikä antaa DNA-molekyylille sen luonteenomaisen kaksisäikeisen rakenteen. Vetysidokset vastaavat myös osasta proteiinien kolmiulotteista rakennetta.
van der Waalsin vuorovaikutukset
Vetysidosten tavoin van der Waalsin vuorovaikutukset ovat heikkoja vetovoimatekijöitä tai vuorovaikutuksia molekyylien välillä. Niitä esiintyy eri molekyylien polaaristen, kovalenttisesti sidottujen atomien välillä. Osa näistä heikoista vetovoimatekijöistä johtuu tilapäisistä osittaisvarauksista, jotka muodostuvat elektronien liikkuessa ytimen ympärillä. Nämä molekyylien väliset heikot vuorovaikutukset ovat tärkeitä biologisissa järjestelmissä.
Yhteenveto
Aine on kaikkea, mikä vie tilaa ja jolla on massaa. Se koostuu eri alkuaineiden atomeista. Kaikilla luonnossa esiintyvillä 92 alkuaineella on ainutlaatuisia ominaisuuksia, joiden ansiosta ne voivat yhdistyä eri tavoin muodostaen yhdisteitä tai molekyylejä. Atomit, jotka koostuvat protoneista, neutroneista ja elektroneista, ovat alkuaineen pienimpiä yksiköitä, jotka säilyttävät kaikki kyseisen alkuaineen ominaisuudet. Atomien välillä voidaan luovuttaa tai jakaa elektroneja, jolloin syntyy sidoksia, kuten ionisidoksia, kovalenttisia sidoksia ja vetysidoksia sekä van der Waalsin vuorovaikutuksia.
Lisätehtäviä itsetarkistukseen
1. Katso kuvaa 2: Kuinka monta neutronia on (K)kalium-39:ssä ja kalium-40:ssä?
2. Miksi vetysidokset ja van der Waalsin vuorovaikutukset ovat välttämättömiä soluille?
Vastaukset
1. Kalium-39:ssä on kaksikymmentä neutronia. Kalium-40:ssä on kaksikymmentäyksi neutronia.
2. Vetysidokset ja van der Waalsin vuorovaikutukset muodostavat heikkoja yhteyksiä eri molekyylien välille. Ne antavat proteiineille ja DNA:lle soluissa tarvittavan rakenteen ja muodon, jotta ne toimisivat oikein. Vetysidokset antavat myös vedelle sen ainutlaatuiset ominaisuudet, jotka ovat välttämättömiä elämälle.