Cele nauczania
Do końca tego rozdziału, będziesz w stanie:
- Opisać materię i pierwiastki
- Opisać wzajemne powiązania między protonami, neutronami i elektronami oraz sposoby, w jakie elektrony mogą być oddawane lub dzielone między atomy
Na swoim najbardziej podstawowym poziomie, życie składa się z materii. Materia zajmuje przestrzeń i ma masę. Cała materia składa się z elementów, substancji, które nie mogą być rozbite lub przekształcone chemicznie w inne substancje. Każdy pierwiastek jest zbudowany z atomów, z których każdy ma stałą liczbę protonów i unikalne właściwości. W sumie zdefiniowano 118 pierwiastków, ale tylko 92 występują naturalnie, a mniej niż 30 znajduje się w żywych komórkach. Pozostałe 26 pierwiastków jest niestabilnych i dlatego nie istnieją bardzo długo lub są teoretyczne i nie zostały jeszcze wykryte.
Każdy pierwiastek jest oznaczony symbolem chemicznym (takim jak H, N, O, C i Na) i posiada unikalne właściwości. Te unikalne właściwości pozwalają pierwiastkom łączyć się i wiązać ze sobą w specyficzny sposób.
Atomy
Atom jest najmniejszym składnikiem pierwiastka, który zachowuje wszystkie właściwości chemiczne tego pierwiastka. Na przykład, jeden atom wodoru ma wszystkie właściwości pierwiastka wodoru, takie jak to, że istnieje jako gaz w temperaturze pokojowej, i wiąże się z tlenem, aby utworzyć cząsteczkę wody. Atomu wodoru nie da się rozłożyć na nic mniejszego, zachowując przy tym właściwości wodoru. Jeśli atom wodoru został rozbity na cząstki subatomowe, nie miałby już właściwości wodoru.
Na najbardziej podstawowym poziomie, wszystkie organizmy są wykonane z kombinacji elementów. Zawierają one atomy, które łączą się ze sobą tworząc cząsteczki. W organizmach wielokomórkowych, takich jak zwierzęta, cząsteczki mogą oddziaływać na siebie, tworząc komórki, które łączą się w tkanki, które tworzą narządy. Kombinacje te trwają do momentu powstania całych organizmów wielokomórkowych.

Rysunek 1. Atomy zbudowane są z protonów i neutronów znajdujących się w jądrze oraz elektronów otaczających jądro.
Wszystkie atomy zawierają protony, elektrony i neutrony (rysunek 1). Jedynym wyjątkiem jest wodór (H), który jest zbudowany z jednego protonu i jednego elektronu. Proton jest dodatnio naładowaną cząstką, która znajduje się w jądrze (rdzeniu atomu) atomu, ma masę 1 i ładunek +1. Elektron jest ujemnie naładowaną cząstką, która porusza się w przestrzeni wokół jądra. Innymi słowy, przebywa poza jądrem. Ma znikomą masę i ma ładunek -1.
Neutrony, podobnie jak protony, rezydują w jądrze atomu. Mają one masę 1 i nie mają ładunku. Ładunki dodatnie (protony) i ujemne (elektrony) równoważą się w atomie obojętnym, który ma ładunek netto równy zero.
Ponieważ protony i neutrony mają masę 1, masa atomu jest równa liczbie protonów i neutronów tego atomu. Liczba elektronów nie ma wpływu na ogólną masę, ponieważ ich masa jest tak mała.
Jak stwierdzono wcześniej, każdy element ma swoje własne unikalne właściwości. Każdy z nich zawiera inną liczbę protonów i neutronów, co daje mu jego własną liczbę atomową i liczbę masową. Liczba atomowa pierwiastka jest równa liczbie protonów, które zawiera dany pierwiastek. Liczba masowa to liczba protonów plus liczba neutronów danego pierwiastka. Dlatego możliwe jest określenie liczby neutronów przez odjęcie liczby atomowej od liczby masowej.
Liczby te dostarczają informacji o elementach i o tym, jak będą reagować po połączeniu. Różne elementy mają różne temperatury topnienia i wrzenia, i są w różnych stanach (ciecz, ciało stałe, lub gaz) w temperaturze pokojowej. Łączą się one również w różny sposób. Niektóre z nich tworzą specyficzne rodzaje wiązań, podczas gdy inne nie. To, jak się łączą, zależy od liczby obecnych elektronów. Ze względu na te cechy, pierwiastki są ułożone w układzie okresowym pierwiastków, który zawiera liczbę atomową i względną masę atomową każdego pierwiastka. Układ okresowy dostarcza również kluczowych informacji o właściwościach pierwiastków (Rysunek 2) – często oznaczonych kolorami. Układ okresowy pokazuje również, jak zorganizowane są elektrony w każdym pierwiastku i dostarcza ważnych szczegółów o tym, jak atomy będą reagować ze sobą, tworząc cząsteczki.
Izotopy są różnymi formami tego samego pierwiastka, które mają tę samą liczbę protonów, ale inną liczbę neutronów. Niektóre elementy, takie jak węgiel, potas i uran, mają naturalnie występujące izotopy. Węgiel-12, najbardziej rozpowszechniony izotop węgla, zawiera sześć protonów i sześć neutronów. Dlatego jego liczba masowa wynosi 12 (sześć protonów i sześć neutronów), a liczba atomowa 6 (co czyni go węglem). Węgiel-14 zawiera sześć protonów i osiem neutronów. Dlatego ma on liczbę masową 14 (sześć protonów i osiem neutronów) i liczbę atomową 6, co oznacza, że nadal jest to pierwiastek węgiel. Te dwie alternatywne formy węgla to izotopy. Niektóre izotopy są niestabilne i tracą protony, inne cząstki subatomowe lub energię, tworząc bardziej stabilne pierwiastki. Są one nazywane izotopami promieniotwórczymi lub radioizotopami.
Art Connection

Rysunek 2. Układ okresowy, ułożony w kolumnach i rzędach na podstawie cech pierwiastków, dostarcza kluczowych informacji o pierwiastkach i o tym, jak mogą one oddziaływać ze sobą, tworząc cząsteczki. Większość układów okresowych zawiera klucz lub legendę do zawartych w nich informacji.
Ile neutronów mają odpowiednio (K) potas-39 i potas-40?
Ewolucja w działaniu
Datowanie węglem

Rysunek 3. Wiek szczątków, które zawierają węgiel i mają mniej niż około 50 000 lat, takich jak ten mamut pigmejski, można określić za pomocą datowania węglowego. (kredyt: Bill Faulkner/NPS)
Węgiel-14 (14C) jest naturalnie występującym radioizotopem, który jest tworzony w atmosferze przez promienie kosmiczne. Jest to proces ciągły, więc zawsze powstaje więcej 14C. Gdy żywy organizm się rozwija, względny poziom 14C w jego ciele jest równy stężeniu 14C w atmosferze. Kiedy organizm umiera, nie pobiera już 14C, więc stosunek ten będzie się zmniejszał. 14C rozpada się do 14N w procesie zwanym rozpadem beta; w tym powolnym procesie wydziela energię.
Po około 5730 latach tylko połowa początkowego stężenia 14C zostanie przekształcona w 14N. Czas potrzebny na rozpad połowy początkowego stężenia izotopu do jego bardziej stabilnej formy nazywamy okresem połowicznego zaniku. Ponieważ okres połowicznego zaniku 14C jest długi, wykorzystuje się go do starzenia dawniej żyjących obiektów, takich jak skamieniałości. Stosując stosunek stężenia 14C znalezionego w obiekcie do ilości 14C wykrytej w atmosferze, można określić ilość izotopu, która nie uległa jeszcze rozpadowi. Na podstawie tej ilości można obliczyć wiek skamieniałości na około 50 000 lat (Rysunek 3). Izotopy o dłuższych okresach półtrwania, takie jak potas-40, są używane do obliczania wieku starszych skamieniałości. Dzięki datowaniu węglem naukowcy mogą zrekonstruować ekologię i biogeografię organizmów żyjących w ciągu ostatnich 50 000 lat.
Koncepcja w działaniu
Ta symulacja pokazuje więcej o atomach i izotopach oraz jak można odróżnić jeden izotop od drugiego.
Wiązania chemiczne
Jak elementy oddziałują ze sobą zależy od tego jak ich elektrony są rozmieszczone i ile otworów dla elektronów istnieje w najbardziej zewnętrznym regionie, gdzie elektrony są obecne w atomie. Elektrony istnieją na poziomach energetycznych, które tworzą powłoki wokół jądra. Najbliższa powłoka może pomieścić do dwóch elektronów. Powłoka najbliższa jądru jest zawsze zapełniana jako pierwsza, przed zapełnieniem jakiejkolwiek innej powłoki. Wodór posiada jeden elektron; dlatego ma tylko jedno miejsce zajęte w najniższej powłoce. Hel ma dwa elektrony, dlatego może całkowicie wypełnić najniższą powłokę swoimi dwoma elektronami. Jeśli spojrzysz na układ okresowy, zobaczysz, że wodór i hel są jedynymi dwoma pierwiastkami w pierwszym rzędzie. Dzieje się tak dlatego, że mają one tylko elektrony w swojej pierwszej powłoce. Wodór i hel są jedynymi dwoma elementami, które mają najniższą powłokę i żadnych innych shells.
Drugie i trzecie poziomy energetyczne mogą pomieścić do ośmiu elektronów. Osiem elektronów jest ułożonych w cztery pary i jedna pozycja w każdej parze jest wypełniona elektronem zanim jakiekolwiek pary zostaną uzupełnione.
Patrząc ponownie na układ okresowy (rysunek 2), można zauważyć, że istnieje siedem rzędów. Rzędy te odpowiadają liczbie powłok, które mają pierwiastki w tym rzędzie. Pierwiastki w danym rzędzie mają coraz większą liczbę elektronów w kolumnach od lewej do prawej. Chociaż każdy element ma taką samą liczbę powłok, nie wszystkie z nich są całkowicie wypełnione elektronami. Jeśli spojrzysz na drugi rząd układu okresowego, znajdziesz tam lit (Li), beryl (Be), bor (B), węgiel (C), azot (N), tlen (O), fluor (F) i neon (Ne). Wszystkie one posiadają elektrony, które zajmują tylko pierwszą i drugą powłokę. Lit ma tylko jeden elektron w swojej najbardziej zewnętrznej powłoce, beryl ma dwa elektrony, bor ma trzy, i tak dalej, aż cała powłoka jest wypełniona ośmioma elektronami, jak w przypadku neonu.
Nie wszystkie elementy mają wystarczająco dużo elektronów, aby wypełnić swoje najbardziej zewnętrzne powłoki, ale atom jest najbardziej stabilny, gdy wszystkie pozycje elektronów w najbardziej zewnętrznej powłoce są wypełnione. Z powodu tych wolnych miejsc w najbardziej zewnętrznych powłokach, widzimy tworzenie się wiązań chemicznych lub interakcji pomiędzy dwoma lub więcej takimi samymi lub różnymi elementami, które skutkują tworzeniem się cząsteczek. Aby osiągnąć większą stabilność, atomy dążą do całkowitego wypełnienia swoich zewnętrznych powłok i wiążą się z innymi pierwiastkami, aby osiągnąć ten cel poprzez dzielenie się elektronami, przyjmowanie elektronów od innego atomu lub oddawanie elektronów innemu atomowi. Ponieważ najbardziej zewnętrzne powłoki pierwiastków o niskich liczbach atomowych (aż do wapnia, o liczbie atomowej 20) mogą pomieścić osiem elektronów, nazywa się to regułą oktetu. Pierwiastek może oddawać, przyjmować lub dzielić elektrony z innymi pierwiastkami, aby wypełnić swoją zewnętrzną powłokę i spełnić regułę oktetu.

Rysunek 4. Pierwiastki mają tendencję do wypełniania swoich najbardziej zewnętrznych powłok elektronami. Aby to osiągnąć, mogą oddawać lub przyjmować elektrony od innych pierwiastków.
Gdy atom nie zawiera równej liczby protonów i elektronów, nazywa się go jonem. Ponieważ liczba elektronów nie jest równa liczbie protonów, każdy jon ma ładunek netto. Jony dodatnie powstają poprzez utratę elektronów i nazywane są kationami. Jony ujemne powstają poprzez zyskanie elektronów i nazywane są anionami. Nazwy anionowe pierwiastków są zmieniane tak, aby kończyły się na -ide.
Na przykład sód ma tylko jeden elektron w swojej najbardziej zewnętrznej powłoce. Potrzeba mniej energii dla sodu, aby oddać ten jeden elektron, niż do przyjęcia siedmiu więcej elektronów, aby wypełnić zewnętrzną powłokę. Jeśli sód traci elektron, ma teraz 11 protonów i tylko 10 elektronów, pozostawiając go z ogólnym ładunkiem +1. Jest teraz nazywany jonem sodu.
Atom chloru ma siedem elektronów w swojej zewnętrznej powłoce. Ponownie, jest to bardziej wydajne energetycznie dla chloru, aby uzyskać jeden elektron niż stracić siedem. Dlatego, ma tendencję do uzyskania elektronu, aby utworzyć jon z 17 protonami i 18 elektronami, dając mu ładunek ujemny netto (-1). Jest on teraz nazywany jonem chlorkowym. Ten ruch elektronów z jednego pierwiastka do drugiego jest określany jako przeniesienie elektronu. Jak ilustruje Rysunek 4, atom sodu (Na) posiada tylko jeden elektron w swojej najbardziej zewnętrznej powłoce, podczas gdy atom chloru (Cl) posiada siedem elektronów w swojej najbardziej zewnętrznej powłoce. Atom sodu odda swój jeden elektron, aby opróżnić swoją powłokę, a atom chloru przyjmie ten elektron, aby wypełnić swoją powłokę, stając się chlorkiem. Oba jony spełniają teraz regułę oktetu i mają kompletne skrajne powłoki. Ponieważ liczba elektronów nie jest już równa liczbie protonów, każdy z nich jest teraz jonem i ma ładunek +1 (sód) lub -1 (chlorek).
Wiązania jonowe
Istnieją cztery rodzaje wiązań lub oddziaływań: jonowe, kowalencyjne, wiązania wodorowe i oddziaływania van der Waalsa. Wiązania jonowe i kowalencyjne są silnymi interakcjami, które wymagają większego wkładu energii, aby się rozdzielić. Kiedy pierwiastek oddaje elektron ze swojej zewnętrznej powłoki, jak w powyższym przykładzie atomu sodu, powstaje jon dodatni. Element przyjmujący elektron jest teraz naładowany ujemnie. Ponieważ ładunki dodatnie i ujemne przyciągają się, jony te pozostają razem i tworzą wiązanie jonowe, czyli wiązanie pomiędzy jonami. Pierwiastki łączą się ze sobą, a elektron z jednego pierwiastka pozostaje przeważnie w drugim pierwiastku. Kiedy jony Na+ i Cl- łączą się w celu wytworzenia NaCl, elektron z atomu sodu pozostaje z innymi siedmioma z atomu chloru, a jony sodu i chlorku przyciągają się wzajemnie w sieci jonów o zerowym ładunku netto.
Wiązania kowalencyjne
Innym rodzajem silnego wiązania chemicznego pomiędzy dwoma lub więcej atomami jest wiązanie kowalencyjne. Wiązania te tworzą się, gdy elektron jest dzielony między dwa elementy i są najsilniejszą i najbardziej powszechną formą wiązania chemicznego w organizmach żywych. Wiązania kowalencyjne tworzą się między elementami, które tworzą cząsteczki biologiczne w naszych komórkach. W przeciwieństwie do wiązań jonowych, wiązania kowalencyjne nie dysocjują w wodzie.
Atomy wodoru i tlenu, które łączą się, aby utworzyć cząsteczki wody są związane razem przez wiązania kowalencyjne. Elektron z atomu wodoru dzieli swój czas pomiędzy zewnętrzną powłokę atomu wodoru i niekompletną zewnętrzną powłokę atomu tlenu. Aby całkowicie wypełnić zewnętrzną powłokę atomu tlenu, potrzebne są dwa elektrony z dwóch atomów wodoru, stąd indeks „2” w H2O. Elektrony są dzielone pomiędzy atomy, dzieląc swój czas pomiędzy nimi, aby „wypełnić” zewnętrzną powłokę każdego z nich. To dzielenie jest niższy stan energii dla wszystkich zaangażowanych atomów, niż gdyby istniały bez ich zewnętrznych powłok wypełnionych.
Istnieją dwa rodzaje wiązań kowalencyjnych: polarne i niepolarne. Niepolarne wiązania kowalencyjne tworzą się między dwoma atomami tego samego elementu lub między różnymi elementami, które dzielą elektrony równo. Na przykład, atom tlenu może połączyć się z innym atomem tlenu, aby wypełnić ich zewnętrzne powłoki. To połączenie jest niepolarne, ponieważ elektrony będą równo rozmieszczone pomiędzy każdym atomem tlenu. Dwa wiązania kowalencyjne tworzą się pomiędzy dwoma atomami tlenu, ponieważ tlen wymaga dwóch współdzielonych elektronów, aby wypełnić swoją najbardziej zewnętrzną powłokę. Atomy azotu utworzą trzy wiązania kowalencyjne (zwane również potrójnie kowalencyjnymi) pomiędzy dwoma atomami azotu, ponieważ każdy atom azotu potrzebuje trzech elektronów, aby wypełnić swoją najbardziej zewnętrzną powłokę. Inny przykład niepolarnego wiązania kowalencyjnego można znaleźć w cząsteczce metanu (CH4). Atom węgla ma cztery elektrony w swojej najbardziej zewnętrznej powłoce i potrzebuje jeszcze czterech, aby ją wypełnić. Otrzymuje je od czterech atomów wodoru, z których każdy dostarcza jeden. Wszystkie te elementy dzielą elektrony równo, tworząc cztery niepolarne wiązania kowalencyjne (Rysunek 5).
W polarnym wiązaniu kowalencyjnym, elektrony dzielone przez atomy spędzają więcej czasu bliżej jednego jądra niż drugiego jądra. Z powodu nierównej dystrybucji elektronów pomiędzy różnymi jądrami, rozwija się lekko dodatni (δ+) lub lekko ujemny (δ-) ładunek. Wiązania kowalencyjne pomiędzy atomami wodoru i tlenu w wodzie są wiązaniami kowalencyjnymi polarnymi. Wspólne elektrony spędzają więcej czasu w pobliżu jądra tlenu, nadając mu niewielki ładunek ujemny, niż w pobliżu jąder wodoru, nadając tym cząsteczkom niewielki ładunek dodatni.

Ryc. 5. Cząsteczka wody (po lewej) przedstawia wiązanie polarne z lekko dodatnim ładunkiem na atomach wodoru i lekko ujemnym na tlenie. Przykłady wiązań niepolarnych obejmują metan (w środku) i tlen (po prawej).
Wiązania wodorowe
Wiązania jonowe i kowalencyjne są silnymi wiązaniami, które wymagają znacznej energii do przerwania. Jednak nie wszystkie wiązania między elementami są wiązaniami jonowymi lub kowalencyjnymi. Mogą się również tworzyć słabsze wiązania. Są to przyciągania występujące pomiędzy ładunkami dodatnimi i ujemnymi, których zerwanie nie wymaga dużej energii. Dwa często występujące słabe wiązania to wiązania wodorowe i oddziaływania van der Waalsa. Wiązania te dają początek unikalnym właściwościom wody oraz unikalnym strukturom DNA i białek.
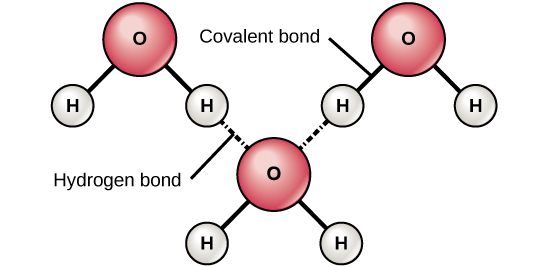
Rysunek 6. Wiązania wodorowe tworzą się pomiędzy lekko dodatnimi (δ+) i lekko ujemnymi (δ-) ładunkami polarnych cząsteczek kowalencyjnych, takich jak woda.
Gdy tworzą się polarne wiązania kowalencyjne zawierające atom wodoru, atom wodoru w tym wiązaniu ma lekko dodatni ładunek. Dzieje się tak dlatego, że wspólny elektron jest przyciągany silniej w kierunku drugiego elementu i z dala od jądra wodoru. Ponieważ atom wodoru jest lekko dodatni (δ+), będzie on przyciągany do sąsiednich ujemnych ładunków cząstkowych (δ-). Kiedy tak się dzieje, powstaje słabe oddziaływanie pomiędzy ładunkiem δ+ atomu wodoru jednej cząsteczki a ładunkiem δ- drugiej cząsteczki. To oddziaływanie nazywane jest wiązaniem wodorowym. Ten typ wiązania jest powszechny; na przykład, płynna natura wody jest spowodowana przez wiązania wodorowe pomiędzy cząsteczkami wody (Rysunek 6). Wiązania wodorowe nadają wodzie unikalne właściwości, które podtrzymują życie. Gdyby nie wiązania wodorowe, woda byłaby raczej gazem niż cieczą w temperaturze pokojowej.
Wiązania wodorowe mogą tworzyć się między różnymi cząsteczkami i nie zawsze muszą zawierać cząsteczkę wody. Atomy wodoru w wiązaniach polarnych w każdej cząsteczce mogą tworzyć wiązania z innymi sąsiednimi cząsteczkami. Na przykład, wiązania wodorowe utrzymują razem dwie długie nici DNA, nadając cząsteczce DNA jej charakterystyczną dwuniciową strukturę. Wiązania wodorowe są również odpowiedzialne za niektóre z trójwymiarowej struktury proteins.
van der Waals Interakcje
Jak wiązania wodorowe, van der Waals interakcje są słabe atrakcje lub interakcje między cząsteczkami. Występują one między polarnymi, związanymi kowalencyjnie, atomami w różnych cząsteczkach. Niektóre z tych słabych oddziaływań są spowodowane tymczasowymi ładunkami częściowymi, które powstają, gdy elektrony poruszają się wokół jądra. Te słabe interakcje między cząsteczkami są ważne w systemach biologicznych.
Podsumowanie
Materia jest wszystko, co zajmuje przestrzeń i ma masę. Składa się ona z atomów różnych pierwiastków. Wszystkie z 92 pierwiastków, które występują w przyrodzie mają unikalne właściwości, które pozwalają im łączyć się na różne sposoby tworząc związki lub cząsteczki. Atomy, które składają się z protonów, neutronów i elektronów, są najmniejszymi jednostkami danego pierwiastka, które zachowują wszystkie jego właściwości. Elektrony mogą być oddawane lub dzielone między atomy w celu utworzenia wiązań, w tym jonowych, kowalencyjnych i wodorowych, jak również oddziaływań van der Waalsa.
Dodatkowe ćwiczenia sprawdzające
1. Spójrz na rysunek 2: Ile neutronów mają odpowiednio (K) potas-39 i potas-40?
2. Dlaczego wiązania wodorowe i oddziaływania van der Waalsa są niezbędne dla komórek?
Odpowiedzi
1. Potas-39 ma dwadzieścia neutronów. Potas-40 ma dwadzieścia jeden neutronów.
2. Wiązania wodorowe i oddziaływania van der Waalsa tworzą słabe związki między różnymi cząsteczkami. Zapewniają one strukturę i kształt niezbędny dla białek i DNA w komórkach, aby mogły one prawidłowo funkcjonować. Wiązania wodorowe nadają również wodzie jej unikalne właściwości, które są niezbędne do życia.
.