Dipolární momenty
Asymetrické rozložení nábojů v polární látce, jako je HCl, vytváří dipólový momentSoučin dílčího náboje Q na vázaných atomech a vzdálenosti r mezi dílčími náboji: µ=Qr, kde Q se měří v coulombech (C) a r v metrech (m). zkráceně řecké písmeno mu (µ). Dipólový moment je definován jako součin dílčího náboje Q na vázaných atomech a vzdálenosti r mezi dílčími náboji:
rovnice 8.16
µ = Qr
kde Q se měří v coulombech (C) a r v metrech. Jednotkou pro dipólové momenty je debye (D):
rovnice 8.17
1 D = 3,3356 × 10-30 C-m
Pokud je molekula s dipólovým momentem umístěna v elektrickém poli, má tendenci se orientovat podle elektrického pole, protože má nesymetrické rozložení náboje (obr. 8).13 „Molecules That Possess a Dipole Moment Partially Align Themself with an Applied Electric Field“).
Obrázek 8.13 Molecules That Possess a Dipole Moment Partially Align Themself with an Applied Electric Field
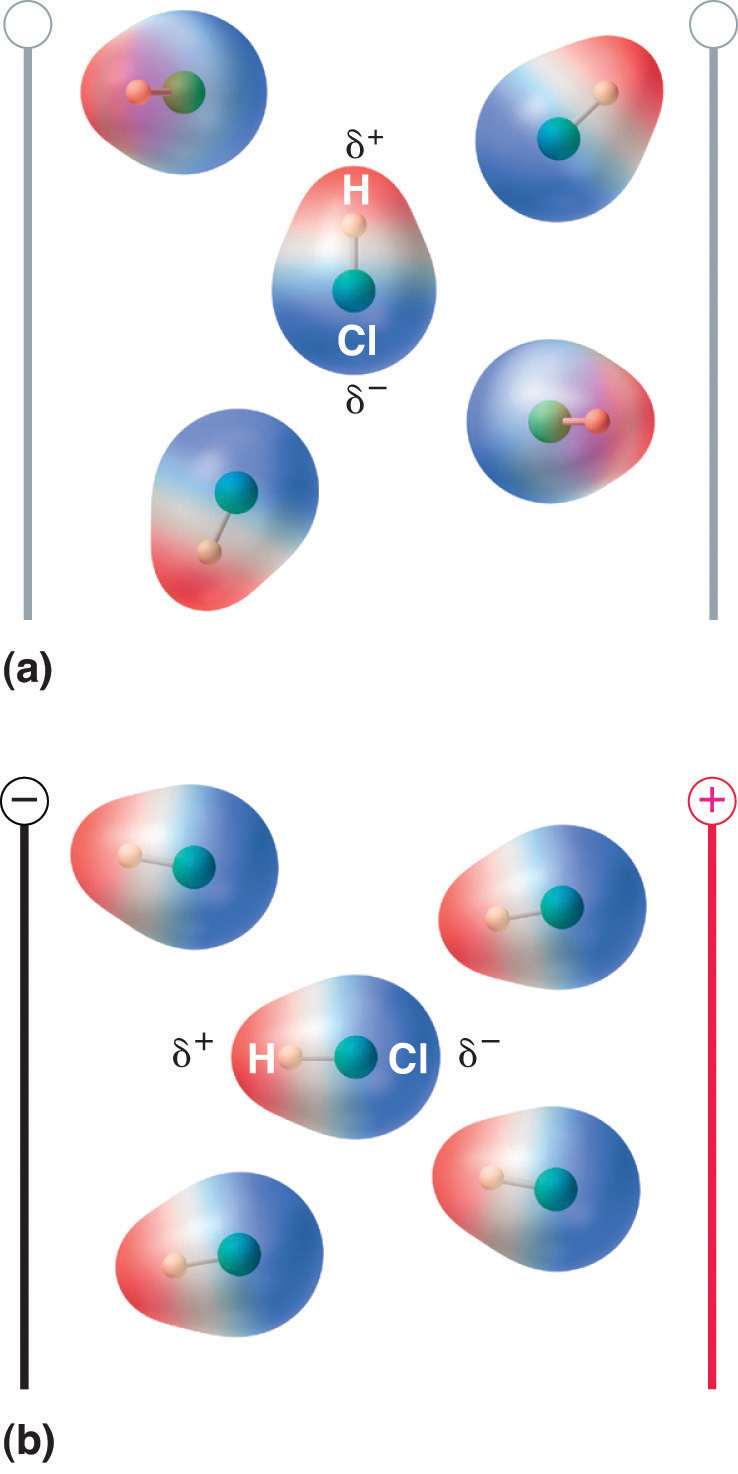
Při absenci pole (a) jsou molekuly HCl orientovány náhodně. Při aplikaci elektrického pole (b) mají molekuly tendenci se s polem vyrovnávat tak, že kladný konec molekulového dipólu směřuje k zápornému pólu a naopak.
Částečné náboje na atomech v molekule, jako je HCl, můžeme změřit pomocí rovnice 8.16.
. Pokud by vazba v HCl byla čistě iontová, došlo by k přenosu elektronu z H na Cl, takže na atomu H by byl plný náboj +1 a na atomu Cl plný náboj -1. Vazba v HCl by byla čistě iontová. Dipólový moment HCl je 1,109 D, jak se určuje měřením rozsahu jeho vyrovnání v elektrickém poli, a udávaná vzdálenost H-Cl v plynné fázi je 127,5 pm. Náboj na každém atomu je tedy
rovnice 8.18
Q = μ r = 1,109 D ( 3,3356 × 10 -30 C – m 1 D ) ( 1 127,5 pm ) ( 1 pm 10 -12 m ) = 2,901 × 10 -20 C
Vydělením této vypočtené hodnoty nábojem na jednom elektronu (1.6022 × 10-19 C) zjistíme, že náboj na atomu Cl v molekule HCl je přibližně -0,18, což odpovídá přibližně 0,18 e-:
Rovnice 8.19
2,901 × 10 -20 C 1,6022 × 10 -19 C /e – = 0,1811 e –
Aby vznikla neutrální sloučenina, musí být náboj na atomu H stejný, ale opačný. Naměřený dipólový moment HCl tedy naznačuje, že vazba H-Cl má přibližně 18 % iontový charakter (0,1811 × 100) nebo 82 % kovalentní charakter. Místo zápisu HCl jako Hδ+-Clδ- můžeme tedy kvantitativně označit oddělení nábojů jako
H 0 .18 δ + – Cl 0 .18 δ –
Naše vypočtené výsledky jsou ve shodě s rozdílem elektronegativit vodíku a chloru χH = 2,20; χCl = 3,16, χCl – χH = 0,96), což je hodnota v mezích pro polární kovalentní vazby. Dipólový moment označujeme šipkou nad molekulou.Z matematického hlediska jsou dipólové momenty vektory a mají velikost i směr. Dipólový moment molekuly je vektorový součet dipólů jednotlivých vazeb. Například u HCl je dipólový moment vyznačen takto:
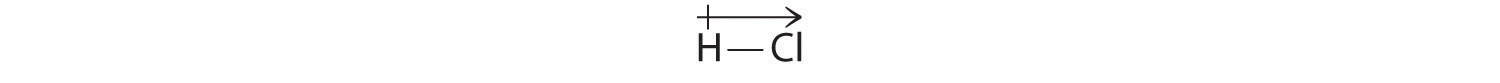
Šipka ukazuje směr toku elektronů tím, že směřuje k elektronegativnějšímu atomu.
Náboj atomů mnoha látek v plynné fázi lze vypočítat pomocí naměřených dipólových momentů a vzdáleností vazeb. Obrázek 8.14 „Graf procentuálního iontového charakteru vazby určeného z naměřených dipólových momentů v závislosti na rozdílu elektronegativity vázaných atomů“ ukazuje graf procentuálního iontového charakteru v závislosti na rozdílu elektronegativity vázaných atomů pro několik látek. Podle grafu má vazba u druhů, jako je NaCl(g) a CsF(g), podstatně méně než 100% iontový charakter. Při kondenzaci plynu do pevné látky však dipólově-dipólové interakce mezi polarizovanými druhy zvyšují nábojové separace. V krystalu tedy dochází k přenosu elektronu z kovu na nekov a tyto látky se chovají jako klasické iontové sloučeniny. Údaje na obrázku 8.14 „Graf procentuálního iontového charakteru vazby určeného z naměřených dipólových momentů v závislosti na rozdílu elektronegativit vázaných atomů“ ukazují, že dvouatomové druhy s rozdílem elektronegativit menším než 1,5 mají méně než 50% iontový charakter, což je v souladu s naším dřívějším popisem těchto druhů jako obsahujících polární kovalentní vazby. Použití dipólových momentů k určení iontového charakteru polární vazby je znázorněno v příkladu 11.
Obrázek 8.14 Graf procentuálního iontového charakteru vazby určeného z naměřených dipólových momentů v závislosti na rozdílu elektronegativity vázaných atomů
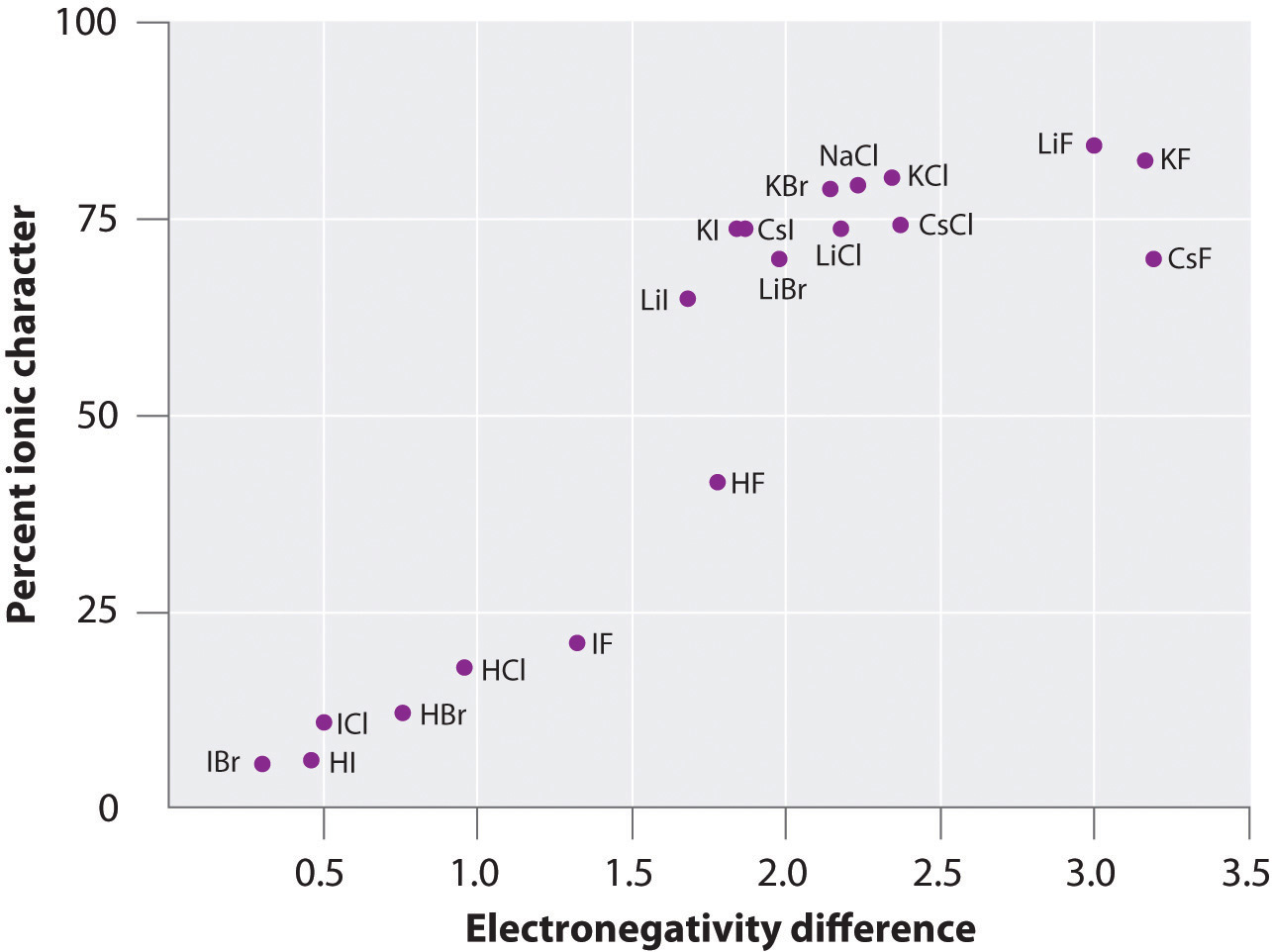
V plynné fázi není ani CsF, který má největší možný rozdíl elektronegativity mezi atomy, 100% iontový. Pevný CsF je však nejlépe považovat za 100% iontový kvůli dodatečným elektrostatickým interakcím v mřížce.
Příklad 11
V plynné fázi má NaCl dipólový moment 9,001 D a vzdálenost Na-Cl 236,1 pm. Vypočítejte procentuální iontový charakter NaCl.
Dáno: chemický druh, dipólový moment a mezijaderná vzdálenost
Zadáno: procentuální iontový charakter
Strategie:
A Vypočítejte náboj každého atomu pomocí daných informací a rovnice 8.16.
B Z poměru skutečného náboje k náboji jednoho elektronu zjistěte procentuální iontový charakter.
Řešení:
A Náboj na každém atomu je dán vztahem
Q = μ r = 9,001 D ( 3,3356 × 10 -30 C – m 1 D ) ( 1 236,1 pm ) ( 1 pm 10 -12 m ) = 1 . 2 7 2 × 1 0 -19 C
NaCl se tedy chová, jako by měl náboje 1,272 × 10-19 C na každém atomu vzdálené 236,1 pm.
B Procentuální iontový charakter je dán poměrem skutečného náboje k náboji jednoho elektronu (náboj očekávaný pro úplný přenos jednoho elektronu):
% iontového charakteru = ( 1.272 × 10 -19 C 1,6022 × 10 -19 C ) ( 100 ) = 79,39 % ≃ 79 %
Cvičení
Chlorid stříbrný (AgCl) má v plynné fázi dipólový moment 6,08 D a vzdálenost Ag-Cl 228,1 pm. Jaký je procentuální iontový charakter chloridu stříbrného?“
Odpověď: Chlorid stříbrný (Agl) má stejnou hmotnost jako chlorid stříbrný (Agl): Sloučeniny s polární kovalentní vazbou mají elektrony, které jsou mezi vázané atomy rozděleny nerovnoměrně, 55,5 %
Souhrn
Sloučeniny s polární kovalentní vazbou mají elektrony rozděleny nerovnoměrně. Polarita takové vazby je do značné míry určena relativní elektronegativitou vázaných atomů. Asymetrické rozložení nábojů v polární látce vytváří dipólový moment, který je součinem dílčích nábojů na vázaných atomech a vzdálenosti mezi nimi.
Klíčový závěr
- Polarita vazby a její iontový charakter se zvětšují s rostoucím rozdílem elektronegativit.
Klíčová rovnice
Dipólový moment
Rovnice č. 8.16: µ = Qr
Koncepční úlohy
-
Proč iontové sloučeniny, jako je KI, vykazují v plynné fázi podstatně méně než 100% iontový charakter
-
Ze sloučenin LiI a LiF byste očekávali, že se bude chovat spíše jako klasická iontová sloučenina? Která by měla větší dipólový moment v plynné fázi? Vysvětlete své odpovědi.
Numerické úlohy
-
Předpovězte, zda je každá sloučenina čistě kovalentní, čistě iontová nebo polárně kovalentní.
- RbCl
- S8
- TiCl2
- SbCl3
- LiI
- Br2
-
Na základě relativních elektronegativit, klasifikujte vazbu v každé sloučenině jako iontovou, kovalentní nebo polární kovalentní. U každé polární kovalentní vazby uveďte směr vazebného dipólu.
- NO
- HF
- MgO
- AlCl3
- SiO2
- vazba C=O v acetonu
- O3
-
Na základě relativních elektronegativit, klasifikujte vazbu v každé sloučenině jako iontovou, kovalentní nebo polární kovalentní. U každé polární kovalentní vazby uveďte směr vazebného dipólu.
- NaBr
- OF2
- BCl3
- vazba S-S v CH3CH2SSCH2CH3
- vazba C-Cl v CH2Cl2
- vazba O-H v CH3OH
- PtCl42-
.
-
Klasifikujte každý druh jako druh s iontovým charakterem 0-40 %, 40%-60% iontový charakter nebo 60%-100% iontový charakter na základě očekávaného typu vazby. Své úvahy zdůvodněte.
- CaO
- S8
- AlBr3
- ICl
- Na2S
- SiO2
- LiBr
-
Pokud je vazebná vzdálenost v HCl (dipólový moment = 1.109 D) byla dvojnásobná než skutečná hodnota 127,46 pm, jaký by byl vliv na náboj lokalizovaný na každém atomu? Jaké by bylo procento záporného náboje na Cl? Jak by při skutečné vazebné vzdálenosti ovlivnilo zdvojnásobení náboje na každém atomu dipólový moment? Představovalo by to více iontový nebo kovalentní charakter?
-
Vypočítejte procentuální iontový charakter HF (dipólový moment = 1.826 D), je-li vzdálenost vazby H-F 92 pm.
-
Vypočítejte procentuální iontový charakter CO (dipólový moment = 0,110 D), je-li vzdálenost C-O 113 pm.
-
Vypočítejte procentuální iontový charakter PbS a PbO v plynné fázi vzhledem k následujícím údajům: pro PbS je r = 228,69 pm a µ = 3. Vypočítejte procentuální iontový charakter PbS.59 D; pro PbO je r = 192,18 pm a µ = 4,64 D. Zařadili byste tyto sloučeniny mezi sloučeniny s kovalentní nebo polární kovalentní vazbou v pevném stavu?
.