N2O (ossido nitroso) è un ossido di azoto ed è chiamato gas esilarante. In questo tutorial, impareremo i seguenti aspetti del protossido di azoto.
- Come disegnare la struttura di lewis per N2O
- Disegnare le strutture di risonanza seguendo la struttura di lewis
- Numeri di ossidazione degli atomi di azoto e ossigeno.
Se conosci già la struttura di lewis di N2O, puoi saltare la prima sezione di questo tutorial e passare direttamente alla parte sulla struttura di lewis.
- Struttura di lewis di N2O
- Numero di elettroni del guscio di valenza
- Atomo centrale di N2O
- Cariche sugli atomi
- Struttura 1
- Struttura 2
- Struttura 3
- Forma della molecola N2O intorno all’atomo centrale
- Strutture di risonanza di N2O
- Stati di ossidazione, numeri di N2O
- Stato di ossidazione di N2O
- Numero di ossidazione dall’equazione
Struttura di lewis di N2O
Ci sono diversi passi da seguire per disegnare la struttura di lewis di N2O. tutti sono spiegati in dettaglio in questo tutorial e un principiante può imparare le basi del disegno della struttura di lewis.
Numero di elettroni del guscio di valenza
Prima di tutto, dovremmo sapere quanti elettroni dei gusci di valenza degli atomi di ossigeno e azoto saranno forniti per formare la molecola.
Numero di elettroni nel guscio di valenza dell’atomo di azoto = 5
Numero di atomi di azoto nella molecola N2O = 2
Numero di elettroni dati dagli atomi di azoto = 5*2 = 10
Numero di elettroni nel guscio di valenza dell’atomo di ossigeno = 6
Totale elettroni dati da tutti atomi = 10 + 6 = 16
Numero di elettroni totali che respingono le coppie (somma di σ + π + coppie solitarie nei gusci di valenza) = 16/2 = 8
Atomo centrale di N2O
Di solito l’atomo di azoto ha la maggiore possibilità di essere l’atomo centrale dell’atomo di ossigeno perché l’azoto può mostrare una valenza più alta dell’ossigeno.
Quindi uno degli atomi di azoto si trova come atomo centrale e gli altri atomi si trovano intorno ad esso. Ora possiamo immaginare uno schizzo per N2O ed è rappresentato qui sotto.
Cariche sugli atomi
Quando si disegna una molecola, dobbiamo fare attenzione a minimizzare sempre le cariche sugli atomi perché quando le cariche degli atomi sono basse, la stabilità di quella molecola è grande.
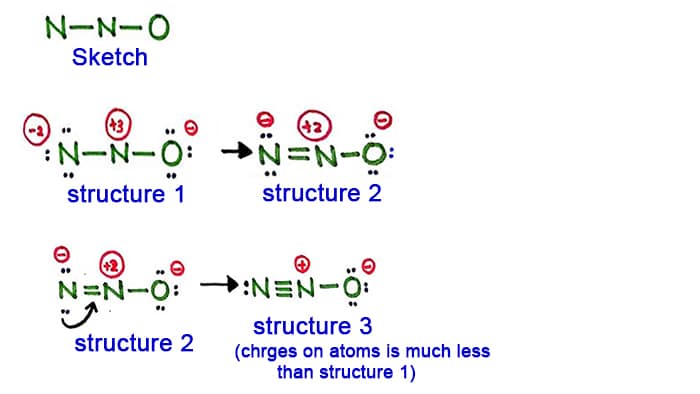
Struttura 1
Guarda la struttura 1, ci sono cariche positive e cariche su ogni atomo nella molecola N2O. Quindi questa struttura non sembra una struttura stabile. Quindi dovremmo provare a disegnare un’altra struttura cambiando la struttura 1.
Fai un nuovo legame convertendo una coppia solitaria nell’atomo di azoto nel lato (non nell’atomo di azoto centrale).
Struttura 2
Una coppia lunga nell’atomo di azoto (lato sinistro) è ora causata per formare un legame tra atomi di azoto. Così ora c’è un doppio legame tra gli atomi di azoto. Con questo, la densità delle cariche sugli atomi è diminuita.
Ma, potete vedere, ci sono ancora cariche sugli atomi. Quindi proviamo un’altra struttura per N2O per abbassare le cariche, se possibile.
Struttura 3
Un’altra coppia lunga nell’atomo di azoto (lato sinistro) è ora portata a formare un legame tra gli atomi di azoto. Così ora c’è un triplo legame tra gli atomi di azoto.
In questa struttura, le cariche sugli atomi sono diminuite ulteriormente. Ora l’atomo di azoto centrale ha solo +1 carica e l’atomo di ossigeno ha una carica -1.
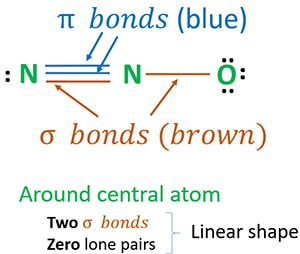
La struttura 3 è la migliore (più stabile) struttura che possiamo disegnare per N2O. Il suo atomo centrale contiene, intorno ad esso,
- due legami sigma (σ)
- zero coppie solitarie
Forma della molecola N2O intorno all’atomo centrale
La molecola N2O contiene due atomi di azoto e uno di ossigeno. Prima dovremmo cercare di disegnare la struttura di lewis più stabile di N2O per decidere la forma della molecola di N2O.
Il numero di coppie solitarie e il numero di legami σ intorno all’atomo centrale sono importanti per trovare la forma di una molecola.
A causa di due legami sigma e zero coppie solitarie intorno all’atomo centrale (azoto), la forma della molecola di N2O è lineare.
Possiamo disegnare strutture di risonanza di N2O per identificare la struttura più stabile di N2O. Il numero di ossidazione dell’azoto in N2O è deciso dalle strutture più stabili. Infine costruiamo la forma della molecola di N2O.
Strutture di risonanza di N2O
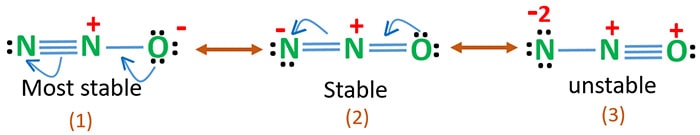
L’elettronegatività dell’ossigeno è più alta dell’azoto. Questo significa che una carica negativa sull’atomo di ossigeno è più stabile di una carica negativa sull’atomo di azoto. Altrimenti possiamo dire che l’ossigeno ama gli elettroni più dell’azoto.
La struttura 3 è la risonanza più instabile di N2O perché c’è una carica positiva sull’atomo di ossigeno.
La struttura 2 ha una certa stabilità.
La struttura 1 è la risonanza più stabile perché l’ossigeno ha una carica negativa.
Stati di ossidazione, numeri di N2O
Possiamo calcolare gli stati di ossidazione di N2O per la struttura di risonanza più stabile.
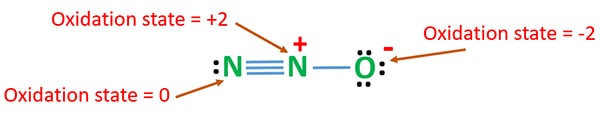
Stato di ossidazione di N2O
Il numero di ossidazione dell’azoto in N2O è +1. Ma nella situazione reale, un atomo di azoto è allo stato di ossidazione +2 e l’altro atomo di azoto è allo stato di ossidazione 0. Il numero di ossidazione dell’ossigeno è -2.
Numero di ossidazione dall’equazione
Sappiamo che nella maggior parte delle occasioni, l’ossidazione dell’ossigeno è -2. Ci sono due atomi di azoto in N2O. Prendiamo il numero di ossidazione dell’azoto è x. La carica complessiva della molecola N2O è 0.
Alcuni numeri di ossidazione di ogni elemento nella molecola dovrebbero essere uguali a zero.