N2O (Distickstoffoxid) ist ein Oxid des Stickstoffs und wird auch als Lachgas bezeichnet. In diesem Tutorium werden wir folgendes über Distickstoffoxid lernen.
- Wie man die Lewis-Struktur für N2O zeichnet
- Zeichnen von Resonanzstrukturen nach der Lewis-Struktur
- Oxidationszahlen von Stickstoff- und Sauerstoffatomen.
Wenn du die Lewis-Struktur von N2O bereits kennst, kannst du den ersten Teil dieses Tutorials überspringen und direkt zur Lewis-Struktur übergehen.
Lewis-Struktur von N2O
Es gibt mehrere Schritte, die beim Zeichnen der Lewis-Struktur von N2O zu befolgen sind. Alle werden in diesem Tutorium ausführlich erklärt und ein Anfänger kann die Grundlagen des Zeichnens der Lewis-Struktur lernen.
Anzahl der Valenzelektronen
Zunächst sollten wir wissen, wie viele Elektronen der Valenzschalen von Sauerstoff- und Stickstoffatomen zur Bildung des Moleküls bereitgestellt werden.
Anzahl der Elektronen in der Valenzschale des Stickstoffatoms = 5
Anzahl der Stickstoffatome im N2O-Molekül = 2
Anzahl der von den Stickstoffatomen abgegebenen Elektronen = 5*2 = 10
Anzahl der Elektronen in der Valenzschale des Sauerstoffatoms = 6
Gesamte Elektronen, die von allen Atome = 10 + 6 = 16
Anzahl der gesamten abstoßenden Elektronenpaare (Summe der σ + π + einsamen Paare in den Valenzschalen) = 16/2 = 8
Zentralatom von N2O
Normalerweise hat das Stickstoffatom die größte Möglichkeit, das Zentralatom zu sein als das Sauerstoffatom, da Stickstoff eine höhere Valenz als Sauerstoff aufweisen kann.
Ein Stickstoffatom befindet sich also als Zentralatom und die anderen Atome befinden sich um es herum. Jetzt können wir uns eine Skizze für N2O vorstellen, die unten abgebildet ist.
Ladungen an Atomen
Wenn ein Molekül gezeichnet wird, sollten wir immer darauf achten, die Ladungen an den Atomen zu minimieren, denn wenn die Ladungen der Atome niedrig sind, ist die Stabilität des Moleküls groß.
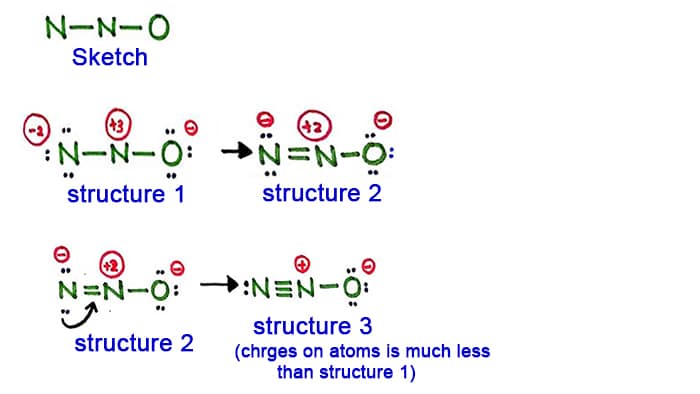
Struktur 1
Bei der Struktur 1 sind alle Atome des N2O-Moleküls positiv und geladen. Diese Struktur scheint also keine stabile Struktur zu sein. Deshalb sollten wir versuchen, eine andere Struktur zu zeichnen, indem wir die Struktur 1 ändern.
Erstelle eine neue Bindung, indem du ein einsames Paar im Stickstoffatom an der Seite (nicht im mittleren Stickstoffatom) umwandelst.
Struktur 2
Ein langes Paar im Stickstoffatom (linke Seite) wird nun veranlasst, eine Bindung zwischen Stickstoffatomen zu bilden. Es besteht nun also eine Doppelbindung zwischen den Stickstoffatomen. Damit verringert sich die Ladungsdichte an den Atomen.
Aber, wie man sieht, gibt es immer noch Ladungen an den Atomen. Versuchen wir also eine andere Struktur für N2O, um die Ladungen zu verringern, wenn es möglich ist.
Struktur 3
Ein weiteres langes Paar im Stickstoffatom (linke Seite) wird nun veranlasst, eine Bindung zwischen Stickstoffatomen zu bilden. Es besteht nun also eine Dreifachbindung zwischen den Stickstoffatomen.
In dieser Struktur werden die Ladungen der Atome weiter verringert. Jetzt hat das zentrale Stickstoffatom nur noch eine Ladung von +1 und das Sauerstoffatom hat eine Ladung von -1.
Struktur 3 ist die beste (stabilste) Struktur, die wir für N2O zeichnen können. Das Zentralatom enthält um sich herum
- zwei Sigma (σ)-Bindungen
- null einsame Paare
Form des N2O-Moleküls um das Zentralatom
Das N2O-Molekül enthält zwei Stickstoffatome und ein Sauerstoffatom. Um die Form des N2O-Moleküls zu bestimmen, sollten wir zunächst versuchen, die stabilste Lewis-Struktur von N2O zu zeichnen.
Die Anzahl der einsamen Paare und die Anzahl der σ-Bindungen um das Zentralatom sind wichtig, um die Form eines Moleküls zu bestimmen.
Aufgrund von zwei Sigma-Bindungen und null einsamen Paaren um das Zentralatom (Stickstoff) ist die Form des N2O-Moleküls linear.
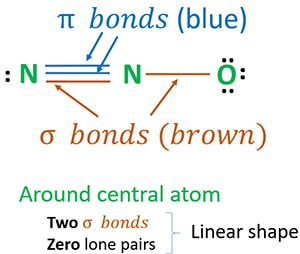
Wir können N2O-Resonanzstrukturen zeichnen, um die stabilste Struktur von N2O zu identifizieren. Die Oxidationszahlen des Stickstoffs in N2O werden anhand der stabilsten Strukturen bestimmt. Schließlich erstellen wir die Form des N2O-Moleküls.
N2O-Resonanzstrukturen
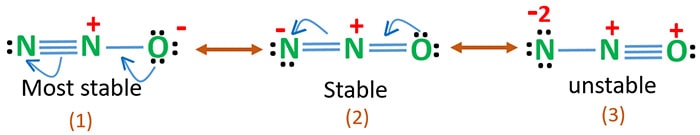
Die Elektronegativität von Sauerstoff ist höher als die von Stickstoff. Das bedeutet, dass eine negative Ladung am Sauerstoffatom stabiler ist als eine negative Ladung am Stickstoffatom. Ansonsten kann man sagen, dass Sauerstoff Elektronen mehr mag als Stickstoff.
Struktur 3 ist die instabilste Resonanz von N2O, weil das Sauerstoffatom positiv geladen ist.
Struktur 2 ist etwas stabiler.
Struktur 1 ist die stabilste Resonanz, weil der Sauerstoff die negative Ladung hält.
Oxidationszustände, Zahlen von N2O
Wir können die Oxidationszustände von N2O für die stabilste Resonanzstruktur berechnen.
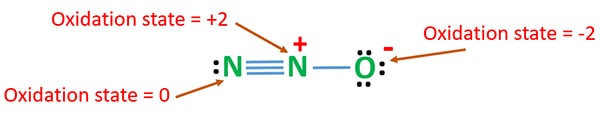
Oxidationszustand von N2O
Die Oxidationszahl von Stickstoff in N2O ist +1. In der Realität hat jedoch ein Stickstoffatom die Oxidationsstufe +2 und das andere Stickstoffatom die Oxidationsstufe 0. Die Oxidationszahl des Sauerstoffs ist -2.
Oxidationszahl aus Gleichung
Wir wissen, dass in den meisten Fällen die Oxidationszahl von Sauerstoff -2 ist. Es gibt zwei Stickstoffatome in N2O. Die Oxidationszahl des Stickstoffs ist x. Die Gesamtladung des N2O-Moleküls ist 0.
Einige der Oxidationszahlen der einzelnen Elemente im Molekül sollten gleich Null sein.