N2O (lattergas) er en nitrogenoxid og kaldes lattergas. I denne tutorial vil vi lære følgende om lattergas.
- Sådan tegner man Lewisstrukturen for N2O
- Tegning af resonansstrukturer efter Lewisstrukturen
- Oxidationstal for nitrogen- og oxygenatomer.
Hvis du allerede kender lewis-strukturen for N2O, kan du springe første afsnit af denne vejledning over og gå direkte til lewis-strukturdelen.
Lewis-struktur af N2O
Der er flere trin at følge for at tegne lewis-strukturen af N2O. Alle trin er forklaret i detaljer i denne vejledning, og en nybegynder kan lære det grundlæggende i at tegne lewis-strukturen.
Antal af elektroner i valensskallen
Først skal vi vide, hvor mange elektroner i ilt- og kvælstofatomernes valensskaller der skal tilføres for at danne molekylet.
Antal elektroner i nitrogenatomets valensskal = 5
Antal nitrogenatomer i N2O-molekylet = 2
Antal elektroner givet af nitrogenatomer = 5*2 = 10
Antal elektroner i oxygenatomets valensskal = 6
Total elektroner givet af de alle atomer = 10 + 6 = 16
Antal samlede elektroner, der frastøder parrene (summen af σ + π + lone par i valensskaller) = 16/2 = 8
Centeratom i N2O
Sædvanligvis har nitrogenatom den største mulighed for at være centeratom end oxygenatom, fordi nitrogen kan vise høj valens end oxygen.
Så et af kvælstofatomerne er placeret som centeratom og de andre atomer er placeret omkring det. Nu kan vi forestille os en skitse for N2O, og den er figureret nedenfor.
Ladninger på atomer
Når et molekyle tegnes, skal vi altid være opmærksomme på at minimere ladningerne på atomerne, for når atomernes ladninger er lave, er stabiliteten af det pågældende molekyle stor.
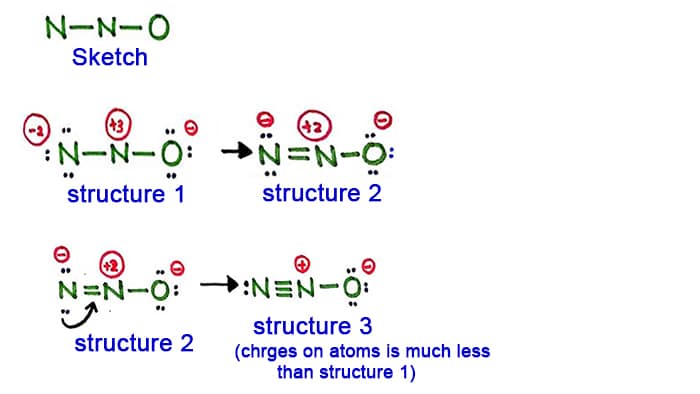
Struktur 1
Se struktur 1, der er positive og ladninger på alle atomer i N2O-molekylet. Så denne struktur ser ikke ud til at være en stabil struktur. Derfor skal vi forsøge at tegne en anden struktur ved at ændre struktur 1.
Skab en ny binding ved at omdanne et lonepar i nitrogenatomet i siden (ikke i det centrale nitrogenatom).
Struktur 2
Et lonepar i nitrogenatomet (venstre side) er nu forårsaget til at danne en binding mellem nitrogenatomer. Så nu er der altså en dobbeltbinding mellem nitrogenatomer. Dermed er tætheden af ladninger på atomerne mindsket.
Men, som du kan se, er der stadig ladninger på atomerne. Så lad os prøve en anden struktur for N2O for at sænke ladningerne, hvis det er muligt.
Struktur 3
Et andet langt par i nitrogenatomet (venstre side) er nu forårsaget til at danne en binding mellem nitrogenatomer. Så nu er der altså en tripelbindingmellem nitrogenatomerne.
I denne struktur er ladningerne på atomerne desuden reduceret yderligere. Nu har det midterste nitrogenatom kun +1 ladning og oxygenatomet har en -1 ladning.
Struktur 3 er den bedste (mest stabile) struktur, vi kan tegne for N2O. Dens centeratom indeholder, omkring det,
- to sigma (σ)-bindinger
- nul lone par
Form af N2O-molekylet omkring centeratom
N2O-molekylet indeholder to nitrogenatomer og et oxygenatomer. Først skal vi forsøge at tegne den mest stabile lewis-struktur af N2O for at bestemme N2O-molekylets form.
Antal af ensomme par og antal σ-bindinger omkring centeratomet er vigtige for at finde formen på et molekyle.
På grund af to sigma-bindinger og nul lone par omkring centeratomet (nitrogen) er N2O-molekylets form lineær.
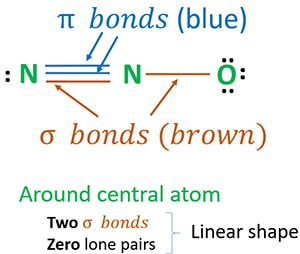
Vi kan tegne N2O-resonansstrukturer for at identificere den mest stabile struktur af N2O. Oxidationstal for nitrogen i N2O afgøres ud fra de mest stabile strukturer. Til sidst opbygger vi N2O-molekylets form.
N2O-resonansstrukturer
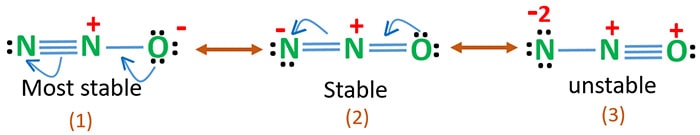
Syre har en højere elektronegativitet end kvælstof. Det betyder, at en negativ ladning på et iltatom er mere stabil end en negativ ladning på et nitrogenatom. Ellers kan vi sige, at ilt kan lide elektroner mere end nitrogen.
Struktur 3 er den mest ustabile resonans af N2O, fordi der er en positiv ladning på oxygenatomet.
Struktur 2 har en vis stabilitet.
Struktur 1 er den mest stabile resonans, fordi ilten har den negative ladning.
Oxidationstilstande, tal for N2O
Vi kan beregne oxidationstilstande for N2O for den mest stabile resonansstruktur.
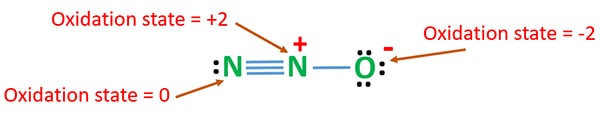
Oxidationstilstand for N2O
Oxidationstallet for nitrogen i N2O er +1. Men i den virkelige situation er det ene nitrogenatom på +2 oxidationstrin og det andet nitrogenatom på 0 oxidationstrin. Oxidationstallet for oxygen er -2.
Oxidationstal fra ligning
Vi ved i de fleste tilfælde, at iltets oxidationsumre er -2. Der er to nitrogenatomer i N2O. Tag nitrogenets oxidationstal som x. Den samlede ladning af N2O-molekylet er 0.
En del af oxidationstallene for hvert element i molekylet skal være lig med nul.