Le N2O (oxyde nitreux) est un oxyde d’azote et est appelé gaz hilarant. Dans ce tutoriel, nous allons apprendre les points suivants du gaz d’oxyde nitreux.
- Comment dessiner la structure de lewis pour N2O
- Dessiner les structures de résonance suivant la structure de lewis
- Nombres d’oxydation des atomes d’azote et d’oxygène.
Si vous connaissez déjà la structure de lewis de N2O, vous pouvez sauter la première section de ce tutoriel et passer directement à la partie sur la structure de lewis.
- Structure de lewis de N2O
- Nombre d’électrons de la coquille de valence
- Atome central de N2O
- Charges sur les atomes
- Structure 1
- Structure 2
- Structure 3
- Forme de la molécule de N2O autour de l’atome central
- Structures de résonance du N2O
- Etats d’oxydation, nombres de N2O
- Etat d’oxydation de N2O
- Nombre d’oxydation de l’équation
Structure de lewis de N2O
Il y a plusieurs étapes à suivre pour dessiner la structure de lewis de N2O. aToutes sont expliquées en détail dans ce tutoriel et un débutant peut apprendre les bases du dessin de la structure de lewis.
Nombre d’électrons de la coquille de valence
D’abord, nous devons savoir, combien d’électrons des coquilles de valence des atomes d’oxygène et d’azote seront fournis pour former la molécule.
Nombre d’électrons de la couche de valence de l’atome d’azote = 5
Nombre d’atomes d’azote dans la molécule de N2O = 2
Nombre d’électrons donnés par les atomes d’azote = 5*2 = 10
Nombre d’électrons de la couche de valence de l’atome d’oxygène = 6
Total des électrons donnés par l’ensemble des atomes = 10 + 6 = 16
Nombre total de paires répulsives d’électrons (somme de σ + π + paires solitaires dans les coquilles de valence) = 16/2 = 8
Atome central de N2O
Usuellement, l’atome d’azote a la plus grande possibilité d’être l’atome central que l’atome d’oxygène parce que l’azote peut montrer une valence élevée que l’oxygène.
Donc un des atomes d’azote est situé comme atome central et les autres atomes sont situés autour de lui. Maintenant nous pouvons imaginer un croquis pour N2O et il est figuré ci-dessous.
Charges sur les atomes
Lorsqu’une molécule est dessinée, nous devrions faire attention à toujours minimiser les charges sur les atomes car lorsque les charges des atomes sont faibles, la stabilité de cette molécule est grande.
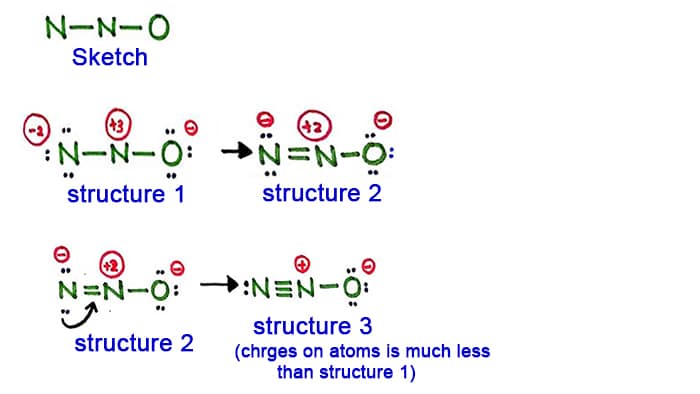
Structure 1
Regardez la structure 1, il y a des charges positives et sur chaque atome de la molécule de N2O. Donc cette structure ne semble pas être une structure stable. Par conséquent, nous devrions essayer de dessiner une autre structure en changeant la structure 1.
Faire une nouvelle liaison en convertissant une paire solitaire dans l’atome d’azote dans le côté (pas dans l’atome d’azote central).
Structure 2
Une paire longue dans l’atome d’azote (côté gauche) est maintenant provoquée pour former une liaison entre les atomes d’azote. Il y a donc maintenant une double liaison entre les atomes d’azote. Avec cela, la densité des charges sur les atomes est diminuée.
Mais, vous pouvez voir, il y a encore des charges sur les atomes. Alors essayons une autre structure pour N2O pour diminuer les charges si c’est possible.
Structure 3
Une autre paire longue dans l’atome d’azote (côté gauche) est maintenant amenée à former une liaison entre les atomes d’azote. Il y a donc maintenant une triple liaison entre les atomes d’azote.
Dans cette structure, les charges des atomes sont encore diminuées. Maintenant, l’atome d’azote central a seulement une charge de +1 et l’atome d’oxygène a une charge de -1.
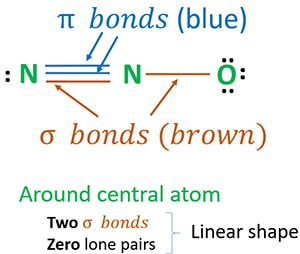
La structure 3 est la meilleure (la plus stable) que nous pouvons dessiner pour N2O. Son atome central contient, autour de lui,
- deux liaisons sigma (σ)
- zéro paires solitaires
Forme de la molécule de N2O autour de l’atome central
La molécule de N2O contient deux atomes d’azote et un atome d’oxygène. Nous devrions d’abord essayer de dessiner la structure de Lewis la plus stable de N2O pour décider de la forme de la molécule de N2O.
Le nombre de paires solitaires et le nombre de liaisons σ autour de l’atome central sont importants pour trouver la forme d’une molécule.
En raison de deux liaisons sigma et de zéro paire solitaire autour de l’atome central (azote), la forme de la molécule de N2O est linéaire.
Nous pouvons dessiner les structures de résonance de N2O pour identifier la structure la plus stable de N2O. Les nombres d’oxydation de l’azote dans N2O sont décidés à partir des structures les plus stables. Enfin, nous construisons la forme de la molécule de N2O.
Structures de résonance du N2O
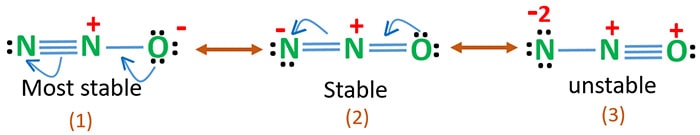
L’électronégativité de l’oxygène est plus élevée que celle de l’azote. Cela signifie qu’une charge négative sur un atome d’oxygène est plus stable qu’une charge négative sur un atome d’azote. Sinon, on peut dire que l’oxygène aime plus les électrons que l’azote.
La structure 3 est la résonance la plus instable de N2O car il y a une charge positive sur l’atome d’oxygène.
La structure 2 a une certaine stabilité.
La structure 1 est la résonance la plus stable car l’oxygène détient la charge négative.
Etats d’oxydation, nombres de N2O
Nous pouvons calculer les états d’oxydation de N2O pour la structure de résonance la plus stable.
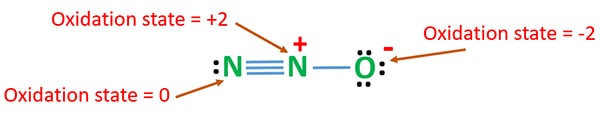
Etat d’oxydation de N2O
Le nombre d’oxydation de l’azote dans N2O est +1. Mais en situation réelle, un atome d’azote est à l’état d’oxydation +2 et l’autre atome d’azote est à l’état d’oxydation 0. Le nombre d’oxydation de l’oxygène est de -2.
Nombre d’oxydation de l’équation
Nous savons que dans la plupart des occasions, le nombre d’oxydation de l’oxygène est -2. Il y a deux atomes d’azote dans N2O. Prenez le nombre d’oxydation de l’azote est x. La charge globale de la molécule de N2O est 0.
Certains des nombres d’oxydation de chaque élément dans la molécule doivent être égaux au zéro.