N2O (dityppioksidi) on typen oksidi ja sitä kutsutaan naurukaasuksi. Tässä opetusohjelmassa opettelemme seuraavat typpioksidikaasua koskevat asiat.
- Miten piirretään N2O:n Lewis-rakenne
- Resonanssirakenteiden piirtäminen Lewis-rakenteen mukaan
- Typpi- ja happiatomien hapetusluvut.
Jos tiedät jo N2O:n Lewis-rakenteen, voit ohittaa tämän ohjeen ensimmäisen osan ja siirtyä suoraan Lewis-rakenne-osioon.
N2O:n Lewis-rakenne
N2O:n Lewis-rakenteen piirtämisessä on useita vaiheita. akaikki ne on selitetty yksityiskohtaisesti tässä opetusohjelmassa, ja aloitteleva opiskelija voi oppia Lewis-rakenteen piirtämisen perusteet.
Valenssikuoren elektronien määrä
Ensin on tiedettävä, kuinka monta happi- ja typpiatomien valenssikuoren elektronia molekyylin muodostamiseen toimitetaan.
Typpiatomin valenssikuoren elektronien määrä = 5
Typpiatomien määrä N2O-molekyylissä = 2
Typpiatomien antamien elektronien määrä = 5*2 = 10
Happiatomin valenssikuoren elektronien määrä = 6
Kokonaisuudessaan kaikkien antamien elektronien määrä. atomit = 10 + 6 = 16
Kokonaiselektronien hylkivien parien määrä (valenssikuorissa olevien σ + π + yksinäisten parien summa) = 16/2 = 8
N2O:n keskus-atomi
Typpiatomilla on yleensä suurin mahdollisuus olla keskus-atomi kuin happiatomilla, koska typpi voi osoittaa korkeampaa valenssia kuin happi.
Yksi typpiatomi sijaitsee siis keskus-atomina ja muut atomit sen ympärillä. Nyt voimme kuvitella piirroksen N2O:lle ja se on esitetty alla olevassa kuvassa.
Atomien varaukset
Kun molekyyliä piirretään, on aina huolehdittava siitä, että atomien varaukset ovat mahdollisimman pienet, koska kun atomien varaukset ovat pienet, kyseisen molekyylin stabiilius on suuri.
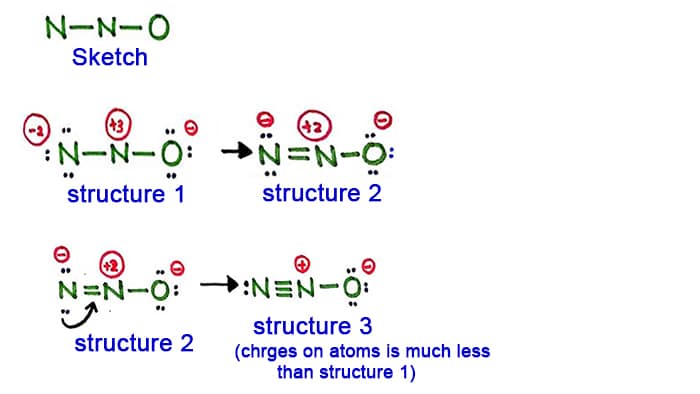
Rakenne 1
Katsokaa rakennetta 1, N2O-molekyylin jokaisessa atomissa on positiivisia ja varauksia. Joten tämä rakenne ei vaikuta vakaalta rakenteelta. Siksi meidän pitäisi yrittää piirtää toinen rakenne muuttamalla rakennetta 1.
Tehdään uusi sidos muuntamalla typpiatomin sivussa (ei keskellä olevassa typpiatomissa) oleva yksinäinen pari.
Rakenne 2
Vasemmalla olevassa typpiatomissa (vasemmalla) oleva yksinäinen pari saa nyt aikaan sidoksen typpiatomien välille. Nyt typpiatomien välillä on siis kaksoissidos. Tämän myötä atomien varaustiheys vähenee.
Mutta, kuten näette, atomeissa on edelleen varauksia. Kokeillaan siis toista rakennetta N2O:lle, jotta varauksia saadaan pienennettyä, jos se on mahdollista.
Rakenne 3
Muutama pitkä pari typpiatomissa (vasemmalla puolella) saa nyt aikaan sidoksen typpiatomien välille. Nyt on siis kolmoissidos typpiatomien välillä.
Tässä rakenteessa atomien varaukset vähenevät edelleen. Nyt keskimmäisellä typpiatomilla on vain +1 varaus ja happiatomilla -1 varaus.
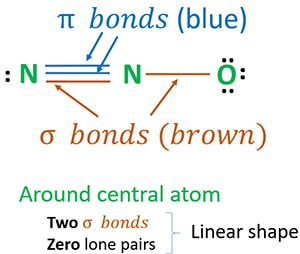
Rakenne 3 on paras (stabiilein) rakenne, jonka voimme piirtää N2O:lle. Sen keskusatomin ympärillä on,
- kaksi sigma(σ)sidosta
- nolla yksinäistä paria
N2O-molekyylin muoto keskusatomin ympärillä
N2O-molekyyli sisältää kaksi typpiatomia ja yhden happiatomin. Ensin pitäisi yrittää piirtää N2O:n stabiilein Lewis-rakenne, jotta voidaan päättää N2O-molekyylin muoto.
Yksinäisten parien määrä ja σ-sidosten määrä keskiatomin ympärillä ovat tärkeitä molekyylin muodon löytämiseksi.
Johtuen kahdesta sigmasidoksesta ja nollasta yksinäisestä parista keskusatomin (typpi) ympärillä, N2O-molekyylin muoto on lineaarinen.
Voidaan piirtää N2O:n resonanssirakenteita, jotta voidaan tunnistaa N2O:n stabiilin rakenne. N2O:n typen hapetusluvut ratkaistaan stabiileimmista rakenteista. Lopuksi rakennamme N2O-molekyylin muodon.
N2O-resonanssirakenteet
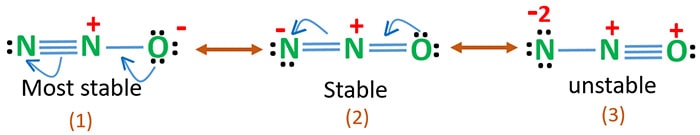
Hapen elektronegatiivisuus on suurempi kuin typen. Tämä tarkoittaa, että happiatomin negatiivinen varaus on vakaampi kuin typpiatomin negatiivinen varaus. Muuten voidaan sanoa, että happi pitää elektroneista enemmän kuin typpi.
Rakenne 3 on N2O:n epästabiili resonanssi, koska happiatomissa on positiivinen varaus.
Rakenne 2 on jonkin verran stabiili.
Rakenne 1 on stabiilein resonanssi, koska hapella on negatiivinen varaus.
N2O:n hapetusasteet, -luvut
Voidaan laskea N2O:n hapetusasteet stabiilimmalle resonanssirakenteelle.
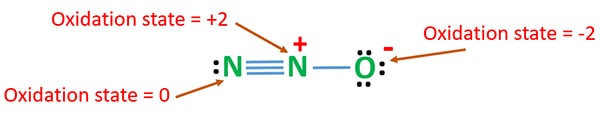
N2O:n hapetusaste
N2O:n typen hapetusluku on +1. Mutta todellisessa tilanteessa yksi typpiatomi on hapetusasteessa +2 ja toinen typpiatomi on hapetusasteessa 0. Hapen hapetusluku on -2.
Hapetusluku yhtälöstä
Tiedämme, että useimmissa tilanteissa hapen hapetusluku on -2. N2O:ssa on kaksi typpiatomia. Otetaan typen hapetusluku x. N2O-molekyylin kokonaisvaraus on 0.
Joidenkin molekyylin kunkin alkuaineen hapetuslukujen pitäisi olla yhtä suuria kuin nolla.