El N2O (óxido nitroso) es un óxido de nitrógeno y se denomina gas de la risa. En este tutorial, vamos a aprender lo siguiente del gas óxido nitroso.
- Cómo dibujar la estructura de lewis para el N2O
- Dibujar estructuras de resonancia siguiendo la estructura de lewis
- Números de oxidación de los átomos de nitrógeno y oxígeno.
Si ya conoces la estructura de lewis del N2O, puedes saltarte la primera sección de este tutorial y puedes ir a la parte de la estructura de lewis directamente.
- Estructura de lewis del N2O
- Número de electrones de la capa de valencia
- Átomo central de N2O
- Cargas en los átomos
- Estructura 1
- Estructura 2
- Estructura 3
- Forma de la molécula de N2O alrededor del átomo central
- Estructuras de resonancia del N2O
- Estados de oxidación, números de N2O
- Estado de oxidación de N2O
- Número de oxidación de la ecuación
Estructura de lewis del N2O
Hay varios pasos a seguir para dibujar la estructura de lewis del N2O. aAlgunos de ellos se explican en detalle en este tutorial y un principiante puede aprender lo básico para dibujar la estructura de lewis.
Número de electrones de la capa de valencia
Primero, debemos saber, cuántos electrones de las capas de valencia de los átomos de oxígeno y nitrógeno serán suministrados para formar la molécula.
Número de electrones en la capa de valencia del átomo de nitrógeno = 5
Número de átomos de nitrógeno en la molécula de N2O = 2
Número de electrones aportados por los átomos de nitrógeno = 5*2 = 10
Número de electrones en la capa de valencia del átomo de oxígeno = 6
Total de electrones aportados por los todos átomos = 10 + 6 = 16
Número de pares totales de electrones repulsivos (suma de σ + π + pares solitarios en las cáscaras de valencia) = 16/2 = 8
Átomo central de N2O
Por lo general, el átomo de nitrógeno tiene la mayor posibilidad de ser el átomo central que el átomo de oxígeno porque el nitrógeno puede mostrar una valencia alta que el oxígeno.
Así que uno de los átomos de nitrógeno se sitúa como átomo central y los demás átomos se sitúan a su alrededor. Ahora podemos imaginar un boceto para N2O y se figura abajo.
Cargas en los átomos
Cuando se dibuja una molécula, debemos tener cuidado siempre de minimizar las cargas en los átomos porque cuando las cargas de los átomos son bajas, la estabilidad de esa molécula es grande.
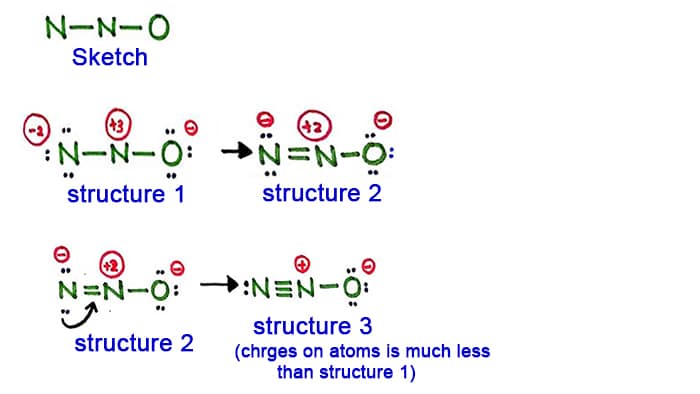
Estructura 1
Mira la estructura 1, hay cargas positivas en todos los átomos de la molécula de N2O. Así que esta estructura no parece una estructura estable. Por lo tanto, debemos tratar de dibujar otra estructura cambiando la estructura 1.
Hacer un nuevo enlace mediante la conversión de un par solitario en el átomo de nitrógeno en el lado (no en el átomo de nitrógeno central).
Estructura 2
Un par largo en el átomo de nitrógeno (lado izquierdo) es ahora causado para formar un enlace entre los átomos de nitrógeno. Así que ahora hay un doble enlace entre los átomos de nitrógeno. Con eso, la densidad de cargas en los átomos se disminuye.
Pero, usted puede ver, hay cargas todavía en los átomos. Así que vamos a intentar otra estructura para N2O para bajar las cargas si es posible.
Estructura 3
Otro par largo en el átomo de nitrógeno (lado izquierdo) es ahora causado para formar un enlace entre los átomos de nitrógeno. Así que ahora hay un triple enlace entre los átomos de nitrógeno.
En esta estructura, las cargas de los átomos se reducen aún más. Ahora el átomo central de nitrógeno sólo tiene carga +1 y el átomo de oxígeno tiene carga -1.
La estructura 3 es la mejor (más estable) estructura que podemos dibujar para el N2O. Su átomo central contiene, a su alrededor,
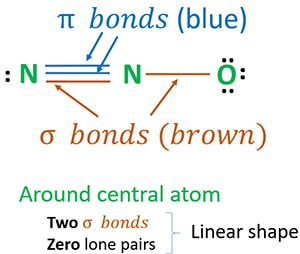
- dos enlaces sigma (σ)
- cero pares lone
Forma de la molécula de N2O alrededor del átomo central
La molécula de N2O contiene dos átomos de nitrógeno y uno de oxígeno. Primero debemos intentar dibujar la estructura de lewis más estable del N2O para decidir la forma de la molécula de N2O.
El número de pares solitarios y el número de enlaces σ alrededor del átomo central son importantes para encontrar la forma de una molécula.
Debido a dos enlaces sigma y cero pares solitarios alrededor del átomo central (nitrógeno), la forma de la molécula de N2O es lineal.
Podemos dibujar estructuras de resonancia de N2O para identificar la estructura más estable de N2O. Los números de oxidación del nitrógeno en el N2O se deciden a partir de las estructuras más estables. Finalmente construimos la forma de la molécula de N2O.
Estructuras de resonancia del N2O
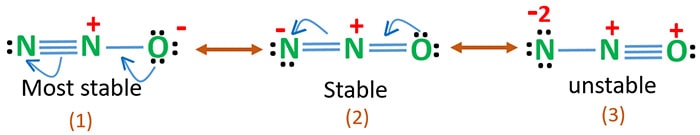
La electronegatividad del oxígeno es mayor que la del nitrógeno. Esto significa que una carga negativa en el átomo de oxígeno es más estable que una carga negativa en el átomo de nitrógeno. Si no, podemos decir que al oxígeno le gustan más los electrones que al nitrógeno.
La estructura 3 es la resonancia más inestable de N2O porque hay una carga positiva en el átomo de oxígeno.
La estructura 2 tiene cierta estabilidad.
La estructura 1 es la resonancia más estable porque el oxígeno tiene la carga negativa.
Estados de oxidación, números de N2O
Podemos calcular los estados de oxidación de N2O para la estructura de resonancia más estable.
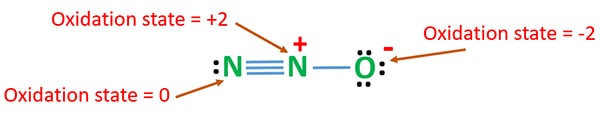
Estado de oxidación de N2O
El número de oxidación del nitrógeno en N2O es +1. Pero en la situación real, un átomo de nitrógeno está en estado de oxidación +2 y el otro átomo de nitrógeno está en estado de oxidación 0. El número de oxidación del oxígeno es -2.
Número de oxidación de la ecuación
Sabemos que en la mayoría de las ocasiones, el número de oxidación del oxígeno es -2. Hay dos átomos de nitrógeno en N2O. Tome el número de oxidación del nitrógeno es x. La carga total de la molécula de N2O es 0.
Algunos de los números de oxidación de cada elemento en la molécula debe ser igual al cero.