Læringsmål
I slutningen af dette afsnit vil du være i stand til at:
- Beskriv stof og grundstoffer
- Beskriv det indbyrdes forhold mellem protoner, neutroner og elektroner og de måder, hvorpå elektroner kan doneres eller deles mellem atomer
På det mest grundlæggende niveau består livet af stof. Materie optager rum og har masse. Alt stof er sammensat af grundstoffer, stoffer, der ikke kan nedbrydes eller omdannes kemisk til andre stoffer. Hvert grundstof består af atomer, der hver især har et konstant antal protoner og unikke egenskaber. Der er blevet defineret i alt 118 grundstoffer, men kun 92 forekommer naturligt, og mindre end 30 findes i levende celler. De resterende 26 grundstoffer er ustabile og eksisterer derfor ikke ret længe, eller de er teoretiske og er endnu ikke blevet opdaget.
Hvert grundstof betegnes med sit kemiske symbol (f.eks. H, N, O, C og Na) og har unikke egenskaber. Disse unikke egenskaber gør det muligt for grundstoffer at kombinere og binde sig til hinanden på bestemte måder.
Atomer
Et atom er den mindste bestanddel af et grundstof, der bevarer alle grundstoffets kemiske egenskaber. F.eks. har et hydrogenatom alle egenskaberne ved grundstoffet hydrogen, f.eks. at det eksisterer som en gas ved stuetemperatur, og det binder sig med oxygen for at skabe et vandmolekyle. Brintatomer kan ikke nedbrydes til noget mindre, mens de stadig bevarer brints egenskaber. Hvis et brintatom blev splittet op i subatomare partikler, ville det ikke længere have brintets egenskaber.
På det mest grundlæggende niveau er alle organismer lavet af en kombination af grundstoffer. De indeholder atomer, der kombineres sammen og danner molekyler. I flercellede organismer, som f.eks. dyr, kan molekyler interagere for at danne celler, der kombineres for at danne væv, som udgør organerne. Disse kombinationer fortsætter, indtil der dannes hele flercellede organismer.

Figur 1. Atomer består af protoner og neutroner, der er placeret i kernen, og af elektroner, der omgiver kernen.
Alle atomer indeholder protoner, elektroner og neutroner (figur 1). Den eneste undtagelse er brint (H), som består af én proton og én elektron. En proton er en positivt ladet partikel, der befinder sig i atomkernen (atomets kerne) i et atom og har en masse på 1 og en ladning på +1. En elektron er en negativt ladet partikel, der bevæger sig i rummet omkring atomkernen. Med andre ord befinder den sig uden for kernen. Den har en ubetydelig masse og har en ladning på -1.
Neutroner befinder sig ligesom protoner i et atoms kerne. De har en masse på 1 og ingen ladning. De positive (protoner) og negative (elektroner) ladninger balancerer hinanden i et neutralt atom, som har en nettoladning på nul.
Da protoner og neutroner hver især har en masse på 1, er et atoms masse lig med antallet af protoner og neutroner i det pågældende atom. Antallet af elektroner indgår ikke i den samlede masse, fordi deres masse er så lille.
Som tidligere nævnt har hvert grundstof sine egne unikke egenskaber. Hvert element indeholder et forskelligt antal protoner og neutroner, hvilket giver det sit eget atomnummer og massetal. Atomnummeret for et grundstof er lig med det antal protoner, som grundstoffet indeholder. Massetallet er antallet af protoner plus antallet af neutroner i det pågældende grundstof. Derfor er det muligt at bestemme antallet af neutroner ved at trække atomnummeret fra massetallet.
Disse tal giver oplysninger om grundstofferne og om, hvordan de vil reagere, når de kombineres. Forskellige grundstoffer har forskellige smelte- og kogepunkter og befinder sig i forskellige tilstande (flydende, fast stof eller gas) ved stuetemperatur. De kombineres også på forskellige måder. Nogle danner bestemte typer bindinger, mens andre ikke gør det. Hvordan de kombineres er baseret på antallet af tilstedeværende elektroner. På grund af disse egenskaber er grundstofferne inddelt i det periodiske system af grundstoffer, som er et skema over grundstofferne, der indeholder atomnummeret og den relative atommasse for hvert grundstof. Det periodiske system indeholder også vigtige oplysninger om grundstoffernes egenskaber (figur 2) – ofte angivet ved farvekodning. Ordningen i tabellen viser også, hvordan elektronerne i hvert grundstof er organiseret, og giver vigtige oplysninger om, hvordan atomerne vil reagere med hinanden for at danne molekyler.
Isotoper er forskellige former af det samme grundstof, der har det samme antal protoner, men et forskelligt antal neutroner. Nogle grundstoffer, som f.eks. kulstof, kalium og uran, har naturligt forekommende isotoper. Kulstof-12, den mest almindelige isotop af kulstof, indeholder seks protoner og seks neutroner. Derfor har den et massetal på 12 (seks protoner og seks neutroner) og et atomnummer på 6 (hvilket gør den til kulstof). Kulstof-14 indeholder seks protoner og otte neutroner. Derfor har det et massetal på 14 (seks protoner og otte neutroner) og et atomnummer på 6, hvilket betyder, at det stadig er grundstoffet kulstof. Disse to alternative former af kulstof er isotoper. Nogle isotoper er ustabile og vil miste protoner, andre subatomare partikler eller energi for at danne mere stabile grundstoffer. Disse kaldes radioaktive isotoper eller radioisotoper.
Art Connection

Figur 2. Det periodiske system er arrangeret i kolonner og rækker baseret på grundstoffernes egenskaber, og det giver vigtige oplysninger om grundstofferne, og hvordan de kan interagere med hinanden for at danne molekyler. De fleste periodiske tabeller indeholder en nøgle eller en legende til de oplysninger, de indeholder.
Hvor mange neutroner har henholdsvis (K) kalium-39 og kalium-40?
Evolution in Action
Kulstofdatering

Figur 3. Alderen af rester, der indeholder kulstof og er mindre end ca. 50.000 år gamle, som f.eks. denne dværgmammut, kan bestemmes ved hjælp af kulstofdatering. (credit: Bill Faulkner/NPS)
Kulstof-14 (14C) er en naturligt forekommende radioisotop, som dannes i atmosfæren af kosmisk stråling. Dette er en kontinuerlig proces, så der bliver altid dannet mere 14C. Efterhånden som en levende organisme udvikler sig, er det relative niveau af 14C i dens krop lig med koncentrationen af 14C i atmosfæren. Når en organisme dør, optager den ikke længere 14C, så forholdet vil falde. 14C henfalder til 14N ved en proces kaldet beta-henfald; det afgiver energi i denne langsomme proces.
Efter ca. 5.730 år vil kun halvdelen af startkoncentrationen af 14C være blevet omdannet til 14N. Den tid, det tager for halvdelen af den oprindelige koncentration af en isotop at henfalde til sin mere stabile form, kaldes dens halveringstid. Fordi 14C’s halveringstid er lang, bruges den til at aldersbestemme tidligere levende genstande, f.eks. fossiler. Ved at bruge forholdet mellem den 14C-koncentration, der findes i en genstand, og den mængde 14C, der er påvist i atmosfæren, kan man bestemme mængden af isotopen, der endnu ikke er henfaldet. På grundlag af denne mængde kan fossilets alder beregnes til ca. 50.000 år (figur 3). Isotoper med længere halveringstider, som f.eks. kalium-40, anvendes til at beregne alderen på ældre fossiler. Ved hjælp af kulstofdatering kan forskerne rekonstruere økologien og biogeografien for organismer, der har levet inden for de sidste 50.000 år.
Concept in Action
Denne simulation viser dig mere om atomer og isotoper, og hvordan du kan skelne en isotop fra en anden.
Kemiske bindinger
Hvordan grundstoffer interagerer med hinanden afhænger af, hvordan deres elektroner er arrangeret, og hvor mange åbninger for elektroner der er i det yderste område, hvor der er elektroner i et atom. Elektroner findes på energiniveauer, der danner skaller omkring atomkernen. Den nærmeste skal kan indeholde op til to elektroner. Den nærmeste skal ved kernen fyldes altid først, før en anden skal kan fyldes. Brint har én elektron; derfor har det kun én plads i den laveste skal. Helium har to elektroner; derfor kan det fylde den nederste skal helt op med sine to elektroner. Hvis du ser på det periodiske system, vil du se, at hydrogen og helium er de eneste to grundstoffer i den første række. Det skyldes, at de kun har elektroner i deres første skal. Brint og helium er de eneste to grundstoffer, der har den laveste skal og ingen andre skaller.
Det andet og tredje energiniveau kan rumme op til otte elektroner. De otte elektroner er arrangeret i fire par, og en plads i hvert par er fyldt med en elektron, før nogen af parrene er færdige.
Hvis du ser på det periodiske system igen (figur 2), vil du bemærke, at der er syv rækker. Disse rækker svarer til det antal skaller, som grundstofferne i den pågældende række har. Grundstofferne i en bestemt række har et stigende antal elektroner, efterhånden som kolonnerne fortsætter fra venstre til højre. Selv om hvert grundstof har det samme antal skaller, er det ikke alle skallerne, der er helt fyldt med elektroner. Hvis du ser på den anden række i det periodiske system, finder du litium (Li), beryllium (Be), bor (B), kulstof (C), nitrogen (N), oxygen (O), fluor (F) og neon (Ne). Disse har alle elektroner, der kun optager den første og anden skal. Lithium har kun én elektron i sin yderste skal, beryllium har to elektroner, bor har tre og så videre, indtil hele skallen er fyldt med otte elektroner, som det er tilfældet med neon.
Det er ikke alle grundstoffer, der har nok elektroner til at fylde deres yderste skal, men et atom er mest stabilt, når alle elektronpositioner i den yderste skal er fyldt. På grund af disse ledige pladser i de yderste skaller ser vi dannelsen af kemiske bindinger eller vekselvirkninger mellem to eller flere af de samme eller forskellige grundstoffer, som resulterer i dannelsen af molekyler. For at opnå større stabilitet vil atomerne have en tendens til at fylde deres yderste skaller helt op og binde sig til andre grundstoffer for at nå dette mål ved at dele elektroner, acceptere elektroner fra et andet atom eller afgive elektroner til et andet atom. Da de yderste skaller af grundstoffer med lavt atomnummer (op til calcium med atomnummer 20) kan indeholde otte elektroner, kaldes dette for oktetreglen. Et grundstof kan afgive, acceptere eller dele elektroner med andre grundstoffer for at fylde sin yderste skal og opfylde oktetreglen.

Figur 4. Elementer har en tendens til at fylde deres yderste skal med elektroner. For at gøre dette kan de enten afgive eller tage imod elektroner fra andre grundstoffer.
Når et atom ikke indeholder lige mange protoner og elektroner, kaldes det en ion. Fordi antallet af elektroner ikke er lig med antallet af protoner, har hver ion en nettoladning. Positive ioner dannes ved at miste elektroner og kaldes kationer. Negative ioner dannes ved at få elektroner og kaldes anioner. Elementernes anioniske navne er ændret, så de ender på -ide.
Natrium har f.eks. kun én elektron i sin yderste skal. Det kræver mindre energi for natrium at afgive denne ene elektron, end det gør at tage imod syv ekstra elektroner for at fylde den yderste skal. Hvis natrium mister en elektron, har det nu 11 protoner og kun 10 elektroner, så det har en samlet ladning på +1. Det kaldes nu en natriumion.
Kloratomet har syv elektroner i sin yderste skal. Igen er det mere energieffektivt for klor at få én elektron end at miste syv. Derfor har det en tendens til at få en elektron for at skabe en ion med 17 protoner og 18 elektroner, hvilket giver den en negativ nettoladning (-1). Den kaldes nu en kloridion. Denne bevægelse af elektroner fra et grundstof til et andet kaldes elektronoverførsel. Som det fremgår af figur 4, har et natriumatom (Na) kun én elektron i sin yderste skal, mens et kloratatom (Cl) har syv elektroner i sin yderste skal. Et natriumatom vil afgive sin ene elektron for at tømme sin skal, og et kloratatom vil acceptere denne elektron for at fylde sin skal og blive til klorid. Begge ioner opfylder nu oktetreglen og har komplette yderste skaller. Da antallet af elektroner ikke længere er lig med antallet af protoner, er de nu hver især en ion og har en ladning på +1 (natrium) eller -1 (klorid).
Ioniske bindinger
Der findes fire typer bindinger eller vekselvirkninger: ioniske, kovalente, hydrogenbindinger og van der Waals-vekselvirkninger. Ioniske og kovalente bindinger er stærke vekselvirkninger, som kræver et større energitilskud for at blive brudt fra hinanden. Når et grundstof afgiver en elektron fra sin ydre skal, som i eksemplet med natriumatomet ovenfor, dannes der en positiv ion. Det grundstof, der modtager elektronen, er nu negativt ladet. Fordi positive og negative ladninger tiltrækkes, bliver disse ioner sammen og danner en ionisk binding, dvs. en binding mellem ioner. Elementerne bindes sammen, idet elektronen fra det ene element forbliver overvejende hos det andet element. Når Na+- og Cl-ioner kombineres for at danne NaCl, bliver en elektron fra et natriumatom sammen med de andre syv fra kloratomet, og natrium- og kloridionerne tiltrækker hinanden i et gitter af ioner med en nettoladning på nul.
Kovalente bindinger
En anden type stærk kemisk binding mellem to eller flere atomer er en kovalent binding. Disse bindinger dannes, når en elektron deles mellem to grundstoffer, og de er den stærkeste og mest almindelige form for kemiske bindinger i levende organismer. Kovalente bindinger dannes mellem de elementer, der udgør de biologiske molekyler i vores celler. I modsætning til ioniske bindinger dissocieres kovalente bindinger ikke i vand.
De hydrogen- og oxygenatomer, der kombineres for at danne vandmolekyler, er bundet sammen af kovalente bindinger. Elektronen fra hydrogenatomet deler sin tid mellem hydrogenatomets ydre skal og iltatomets ufuldstændige ydre skal. For at fylde iltatomets ydre skal fuldstændigt op, er der brug for to elektroner fra to brintatomer, deraf subscriptet “2” i H2O. Elektronerne deles mellem atomerne, idet de deler deres tid mellem dem for at “fylde” den ydre skal af hvert atom. Denne deling er en lavere energitilstand for alle de involverede atomer, end hvis de eksisterede uden deres ydre skaller fyldt.
Der findes to typer af kovalente bindinger: polære og upolære. Ikke-polære kovalente bindinger dannes mellem to atomer af det samme grundstof eller mellem forskellige grundstoffer, der deler elektronerne ligeligt. Et oxygenatom kan f.eks. binde sig til et andet oxygenatom for at udfylde deres ydre skaller. Denne binding er upolær, fordi elektronerne vil være ligeligt fordelt mellem hvert iltatom. Der dannes to kovalente bindinger mellem de to oxygenatomer, fordi oxygen kræver to delte elektroner for at udfylde sin yderste skal. Kvælstofatomer vil danne tre kovalente bindinger (også kaldet trippelkovalente) mellem to kvælstofatomer, fordi hvert kvælstofatom har brug for tre elektroner til at fylde sin yderste skal. Et andet eksempel på en upolær kovalent binding findes i metan (CH4)-molekylet. Kulstofatomet har fire elektroner i sin yderste skal og skal bruge fire mere for at fylde den. Det får disse fire fra fire brintatomer, hvor hvert atom giver en elektron. Disse elementer deler alle elektronerne ligeligt og skaber fire ikke-polære kovalente bindinger (figur 5).
I en polar kovalent binding tilbringer de elektroner, som atomerne deler, mere tid tættere på den ene kerne end på den anden kerne. På grund af den ulige fordeling af elektronerne mellem de forskellige kerner opstår der en svagt positiv (δ+) eller svagt negativ (δ-) ladning. De kovalente bindinger mellem hydrogen- og oxygenatomer i vand er polære kovalente bindinger. De delte elektroner tilbringer mere tid i nærheden af iltkernen, hvilket giver den en lille negativ ladning, end de tilbringer i nærheden af brintkernerne, hvilket giver disse molekyler en lille positiv ladning.

Figur 5. Vandmolekylet (til venstre) viser en polær binding med en let positiv ladning på hydrogenatomerne og en let negativ ladning på oxygenatomerne. Eksempler på upolære bindinger er metan (i midten) og oxygen (til højre).
Hydrogenbindinger
Ioniske og kovalente bindinger er stærke bindinger, der kræver betydelig energi at bryde. Det er dog ikke alle bindinger mellem grundstoffer, der er ioniske eller kovalente bindinger. Der kan også dannes svagere bindinger. Det er tiltrækninger, der opstår mellem positive og negative ladninger, som ikke kræver meget energi at bryde. To svage bindinger, der forekommer hyppigt, er hydrogenbindinger og van der Waals-interaktioner. Disse bindinger giver anledning til vands unikke egenskaber og de unikke strukturer i DNA og proteiner.
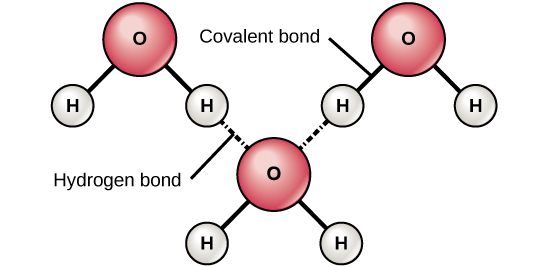
Figur 6. Der dannes hydrogenbindinger mellem svagt positive (δ+) og svagt negative (δ-) ladninger i polære kovalente molekyler, som f.eks. vand.
Når der dannes polære kovalente bindinger, der indeholder et hydrogenatom, har hydrogenatomet i denne binding en svagt positiv ladning. Dette skyldes, at den delte elektron trækkes stærkere mod det andet grundstof og væk fra brintkernen. Fordi hydrogenatomet er svagt positivt (δ+), vil det blive tiltrukket af de nærliggende negative partielle ladninger (δ-). Når dette sker, opstår der en svag vekselvirkning mellem δ+-ladningen fra hydrogenatomet i det ene molekyle og δ-ladningen fra det andet molekyle. Denne vekselvirkning kaldes en hydrogenbinding. Denne type binding er almindelig; f.eks. skyldes vands flydende natur brintbindinger mellem vandmolekyler (figur 6). Hydrogenbindinger giver vand de unikke egenskaber, som opretholder livet. Hvis det ikke var for hydrogenbindinger, ville vand være en gas i stedet for en væske ved stuetemperatur.
Hydrogenbindinger kan dannes mellem forskellige molekyler, og de behøver ikke altid at omfatte et vandmolekyle. Hydrogenatomer i polære bindinger i et hvilket som helst molekyle kan danne bindinger med andre tilstødende molekyler. For eksempel holder hydrogenbindinger to lange DNA-strenge sammen, så DNA-molekylet får sin karakteristiske dobbeltstrengede struktur. Hydrogenbindinger er også ansvarlige for en del af den tredimensionelle struktur i proteiner.
van der Waals-interaktioner
Ligefter hydrogenbindinger er van der Waals-interaktioner svage tiltrækninger eller interaktioner mellem molekyler. De opstår mellem polære, kovalent bundne, atomer i forskellige molekyler. Nogle af disse svage tiltrækninger skyldes midlertidige partielle ladninger, der dannes, når elektroner bevæger sig rundt om en kerne. Disse svage vekselvirkninger mellem molekyler er vigtige i biologiske systemer.
Sammenfatning af afsnittet
Materie er alt, der optager rum og har masse. Det består af atomer af forskellige grundstoffer. Alle de 92 grundstoffer, der forekommer naturligt, har unikke egenskaber, der gør det muligt for dem at kombinere sig på forskellige måder for at skabe forbindelser eller molekyler. Atomer, som består af protoner, neutroner og elektroner, er de mindste enheder af et grundstof, som bevarer alle grundstoffets egenskaber. Elektroner kan doneres eller deles mellem atomer for at skabe bindinger, herunder ioniske, kovalente og brintbindinger samt van der Waals-interaktioner.
Tidligere selvkontroløvelser
1. Se på figur 2: Hvor mange neutroner har henholdsvis (K) kalium-39 og kalium-40?
2. Hvorfor er brintbindinger og van der Waals-interaktioner nødvendige for celler?
Svar
1. Kalium-39 har tyve neutroner. Kalium-40 har enogtyve neutroner.
2. Brintbindinger og van der Waals-interaktioner danner svage forbindelser mellem forskellige molekyler. De giver den struktur og form, der er nødvendig for proteiner og DNA i cellerne, så de fungerer korrekt. Hydrogenbindinger giver også vand dets unikke egenskaber, som er nødvendige for liv.