Lärandemål
I slutet av detta avsnitt kommer du att kunna:
- Beskriv materia och grundämnen
- Beskriv förhållandet mellan protoner, neutroner och elektroner och hur elektroner kan doneras eller delas mellan atomer
På sin mest grundläggande nivå består livet av materia. Materia upptar utrymme och har massa. All materia består av grundämnen, ämnen som inte kan brytas ner eller omvandlas kemiskt till andra ämnen. Varje grundämne består av atomer, var och en med ett konstant antal protoner och unika egenskaper. Sammanlagt 118 grundämnen har definierats, men endast 92 förekommer naturligt och färre än 30 finns i levande celler. De återstående 26 grundämnena är instabila och existerar därför inte särskilt länge eller är teoretiska och har ännu inte upptäckts.
Varje grundämne betecknas med sin kemiska symbol (t.ex. H, N, O, C och Na) och har unika egenskaper. Dessa unika egenskaper gör det möjligt för grundämnen att kombinera och binda med varandra på specifika sätt.
Atomer
En atom är den minsta beståndsdelen av ett grundämne som behåller alla grundämnets kemiska egenskaper. Till exempel har en väteatom alla egenskaper hos grundämnet väte, till exempel att den existerar som en gas vid rumstemperatur och att den binder med syre för att skapa en vattenmolekyl. Väteatomer kan inte brytas ner till något mindre samtidigt som de behåller vätets egenskaper. Om en väteatom bröts ner till subatomära partiklar skulle den inte längre ha vätens egenskaper.
På den mest grundläggande nivån består alla organismer av en kombination av grundämnen. De innehåller atomer som kombineras till molekyler. I flercelliga organismer, t.ex. djur, kan molekyler interagera för att bilda celler som kombineras för att bilda vävnader, vilka utgör organ. Dessa kombinationer fortsätter tills hela flercelliga organismer bildas.

Figur 1. Atomer består av protoner och neutroner som befinner sig i kärnan och elektroner som omger kärnan.
Alla atomer innehåller protoner, elektroner och neutroner (figur 1). Det enda undantaget är väte (H), som består av en proton och en elektron. En proton är en positivt laddad partikel som befinner sig i kärnan (atomens kärna) av en atom och har en massa på 1 och en laddning på +1. En elektron är en negativt laddad partikel som rör sig i utrymmet runt kärnan. Med andra ord befinner den sig utanför kärnan. Den har en försumbar massa och en laddning på -1.
Neutroner, liksom protoner, befinner sig i en atomkärna. De har en massa på 1 och ingen laddning. De positiva (protoner) och negativa (elektroner) laddningarna balanserar varandra i en neutral atom, som har en nettoladdning på noll.
Då protoner och neutroner var och en har en massa på 1 är en atoms massa lika med antalet protoner och neutroner i den atomen. Antalet elektroner räknas inte in i den totala massan eftersom deras massa är så liten.
Som tidigare nämnts har varje grundämne sina egna unika egenskaper. Var och en innehåller ett olika antal protoner och neutroner, vilket ger den ett eget atomnummer och ett eget masstal. Atomnumret för ett grundämne är lika med antalet protoner som grundämnet innehåller. Massatalet är antalet protoner plus antalet neutroner i det grundämnet. Därför är det möjligt att bestämma antalet neutroner genom att subtrahera atomnumret från masstalet.
Dessa nummer ger information om grundämnena och hur de kommer att reagera när de kombineras. Olika grundämnen har olika smält- och kokpunkter och befinner sig i olika tillstånd (flytande, fast eller gas) vid rumstemperatur. De kombineras också på olika sätt. Vissa bildar specifika typer av bindningar, medan andra inte gör det. Hur de kombineras bygger på antalet närvarande elektroner. På grund av dessa egenskaper är grundämnena ordnade i det periodiska systemet för grundämnen, ett diagram över grundämnena som innehåller varje grundämnes atomnummer och relativa atommassa. Det periodiska systemet innehåller också viktig information om grundämnenas egenskaper (figur 2), som ofta anges genom färgkodning. Uppställningen i tabellen visar också hur elektronerna i varje grundämne är organiserade och ger viktiga detaljer om hur atomer kommer att reagera med varandra för att bilda molekyler.
Isotoper är olika former av samma grundämne som har samma antal protoner, men ett olika antal neutroner. Vissa grundämnen, till exempel kol, kalium och uran, har naturligt förekommande isotoper. Kol-12, den vanligaste isotopen av kol, innehåller sex protoner och sex neutroner. Därför har den ett masstal på 12 (sex protoner och sex neutroner) och ett atomnummer på 6 (vilket gör den till kol). Kol-14 innehåller sex protoner och åtta neutroner. Därför har det ett masstal på 14 (sex protoner och åtta neutroner) och ett atomnummer på 6, vilket innebär att det fortfarande är grundämnet kol. Dessa två alternativa former av kol är isotoper. Vissa isotoper är instabila och kommer att förlora protoner, andra subatomära partiklar eller energi för att bilda stabilare grundämnen. Dessa kallas radioaktiva isotoper eller radioisotoper.
Art Connection

Figur 2. Det periodiska systemet är ordnat i kolumner och rader baserat på grundämnenas egenskaper och ger viktig information om grundämnena och hur de kan interagera med varandra för att bilda molekyler. De flesta periodiska tabeller ger en nyckel eller legend till den information de innehåller.
Hur många neutroner har (K) kalium-39 respektive kalium-40?
Evolution in Action
Kolvedatering

Figur 3. Åldern på kvarlevor som innehåller kol och är mindre än cirka 50 000 år gamla, som den här dvärgmammuten, kan bestämmas med hjälp av koldatering. (kredit: Bill Faulkner/NPS)
Kol-14 (14C) är en naturligt förekommande radioisotop som skapas i atmosfären av kosmisk strålning. Detta är en kontinuerlig process, så det skapas alltid mer 14C. När en levande organism utvecklas är den relativa nivån av 14C i dess kropp lika med koncentrationen av 14C i atmosfären. När en organism dör får den inte längre i sig 14C, så förhållandet minskar. 14C sönderfaller till 14N genom en process som kallas betasönderfall; den avger energi i denna långsamma process.
Efter cirka 5 730 år kommer endast hälften av startkoncentrationen av 14C att ha omvandlats till 14N. Den tid det tar för hälften av den ursprungliga koncentrationen av en isotop att sönderfalla till sin stabilare form kallas halveringstid. Eftersom 14C:s halveringstid är lång används den för att åldersbestämma tidigare levande föremål, t.ex. fossiler. Genom att använda förhållandet mellan den 14C-koncentration som finns i ett föremål och den mängd 14C som påvisas i atmosfären kan man bestämma hur mycket av isotopen som ännu inte har sönderfallit. Utifrån denna mängd kan fossilets ålder beräknas till cirka 50 000 år (figur 3). Isotoper med längre halveringstid, t.ex. kalium-40, används för att beräkna åldern på äldre fossil. Med hjälp av koldatering kan forskare rekonstruera ekologin och biogeografin hos organismer som levde under de senaste 50 000 åren.
Concept in Action
Den här simuleringen visar dig mer om atomer och isotoper, och hur du kan skilja en isotop från en annan.
Kemiska bindningar
Hur grundämnen interagerar med varandra beror på hur deras elektroner är ordnade och hur många öppningar för elektroner som finns i det yttersta området där elektroner finns i en atom. Elektroner finns på energinivåer som bildar skal runt kärnan. Det närmaste skalet kan rymma upp till två elektroner. Det närmaste skalet till kärnan fylls alltid först, innan något annat skal kan fyllas. Vätgas har en elektron och har därför bara en plats upptagen i det lägsta skalet. Helium har två elektroner och kan därför helt fylla det nedersta skalet med sina två elektroner. Om du tittar på det periodiska systemet ser du att väte och helium är de enda två grundämnena i den första raden. Detta beror på att de bara har elektroner i sitt första skal. Väte och helium är de enda två grundämnena som har det lägsta skalet och inga andra skal.
Den andra och tredje energinivån kan rymma upp till åtta elektroner. De åtta elektronerna är ordnade i fyra par och en position i varje par fylls med en elektron innan något par är färdigt.
Om du tittar på det periodiska systemet igen (figur 2) kommer du att märka att det finns sju rader. Dessa rader motsvarar det antal skal som grundämnena inom den raden har. Grundämnena inom en viss rad har ett ökande antal elektroner när kolumnerna fortsätter från vänster till höger. Även om varje grundämne har samma antal skal är inte alla skalen helt fyllda med elektroner. Om du tittar på den andra raden i det periodiska systemet hittar du litium (Li), beryllium (Be), bor (B), kol (C), kväve (N), syre (O), fluor (F) och neon (Ne). Alla dessa har elektroner som endast upptar det första och andra höljet. Litium har bara en elektron i sitt yttersta skal, beryllium har två elektroner, bor har tre och så vidare, tills hela skalet är fyllt med åtta elektroner, vilket är fallet med neon.
Inte alla grundämnen har tillräckligt med elektroner för att fylla sina yttersta skal, men en atom är som mest stabil när alla elektronpositioner i det yttersta skalet är fyllda. På grund av dessa vakanser i de yttersta skalen ser vi bildandet av kemiska bindningar, eller interaktioner mellan två eller flera av samma eller olika grundämnen som resulterar i bildandet av molekyler. För att uppnå större stabilitet tenderar atomer att fylla sina yttersta skal helt och hållet och binder sig till andra grundämnen för att uppnå detta mål genom att dela elektroner, ta emot elektroner från en annan atom eller donera elektroner till en annan atom. Eftersom de yttersta skalen hos grundämnen med låga atomnummer (upp till kalcium, med atomnummer 20) kan rymma åtta elektroner, kallas detta för oktettregeln. Ett grundämne kan donera, ta emot eller dela elektroner med andra grundämnen för att fylla sitt yttre skal och uppfylla oktettregeln.

Figur 4. Element tenderar tenderar att fylla sina yttersta skal med elektroner. För att göra detta kan de antingen donera eller ta emot elektroner från andra grundämnen.
När en atom inte innehåller lika många protoner och elektroner kallas den för en jon. Eftersom antalet elektroner inte är lika med antalet protoner har varje jon en nettoladdning. Positiva joner bildas genom att förlora elektroner och kallas katjoner. Negativa joner bildas genom att de får elektroner och kallas anjoner. Elementens anjoniska namn ändras så att de slutar på -ide.
Natrium har till exempel bara en elektron i sitt yttersta skal. Det krävs mindre energi för natrium för att donera den ena elektronen än för att ta emot ytterligare sju elektroner för att fylla det yttersta skalet. Om natrium förlorar en elektron har den nu 11 protoner och endast 10 elektroner, vilket gör att den har en total laddning på +1. Den kallas nu en natriumjon.
Kloratomen har sju elektroner i sitt yttersta skal. Återigen är det mer energieffektivt för klor att få en elektron än att förlora sju. Därför tenderar den att få en elektron för att skapa en jon med 17 protoner och 18 elektroner, vilket ger den en negativ nettoladdning (-1). Den kallas nu en kloridjon. Denna förflyttning av elektroner från ett grundämne till ett annat kallas för elektronöverföring. Som figur 4 visar har en natriumatom (Na) endast en elektron i sitt yttersta skal, medan en kloratatom (Cl) har sju elektroner i sitt yttersta skal. En natriumatom avger sin elektron för att tömma sitt skal, och en kloratatom tar emot denna elektron för att fylla sitt skal och blir klorid. Båda jonerna uppfyller nu oktettregeln och har fullständiga yttersta skal. Eftersom antalet elektroner inte längre är lika med antalet protoner är båda nu en jon och har en laddning på +1 (natrium) eller -1 (klorid).
Ioniska bindningar
Det finns fyra typer av bindningar eller interaktioner: joniska, kovalenta, vätebindningar och van der Waals-interaktioner. Joniska och kovalenta bindningar är starka interaktioner som kräver en större energiåtgång för att brytas isär. När ett grundämne donerar en elektron från sitt yttre skal, som i exemplet med natriumatomen ovan, bildas en positiv jon. Det grundämne som tar emot elektronen är nu negativt laddat. Eftersom positiva och negativa laddningar attraherar varandra håller dessa joner ihop och bildar en jonisk bindning, eller en bindning mellan joner. Elementen binds samman genom att elektronen från det ena elementet förblir övervägande hos det andra elementet. När Na+- och Cl-joner kombineras för att bilda NaCl stannar en elektron från en natriumatom hos de andra sju från kloratomen, och natrium- och kloridjonerna drar till sig varandra i ett gitter av joner med en nettonoll-laddning.
Kovalenta bindningar
En annan typ av stark kemisk bindning mellan två eller flera atomer är en kovalent bindning. Dessa bindningar bildas när en elektron delas mellan två element och är den starkaste och vanligaste formen av kemiska bindningar i levande organismer. Kovalenta bindningar bildas mellan de element som utgör de biologiska molekylerna i våra celler. Till skillnad från joniska bindningar dissocieras inte kovalenta bindningar i vatten.
Väte- och syreatomerna som kombineras för att bilda vattenmolekyler är bundna till varandra genom kovalenta bindningar. Elektronen från väteatomen delar sin tid mellan väteatomens yttre skal och syreatomens ofullständiga yttre skal. För att fullständigt fylla syreatomens yttre skal behövs två elektroner från två väteatomer, därav substitutet ”2” i H2O. Elektronerna delas mellan atomerna och delar sin tid mellan dem för att ”fylla” det yttre skalet hos var och en av dem. Denna delning är ett lägre energitillstånd för alla inblandade atomer än om de existerar utan att deras yttre skal är fyllda.
Det finns två typer av kovalenta bindningar: polära och opolära. Opolära kovalenta bindningar bildas mellan två atomer av samma grundämne eller mellan olika grundämnen som delar elektronerna lika mycket. Till exempel kan en syreatom binda sig till en annan syreatom för att fylla deras yttre skal. Denna förening är opolär eftersom elektronerna kommer att fördelas lika mellan varje syreatom. Två kovalenta bindningar bildas mellan de två syreatomerna eftersom syre kräver två delade elektroner för att fylla sitt yttersta skal. Kväveatomer bildar tre kovalenta bindningar (även kallade trippelkovalenta) mellan två kväveatomer eftersom varje kväveatom behöver tre elektroner för att fylla sitt yttersta skal. Ett annat exempel på en opolär kovalent bindning finns i metanmolekylen (CH4). Kolatomen har fyra elektroner i sitt yttersta skal och behöver fyra till för att fylla det. Den får dessa fyra från fyra väteatomer, där varje atom ger en. Dessa element delar alla på elektronerna lika mycket, vilket skapar fyra opolära kovalenta bindningar (figur 5).
I en polär kovalent bindning tillbringar atomernas delade elektroner mer tid närmare den ena kärnan än den andra kärnan. På grund av den ojämna fördelningen av elektroner mellan de olika atomkärnorna utvecklas en svagt positiv (δ+) eller svagt negativ (δ-) laddning. De kovalenta bindningarna mellan väte- och syreatomer i vatten är polära kovalenta bindningar. De delade elektronerna tillbringar mer tid nära syrekärnan, vilket ger den en liten negativ laddning, än de tillbringar nära vätekärnorna, vilket ger dessa molekyler en liten positiv laddning.

Figur 5. Vattenmolekylen (vänster) visar en polär bindning med en svagt positiv laddning på väteatomerna och en svagt negativ laddning på syreatomerna. Exempel på opolära bindningar är metan (mitten) och syre (höger).
Vätgasbindningar
Ioniska och kovalenta bindningar är starka bindningar som kräver mycket energi för att brytas. Alla bindningar mellan grundämnen är dock inte joniska eller kovalenta bindningar. Svagare bindningar kan också bildas. Dessa är attraktioner som uppstår mellan positiva och negativa laddningar som inte kräver mycket energi för att brytas. Två svaga bindningar som förekommer ofta är vätebindningar och van der Waals-interaktioner. Dessa bindningar ger upphov till vattnets unika egenskaper och de unika strukturerna hos DNA och proteiner.
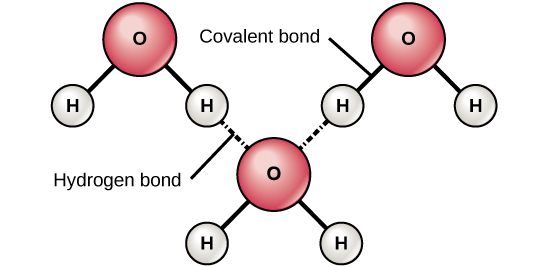
Figur 6. Vätgasbindningar bildas mellan svagt positiva (δ+) och svagt negativa (δ-) laddningar i polära kovalenta molekyler, t.ex. vatten.
När polära kovalenta bindningar som innehåller en väteatom bildas har väteatomen i denna bindning en svagt positiv laddning. Detta beror på att den delade elektronen dras starkare mot det andra grundämnet och bort från vätekärnan. Eftersom väteatomen är svagt positiv (δ+) kommer den att dras till närliggande negativa partiella laddningar (δ-). När detta sker uppstår en svag växelverkan mellan δ+-laddningen hos väteatomen i den ena molekylen och δ–laddningen hos den andra molekylen. Denna växelverkan kallas vätebindning. Denna typ av bindning är vanlig; till exempel orsakas vattnets flytande natur av vätebindningarna mellan vattenmolekylerna (figur 6). Vätebindningar ger vatten de unika egenskaper som upprätthåller livet. Om det inte vore för vätebindningar skulle vatten vara en gas snarare än en vätska vid rumstemperatur.
Vätebindningar kan bildas mellan olika molekyler och de behöver inte alltid inkludera en vattenmolekyl. Väteatomer i polära bindningar inom en molekyl kan bilda bindningar med andra intilliggande molekyler. Till exempel håller vätebindningar ihop två långa DNA-strängar för att ge DNA-molekylen dess karakteristiska dubbelsträngade struktur. Vätgasbindningar är också ansvariga för en del av den tredimensionella strukturen hos proteiner.
van der Waals-interaktioner
Likt vätebindningar är van der Waals-interaktioner svaga attraktioner eller interaktioner mellan molekyler. De uppstår mellan polära, kovalent bundna, atomer i olika molekyler. En del av dessa svaga attraktioner orsakas av tillfälliga partiella laddningar som bildas när elektroner rör sig runt en kärna. Dessa svaga interaktioner mellan molekyler är viktiga i biologiska system.
Avsnittssammanfattning
Materia är allt som upptar utrymme och har massa. Den består av atomer av olika grundämnen. Alla de 92 grundämnen som förekommer naturligt har unika egenskaper som gör att de kan kombineras på olika sätt för att skapa föreningar eller molekyler. Atomer, som består av protoner, neutroner och elektroner, är de minsta enheterna av ett grundämne som behåller alla grundämnets egenskaper. Elektroner kan doneras eller delas mellan atomer för att skapa bindningar, inklusive joniska, kovalenta och vätebindningar samt van der Waals-interaktioner.
Tilläggsövningar för självkontroll
1. Titta på figur 2: Hur många neutroner har (K) kalium-39 respektive kalium-40?
2. Varför är vätebindningar och van der Waals-interaktioner nödvändiga för celler?
Svar
1. Kalium-39 har tjugo neutroner. Kalium-40 har tjugoen neutroner.
2. Vätebindningar och van der Waals-interaktioner bildar svaga föreningar mellan olika molekyler. De ger proteiner och DNA i cellerna den struktur och form som behövs för att de ska fungera korrekt. Vätebindningar ger också vatten dess unika egenskaper, som är nödvändiga för livet.