Obiective de învățare
La sfârșitul acestei secțiuni, veți fi capabili să:
- Descrieți materia și elementele
- Descrieți interrelația dintre protoni, neutroni și electroni, precum și modalitățile prin care electronii pot fi donați sau împărțiți între atomi
La nivelul cel mai fundamental, viața este alcătuită din materie. Materia ocupă spațiu și are masă. Toată materia este compusă din elemente, substanțe care nu pot fi descompuse sau transformate chimic în alte substanțe. Fiecare element este alcătuit din atomi, fiecare având un număr constant de protoni și proprietăți unice. În total, au fost definite 118 elemente; cu toate acestea, doar 92 apar în mod natural, iar mai puțin de 30 se găsesc în celulele vii. Cele 26 de elemente rămase sunt instabile și, prin urmare, nu există pentru foarte mult timp sau sunt teoretice și nu au fost încă detectate.
Care element este desemnat prin simbolul său chimic (cum ar fi H, N, O, C și Na) și posedă proprietăți unice. Aceste proprietăți unice permit elementelor să se combine și să se lege între ele în moduri specifice.
Atomi
Un atom este cea mai mică componentă a unui element care păstrează toate proprietățile chimice ale acelui element. De exemplu, un atom de hidrogen are toate proprietățile elementului hidrogen, cum ar fi că există sub formă de gaz la temperatura camerei și se leagă cu oxigenul pentru a crea o moleculă de apă. Atomii de hidrogen nu pot fi descompuși în ceva mai mic, păstrând în același timp proprietățile hidrogenului. Dacă un atom de hidrogen ar fi descompus în particule subatomice, acesta nu ar mai avea proprietățile hidrogenului.
La nivelul cel mai elementar, toate organismele sunt alcătuite dintr-o combinație de elemente. Ele conțin atomi care se combină între ei pentru a forma molecule. În organismele multicelulare, cum ar fi animalele, moleculele pot interacționa pentru a forma celule care se combină pentru a forma țesuturi, care alcătuiesc organele. Aceste combinații continuă până când se formează organisme multicelulare întregi.

Figura 1. Atomii sunt formați din protoni și neutroni localizați în nucleu și electroni care înconjoară nucleul.
Toți atomii conțin protoni, electroni și neutroni (figura 1). Singura excepție este hidrogenul (H), care este alcătuit dintr-un proton și un electron. Un proton este o particulă încărcată pozitiv care locuiește în nucleul (miezul atomului) unui atom și are masa 1 și sarcina +1. Un electron este o particulă cu sarcină negativă care se deplasează în spațiul din jurul nucleului. Cu alte cuvinte, acesta locuiește în afara nucleului. Are o masă neglijabilă și are sarcina de -1.
Neutronii, ca și protonii, rezidă în nucleul unui atom. Ei au o masă de 1 și nu au sarcină. Sarcinile pozitive (protoni) și negative (electroni) se echilibrează reciproc într-un atom neutru, care are o sarcină netă zero.
Pentru că protonii și neutronii au fiecare o masă de 1, masa unui atom este egală cu numărul de protoni și neutroni din acel atom. Numărul de electroni nu intră în calculul masei totale, deoarece masa lor este atât de mică.
După cum s-a spus mai devreme, fiecare element are propriile sale proprietăți unice. Fiecare conține un număr diferit de protoni și neutroni, ceea ce îi conferă un număr atomic și un număr de masă proprii. Numărul atomic al unui element este egal cu numărul de protoni pe care îl conține acel element. Numărul de masă este egal cu numărul de protoni plus numărul de neutroni ai acelui element. Prin urmare, este posibil să se determine numărul de neutroni scăzând numărul atomic din numărul de masă.
Aceste numere oferă informații despre elemente și despre modul în care acestea vor reacționa atunci când sunt combinate. Diferite elemente au puncte de topire și de fierbere diferite și se află în diferite stări (lichid, solid sau gaz) la temperatura camerei. De asemenea, ele se combină în moduri diferite. Unele formează tipuri specifice de legături, în timp ce altele nu. Modul în care se combină se bazează pe numărul de electroni prezenți. Datorită acestor caracteristici, elementele sunt aranjate în tabelul periodic al elementelor, un tabel al elementelor care include numărul atomic și masa atomică relativă a fiecărui element. Tabelul periodic oferă, de asemenea, informații cheie despre proprietățile elementelor (Figura 2) – adesea indicate prin coduri de culori. Aranjamentul tabelului arată, de asemenea, modul în care sunt organizați electronii din fiecare element și oferă detalii importante despre modul în care atomii vor reacționa unii cu alții pentru a forma molecule.
Izotopii sunt forme diferite ale aceluiași element care au același număr de protoni, dar un număr diferit de neutroni. Unele elemente, cum ar fi carbonul, potasiul și uraniul, au izotopi care apar în mod natural. Carbonul-12, cel mai comun izotop al carbonului, conține șase protoni și șase neutroni. Prin urmare, are un număr de masă de 12 (șase protoni și șase neutroni) și un număr atomic de 6 (ceea ce îl face să fie carbon). Carbonul-14 conține șase protoni și opt neutroni. Prin urmare, are un număr de masă de 14 (șase protoni și opt neutroni) și un număr atomic de 6, ceea ce înseamnă că este tot elementul carbon. Aceste două forme alternative ale carbonului sunt izotopi. Unii izotopi sunt instabili și vor pierde protoni, alte particule subatomice sau energie pentru a forma elemente mai stabile. Aceștia se numesc izotopi radioactivi sau radioizotopi.
Art Connection

Figura 2. Aranjat în coloane și rânduri pe baza caracteristicilor elementelor, tabelul periodic oferă informații cheie despre elemente și despre modul în care acestea ar putea interacționa între ele pentru a forma molecule. Majoritatea tabelelor periodice oferă o cheie sau o legendă pentru informațiile pe care le conțin.
Câți neutroni au (K) potasiul-39 și, respectiv, potasiul-40?
Evoluția în acțiune
Datarea cu carbon

Figura 3. Vârsta rămășițelor care conțin carbon și au o vechime mai mică de aproximativ 50.000 de ani, cum ar fi acest mamut pigmeu, poate fi determinată cu ajutorul datării cu carbon. (credit: Bill Faulkner/NPS)
Carbon 14 (14C) este un radioizotop natural care este creat în atmosferă de către razele cosmice. Acesta este un proces continuu, astfel încât se creează mereu mai mult 14C. Pe măsură ce un organism viu se dezvoltă, nivelul relativ de 14C din corpul său este egal cu concentrația de 14C din atmosferă. Atunci când un organism moare, acesta nu mai ingerează 14C, astfel că raportul va scădea. 14C se dezintegrează în 14N printr-un proces numit dezintegrare beta; el cedează energie în acest proces lent.
După aproximativ 5.730 de ani, doar jumătate din concentrația inițială de 14C va fi fost transformată în 14N. Timpul necesar pentru ca jumătate din concentrația inițială a unui izotop să se dezintegreze în forma sa mai stabilă se numește timpul său de înjumătățire. Deoarece timpul de înjumătățire al 14C este lung, acesta este utilizat pentru a stabili vârsta unor obiecte care au fost vii, cum ar fi fosilele. Utilizând raportul dintre concentrația de 14C găsită într-un obiect și cantitatea de 14C detectată în atmosferă, se poate determina cantitatea de izotop care nu s-a descompus încă. Pe baza acestei cantități, vârsta fosilei poate fi calculată la aproximativ 50.000 de ani (Figura 3). Izotopii cu timpi de înjumătățire mai lungi, cum ar fi potasiu-40, sunt utilizați pentru a calcula vârsta fosilelor mai vechi. Prin utilizarea datării cu carbon, oamenii de știință pot reconstitui ecologia și biogeografia organismelor care au trăit în ultimii 50.000 de ani.
Concept în acțiune
Această simulare vă arată mai multe despre atomi și izotopi și cum puteți deosebi un izotop de altul.
Legături chimice
Modul în care elementele interacționează unele cu altele depinde de modul în care sunt aranjați electronii lor și de câte deschideri pentru electroni există în regiunea cea mai exterioară în care sunt prezenți electronii într-un atom. Electronii există la niveluri de energie care formează învelișuri în jurul nucleului. Cea mai apropiată cochilie poate conține până la doi electroni. Învelișul cel mai apropiat de nucleu este întotdeauna umplut primul, înainte ca orice alt înveliș să poată fi umplut. Hidrogenul are un singur electron; prin urmare, are un singur loc ocupat în cea mai joasă cochilie. Heliul are doi electroni; prin urmare, poate umple complet învelișul cel mai de jos cu cei doi electroni ai săi. Dacă vă uitați la tabelul periodic, veți vedea că hidrogenul și heliul sunt singurele două elemente din primul rând. Acest lucru se datorează faptului că acestea au doar electroni în prima cochilie. Hidrogenul și heliul sunt singurele două elemente care au învelișul cel mai de jos și niciun alt înveliș.
Nivelurile de energie al doilea și al treilea pot conține până la opt electroni. Cei opt electroni sunt aranjați în patru perechi și o poziție din fiecare pereche este umplută cu un electron înainte ca orice pereche să fie completată.
Urmărind din nou tabelul periodic (figura 2), veți observa că există șapte rânduri. Aceste rânduri corespund numărului de învelișuri pe care le au elementele din rândul respectiv. Elementele din cadrul unui anumit rând au un număr din ce în ce mai mare de electroni pe măsură ce coloanele avansează de la stânga la dreapta. Deși fiecare element are același număr de învelișuri, nu toate învelișurile sunt complet umplute cu electroni. Dacă vă uitați la al doilea rând al tabelului periodic, veți găsi litiu (Li), beriliu (Be), bor (B), carbon (C), azot (N), oxigen (O), fluor (F) și neon (Ne). Toate acestea au electroni care ocupă doar prima și a doua învelișuri. Litiul are doar un singur electron în învelișul său cel mai exterior, beriliul are doi electroni, borul are trei și așa mai departe, până când întregul înveliș este umplut cu opt electroni, așa cum este cazul neonului.
Nu toate elementele au suficienți electroni pentru a-și umple învelișurile cele mai exterioare, dar un atom este cel mai stabil atunci când toate pozițiile electronice din învelișul cel mai exterior sunt ocupate. Din cauza acestor locuri libere în învelișurile cele mai exterioare, asistăm la formarea de legături chimice sau interacțiuni între două sau mai multe elemente identice sau diferite, care duc la formarea de molecule. Pentru a obține o mai mare stabilitate, atomii vor avea tendința de a-și umple complet învelișurile exterioare și se vor lega cu alte elemente pentru a atinge acest obiectiv prin schimbul de electroni, prin acceptarea de electroni de la un alt atom sau prin donarea de electroni unui alt atom. Deoarece învelișurile cele mai exterioare ale elementelor cu număr atomic mic (până la calciu, cu numărul atomic 20) pot conține opt electroni, acest lucru se numește regula octetului. Un element poate să doneze, să accepte sau să împartă electroni cu alte elemente pentru a-și umple învelișul exterior și a satisface regula octetului.

Figura 4. Elementele au tendința de a-și umple cu electroni învelișurile cele mai exterioare. Pentru a face acest lucru, ele pot fie să doneze, fie să accepte electroni de la alte elemente.
Când un atom nu conține un număr egal de protoni și electroni, acesta se numește ion. Deoarece numărul de electroni nu este egal cu numărul de protoni, fiecare ion are o sarcină netă. Ionii pozitivi se formează prin pierderea de electroni și se numesc cationi. Ionii negativi se formează prin câștigarea de electroni și se numesc anioni. Denumirile elementale anionice sunt modificate pentru a se termina în -ide.
De exemplu, sodiul are doar un singur electron în învelișul său cel mai exterior. Este nevoie de mai puțină energie pentru ca sodiul să doneze acel singur electron decât pentru a accepta încă șapte electroni pentru a umple învelișul exterior. Dacă sodiul pierde un electron, acesta are acum 11 protoni și doar 10 electroni, rămânând cu o sarcină totală de +1. Acum se numește ion de sodiu.
Astomul de clor are șapte electroni în învelișul său exterior. Din nou, este mai eficient din punct de vedere energetic ca clorul să câștige un electron decât să piardă șapte. Prin urmare, acesta tinde să câștige un electron pentru a crea un ion cu 17 protoni și 18 electroni, ceea ce îi conferă o sarcină netă negativă (-1). Acesta se numește acum ion clorură. Această mișcare a electronilor de la un element la altul se numește transfer de electroni. După cum ilustrează figura 4, un atom de sodiu (Na) are doar un singur electron în învelișul său cel mai exterior, în timp ce un atom de clor (Cl) are șapte electroni în învelișul său cel mai exterior. Un atom de sodiu va dona singurul său electron pentru a-și goli învelișul, iar un atom de clor va accepta acel electron pentru a-și umple învelișul, devenind clorură. Ambii ioni îndeplinesc acum regula octetului și au învelișurile exterioare complete. Deoarece numărul de electroni nu mai este egal cu numărul de protoni, fiecare este acum un ion și are o sarcină +1 (sodiu) sau -1 (clorură).
Legături ionice
Există patru tipuri de legături sau interacțiuni: ionice, covalente, legături de hidrogen și interacțiuni van der Waals. Legăturile ionice și covalente sunt interacțiuni puternice care necesită un aport mai mare de energie pentru a se rupe. Atunci când un element donează un electron din învelișul său exterior, ca în exemplul atomului de sodiu de mai sus, se formează un ion pozitiv. Elementul care acceptă electronul este acum încărcat negativ. Deoarece sarcinile pozitive și negative se atrag, acești ioni rămân împreună și formează o legătură ionică, sau o legătură între ioni. Elementele se leagă între ele, electronul de la un element rămânând preponderent cu celălalt element. Atunci când ionii Na+ și Cl- se combină pentru a produce NaCl, un electron de la un atom de sodiu rămâne cu ceilalți șapte de la atomul de clor, iar ionii de sodiu și clorură se atrag reciproc într-o rețea de ioni cu sarcină netă zero.
Legături covalente
Un alt tip de legătură chimică puternică între doi sau mai mulți atomi este legătura covalentă. Aceste legături se formează atunci când un electron este împărțit între două elemente și sunt cea mai puternică și cea mai comună formă de legătură chimică în organismele vii. Legăturile covalente se formează între elementele care alcătuiesc moleculele biologice din celulele noastre. Spre deosebire de legăturile ionice, legăturile covalente nu se disociază în apă.
Atomii de hidrogen și oxigen care se combină pentru a forma moleculele de apă sunt legați între ei prin legături covalente. Electronul din atomul de hidrogen își împarte timpul între învelișul exterior al atomului de hidrogen și învelișul exterior incomplet al atomului de oxigen. Pentru a umple complet învelișul exterior al unui atom de oxigen, sunt necesari doi electroni de la doi atomi de hidrogen, de unde și indicele „2” din H2O. Electronii sunt împărțiți între atomi, împărțindu-și timpul între ei pentru a „umple” învelișul exterior al fiecăruia. Această partajare reprezintă o stare de energie mai mică pentru toți atomii implicați decât dacă ar exista fără ca învelișurile lor exterioare să fie umplute.
Există două tipuri de legături covalente: polare și nepolare. Legăturile covalente nepolare se formează între doi atomi ai aceluiași element sau între elemente diferite care își împart electronii în mod egal. De exemplu, un atom de oxigen se poate lega de un alt atom de oxigen pentru a-și umple învelișurile exterioare. Această asociere este nepolară deoarece electronii vor fi distribuiți în mod egal între fiecare atom de oxigen. Între cei doi atomi de oxigen se formează două legături covalente, deoarece oxigenul are nevoie de doi electroni comuni pentru a-și umple învelișul cel mai exterior. Atomii de azot vor forma trei legături covalente (numite și triple covalente) între doi atomi de azot, deoarece fiecare atom de azot are nevoie de trei electroni pentru a-și umple învelișul cel mai exterior. Un alt exemplu de legătură covalentă nepolară se găsește în molecula de metan (CH4). Atomul de carbon are patru electroni în învelișul său cel mai exterior și are nevoie de încă patru pentru a-l umple. Îi obține de la patru atomi de hidrogen, fiecare atom furnizând câte unul. Toate aceste elemente împart electronii în mod egal, creând patru legături covalente nepolare (figura 5).
Într-o legătură covalentă polară, electronii împărțiți de atomi petrec mai mult timp mai aproape de un nucleu decât de celălalt nucleu. Din cauza distribuției inegale a electronilor între diferitele nuclee, se dezvoltă o sarcină ușor pozitivă (δ+) sau ușor negativă (δ-). Legăturile covalente dintre atomii de hidrogen și oxigen din apă sunt legături covalente polare. Electronii partajați petrec mai mult timp în apropierea nucleului de oxigen, conferindu-i o mică sarcină negativă, decât în apropierea nucleelor de hidrogen, ceea ce conferă acestor molecule o mică sarcină pozitivă.

Figura 5. Molecula de apă (stânga) ilustrează o legătură polară cu o sarcină ușor pozitivă pe atomii de hidrogen și o sarcină ușor negativă pe cei de oxigen. Exemple de legături nepolare includ metanul (mijloc) și oxigenul (dreapta).
Legături de hidrogen
Legăturile ionice și covalente sunt legături puternice care necesită o energie considerabilă pentru a se rupe. Cu toate acestea, nu toate legăturile dintre elemente sunt legături ionice sau covalente. Se pot forma și legături mai slabe. Acestea sunt atracții care au loc între sarcini pozitive și negative care nu necesită multă energie pentru a se rupe. Două legături slabe care apar frecvent sunt legăturile de hidrogen și interacțiunile van der Waals. Aceste legături dau naștere proprietăților unice ale apei și structurilor unice ale ADN-ului și proteinelor.
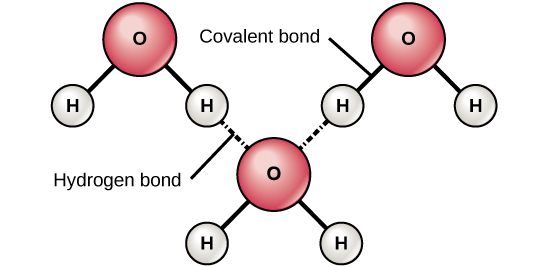
Figura 6. Legăturile de hidrogen se formează între sarcinile ușor pozitive (δ+) și ușor negative (δ-) ale moleculelor covalente polare, cum ar fi apa.
Când se formează legături covalente polare care conțin un atom de hidrogen, atomul de hidrogen din acea legătură are o sarcină ușor pozitivă. Acest lucru se datorează faptului că electronul partajat este atras mai puternic spre celălalt element și îndepărtat de nucleul de hidrogen. Deoarece atomul de hidrogen este ușor pozitiv (δ+), acesta va fi atras de sarcinile parțiale negative învecinate (δ-). Când se întâmplă acest lucru, are loc o interacțiune slabă între sarcina δ+ a atomului de hidrogen dintr-o moleculă și sarcina δ- a celeilalte molecule. Această interacțiune se numește legătură de hidrogen. Acest tip de legătură este comun; de exemplu, natura lichidă a apei este cauzată de legăturile de hidrogen dintre moleculele de apă (Figura 6). Legăturile de hidrogen conferă apei proprietățile unice care susțin viața. Dacă nu ar fi existat legăturile de hidrogen, apa ar fi fost mai degrabă un gaz decât un lichid la temperatura camerei.
Legăturile de hidrogen se pot forma între diferite molecule și nu trebuie să includă întotdeauna o moleculă de apă. Atomii de hidrogen din legăturile polare din orice moleculă pot forma legături cu alte molecule adiacente. De exemplu, legăturile de hidrogen țin împreună două șiruri lungi de ADN pentru a da moleculei de ADN structura sa caracteristică cu două șiruri. Legăturile de hidrogen sunt, de asemenea, responsabile pentru o parte din structura tridimensională a proteinelor.
Interacțiuni van der Waals
Ca și legăturile de hidrogen, interacțiunile van der Waals sunt atracții sau interacțiuni slabe între molecule. Ele apar între atomii polari, legați covalent, din molecule diferite. Unele dintre aceste atracții slabe sunt cauzate de sarcinile parțiale temporare formate atunci când electronii se deplasează în jurul unui nucleu. Aceste interacțiuni slabe între molecule sunt importante în sistemele biologice.
Rezumat al secțiunii
Materia este orice lucru care ocupă spațiu și are masă. Ea este alcătuită din atomi de diferite elemente. Toate cele 92 de elemente care apar în mod natural au calități unice care le permit să se combine în diferite moduri pentru a crea compuși sau molecule. Atomii, care constau din protoni, neutroni și electroni, sunt cele mai mici unități ale unui element care păstrează toate proprietățile acelui element. Electronii pot fi donați sau împărțiți între atomi pentru a crea legături, inclusiv legături ionice, covalente și de hidrogen, precum și interacțiuni van der Waals.
Exerciții suplimentare de autoverificare
1. Priviți figura 2: Câți neutroni au (K) potasiu-39 și, respectiv, potasiu-40?
2. De ce sunt necesare legăturile de hidrogen și interacțiunile van der Waals pentru celule?
Răspunsuri
1. Potasiul-39 are douăzeci de neutroni. Potasiul-40 are douăzeci și unu de neutroni.
2. Legăturile de hidrogen și interacțiunile van der Waals formează asociații slabe între diferite molecule. Ele asigură structura și forma necesare proteinelor și ADN-ului din celule pentru ca acestea să funcționeze corect. De asemenea, legăturile de hidrogen conferă apei proprietățile sale unice, care sunt necesare pentru viață.
.