Leerdoelen
Aan het eind van dit deel, zul je in staat zijn om:
- Materie en elementen beschrijven
- De onderlinge relatie tussen protonen, neutronen en elektronen beschrijven, en de manieren waarop elektronen kunnen worden afgestaan of gedeeld tussen atomen
Op het meest fundamentele niveau is het leven opgebouwd uit materie. Materie neemt ruimte in en heeft massa. Alle materie is samengesteld uit elementen, stoffen die niet kunnen worden afgebroken of chemisch worden omgezet in andere stoffen. Elk element is opgebouwd uit atomen, elk met een constant aantal protonen en unieke eigenschappen. In totaal zijn er 118 elementen gedefinieerd; slechts 92 komen echter in de natuur voor, en minder dan 30 worden in levende cellen aangetroffen. De overige 26 elementen zijn instabiel en bestaan dus niet lang of zijn theoretisch en moeten nog worden ontdekt.
Elk element wordt aangeduid met zijn chemisch symbool (zoals H, N, O, C, en Na), en bezit unieke eigenschappen. Door deze unieke eigenschappen kunnen elementen zich op specifieke manieren met elkaar verbinden en verbinden.
Atomen
Een atoom is het kleinste bestanddeel van een element dat alle chemische eigenschappen van dat element behoudt. Zo heeft een waterstofatoom alle eigenschappen van het element waterstof, zoals het bestaan als een gas bij kamertemperatuur, en het bindt zich met zuurstof om een watermolecuul te vormen. Waterstofatomen kunnen niet worden afgebroken tot iets kleiners terwijl ze toch de eigenschappen van waterstof behouden. Als een waterstofatoom zou worden opgesplitst in subatomaire deeltjes, zou het niet langer de eigenschappen van waterstof hebben.
Op het meest basale niveau zijn alle organismen gemaakt van een combinatie van elementen. Zij bevatten atomen die zich samenvoegen tot moleculen. In meercellige organismen, zoals dieren, kunnen moleculen op elkaar inwerken om cellen te vormen die zich combineren om weefsels te vormen, waaruit organen zijn opgebouwd. Deze combinaties gaan door totdat volledige meercellige organismen zijn gevormd.

Figuur 1. Atomen zijn opgebouwd uit protonen en neutronen die zich in de kern bevinden, en elektronen die de kern omringen.
Alle atomen bevatten protonen, elektronen en neutronen (figuur 1). De enige uitzondering is waterstof (H), dat bestaat uit één proton en één elektron. Een proton is een positief geladen deeltje dat zich in de kern (de kern van het atoom) van een atoom bevindt en een massa van 1 en een lading van +1 heeft. Een elektron is een negatief geladen deeltje dat zich in de ruimte rond de atoomkern bevindt. Met andere woorden, het bevindt zich buiten de atoomkern. Het heeft een verwaarloosbare massa en heeft een lading van -1.
Neutronen bevinden zich, net als protonen, in de kern van een atoom. Zij hebben een massa van 1 en geen lading. De positieve (protonen) en negatieve (elektronen) ladingen houden elkaar in evenwicht in een neutraal atoom, dat netto een lading van nul heeft.
Omdat protonen en neutronen elk een massa van 1 hebben, is de massa van een atoom gelijk aan het aantal protonen en neutronen van dat atoom. Het aantal elektronen speelt geen rol in de totale massa, omdat hun massa zo klein is.
Zoals eerder gezegd, heeft elk element zijn eigen unieke eigenschappen. Elk bevat een verschillend aantal protonen en neutronen, waardoor het een eigen atoomnummer en massagetal heeft. Het atoomnummer van een element is gelijk aan het aantal protonen dat het element bevat. Het massagetal is het aantal protonen plus het aantal neutronen van dat element. Het is dus mogelijk het aantal neutronen te bepalen door het atoomnummer van het massagetal af te trekken.
Deze getallen geven informatie over de elementen en hoe ze zullen reageren als ze worden gecombineerd. Verschillende elementen hebben verschillende smelt- en kookpunten, en bevinden zich in verschillende toestanden (vloeibaar, vast, of gas) bij kamertemperatuur. Ze combineren ook op verschillende manieren. Sommige vormen specifieke soorten bindingen, terwijl andere dat niet doen. Hoe ze zich verbinden is gebaseerd op het aantal aanwezige elektronen. Vanwege deze eigenschappen zijn de elementen gerangschikt in het periodiek systeem der elementen, een tabel van de elementen met het atoomnummer en de relatieve atoommassa van elk element. Het periodiek systeem geeft ook belangrijke informatie over de eigenschappen van de elementen (figuur 2) – vaak aangegeven door kleurcodering. De ordening van de tabel laat ook zien hoe de elektronen in elk element zijn georganiseerd en geeft belangrijke details over hoe atomen met elkaar zullen reageren om moleculen te vormen.
Isotopen zijn verschillende vormen van hetzelfde element die hetzelfde aantal protonen hebben, maar een verschillend aantal neutronen. Sommige elementen, zoals koolstof, kalium en uranium, hebben natuurlijk voorkomende isotopen. Koolstof-12, de meest voorkomende isotoop van koolstof, bevat zes protonen en zes neutronen. Daarom heeft het een massagetal van 12 (zes protonen en zes neutronen) en een atoomnummer van 6 (wat het koolstof maakt). Koolstof-14 bevat zes protonen en acht neutronen. Het heeft dus een massagetal van 14 (zes protonen en acht neutronen) en een atoomnummer van 6, wat betekent dat het nog steeds het element koolstof is. Deze twee alternatieve vormen van koolstof zijn isotopen. Sommige isotopen zijn onstabiel en zullen protonen, andere subatomaire deeltjes of energie verliezen om stabielere elementen te vormen. Deze worden radioactieve isotopen of radio-isotopen genoemd.
Art Connection

Figuur 2. Het periodiek systeem, gerangschikt in kolommen en rijen op basis van de eigenschappen van de elementen, geeft belangrijke informatie over de elementen en hoe ze met elkaar kunnen interageren om moleculen te vormen. De meeste periodieke tabellen bevatten een sleutel of legenda bij de informatie die ze bevatten.
Hoeveel neutronen hebben (K) kalium-39 en kalium-40 respectievelijk?
Evolutie in actie
Koolstofdatering

Figuur 3. De leeftijd van overblijfselen die koolstof bevatten en minder dan ongeveer 50.000 jaar oud zijn, zoals deze pygmee mammoet, kan worden bepaald met behulp van koolstofdatering. (credit: Bill Faulkner/NPS)
Koolstof-14 (14C) is een natuurlijk voorkomend radio-isotoop dat in de atmosfeer wordt gecreëerd door kosmische straling. Dit is een continu proces, dus er wordt altijd meer 14C aangemaakt. Wanneer een levend organisme zich ontwikkelt, is het relatieve niveau van 14C in zijn lichaam gelijk aan de concentratie van 14C in de atmosfeer. Wanneer een organisme sterft, neemt het geen 14C meer op, zodat de verhouding zal dalen. 14C vervalt tot 14N door een proces dat bètaverval wordt genoemd; het geeft energie af in dit langzame proces.
Na ongeveer 5730 jaar zal slechts de helft van de beginconcentratie van 14C zijn omgezet in 14N. De tijd die nodig is om de helft van de oorspronkelijke concentratie van een isotoop in zijn stabielere vorm te laten vervallen, wordt de halveringstijd genoemd. Omdat de halfwaardetijd van 14C lang is, wordt deze gebruikt om vroeger levende objecten, zoals fossielen, te verouderen. Aan de hand van de verhouding tussen de 14C-concentratie die in een voorwerp wordt aangetroffen en de hoeveelheid 14C die in de atmosfeer wordt aangetroffen, kan de hoeveelheid van de isotoop die nog niet is vervallen, worden bepaald. Op basis van deze hoeveelheid kan de leeftijd van het fossiel worden berekend op ongeveer 50.000 jaar (figuur 3). Isotopen met een langere halfwaardetijd, zoals kalium-40, worden gebruikt om de ouderdom van oudere fossielen te berekenen. Met behulp van koolstofdatering kunnen wetenschappers de ecologie en biogeografie reconstrueren van organismen die in de afgelopen 50.000 jaar leefden.
Concept in actie
Deze simulatie laat je meer zien over atomen en isotopen, en hoe je het ene isotoop van het andere kunt onderscheiden.
Chemische bindingen
Hoe elementen met elkaar reageren hangt af van hoe hun elektronen zijn gerangschikt en hoeveel openingen voor elektronen er zijn in het buitenste gebied waar elektronen in een atoom aanwezig zijn. Elektronen bestaan op energieniveaus die schillen vormen rond de kern. De dichtstbijzijnde schil kan maximaal twee elektronen bevatten. De dichtstbijzijnde schil bij de kern wordt altijd eerst gevuld, voordat een andere schil kan worden gevuld. Waterstof heeft één elektron; daarom is er slechts één plaats bezet in de onderste schil. Helium heeft twee elektronen; daarom kan het de onderste schil volledig vullen met zijn twee elektronen. Als u naar het periodiek systeem kijkt, zult u zien dat waterstof en helium de enige twee elementen in de eerste rij zijn. Dit komt omdat zij alleen elektronen in hun eerste schil hebben. Waterstof en helium zijn de enige twee elementen die de laagste schil hebben en geen andere schillen.
De tweede en derde energieniveaus kunnen tot acht elektronen bevatten. De acht elektronen zijn gerangschikt in vier paren en één positie in elk paar is gevuld met een elektron voordat er paren zijn voltooid.
Kijkend naar het periodiek systeem opnieuw (figuur 2), zult u opmerken dat er zeven rijen zijn. Deze rijen corresponderen met het aantal schillen dat de elementen binnen die rij hebben. De elementen in een bepaalde rij hebben een toenemend aantal elektronen naarmate de kolommen van links naar rechts doorlopen. Hoewel elk element hetzelfde aantal schillen heeft, zijn niet alle schillen volledig gevuld met elektronen. Als u naar de tweede rij van het periodiek systeem kijkt, ziet u lithium (Li), beryllium (Be), boor (B), koolstof (C), stikstof (N), zuurstof (O), fluor (F), en neon (Ne). Deze hebben allemaal elektronen die alleen de eerste en tweede schil bezetten. Lithium heeft slechts één elektron in zijn buitenste schil, beryllium heeft twee elektronen, boor heeft er drie, enzovoort, totdat de hele schil is gevuld met acht elektronen, zoals het geval is bij neon.
Niet alle elementen hebben voldoende elektronen om hun buitenste schil te vullen, maar een atoom is het meest stabiel wanneer alle elektronenposities in de buitenste schil zijn gevuld. Vanwege deze lege plekken in de buitenste schillen zien we de vorming van chemische bindingen, of interacties tussen twee of meer van dezelfde of verschillende elementen die resulteren in de vorming van moleculen. Om een grotere stabiliteit te bereiken, zullen atomen de neiging hebben hun buitenste schillen volledig te vullen en zullen zij zich binden met andere elementen om dit doel te bereiken door elektronen te delen, elektronen van een ander atoom aan te nemen of elektronen aan een ander atoom af te staan. Omdat de buitenste schillen van de elementen met lage atoomnummers (tot en met calcium, met atoomnummer 20) acht elektronen kunnen bevatten, wordt dit de octetregel genoemd. Een element kan elektronen afstaan, accepteren of delen met andere elementen om zijn buitenste schil te vullen en te voldoen aan de octet-regel.

Figuur 4. Elementen hebben de neiging hun buitenste schillen te vullen met elektronen. Daartoe kunnen zij elektronen afstaan aan of aanvaarden van andere elementen.
Wanneer een atoom niet evenveel protonen als elektronen bevat, wordt het een ion genoemd. Omdat het aantal elektronen niet gelijk is aan het aantal protonen, heeft elk ion een nettolading. Positieve ionen worden gevormd door elektronen te verliezen en worden kationen genoemd. Negatieve ionen worden gevormd door het winnen van elektronen en worden anionen genoemd. De anionische namen van de elementen eindigen op -ide.
Zo heeft natrium bijvoorbeeld maar één elektron in zijn buitenste schil. Het kost natrium minder energie om dat ene elektron af te staan dan om nog zeven elektronen te accepteren om de buitenste schil te vullen. Als natrium een elektron verliest, heeft het nu 11 protonen en slechts 10 elektronen, waardoor het een totale lading van +1 heeft. Het wordt nu een natriumion genoemd.
Het chlooratoom heeft zeven elektronen in zijn buitenste schil. Ook hier is het energie-efficiënter voor chloor om één elektron te winnen dan om er zeven te verliezen. Daarom heeft het de neiging een elektron te winnen om een ion te creëren met 17 protonen en 18 elektronen, waardoor het een netto negatieve (-1) lading krijgt. Het wordt nu een chloride-ion genoemd. Deze verplaatsing van elektronen van het ene element naar het andere wordt elektronenoverdracht genoemd. Zoals figuur 4 laat zien, heeft een natriumatoom (Na) slechts één elektron in zijn buitenste schil, terwijl een chlooratoom (Cl) zeven elektronen in zijn buitenste schil heeft. Een natriumatoom zal zijn ene elektron afstaan om zijn schil te legen, en een chlooratoom zal dat elektron accepteren om zijn schil te vullen, en chloride worden. Beide ionen voldoen nu aan de octet-regel en hebben volledige buitenste schillen. Omdat het aantal elektronen niet langer gelijk is aan het aantal protonen, is elk ion nu een ion en heeft het een lading van +1 (natrium) of -1 (chloride).
Ionische bindingen
Er zijn vier soorten bindingen of interacties: ionische, covalente, waterstofbruggen, en van der Waals interacties. Ionische en covalente bindingen zijn sterke interacties die een grotere energie-input vergen om uiteen te vallen. Wanneer een element een elektron uit zijn buitenste schil afstaat, zoals in het voorbeeld van het natriumatoom hierboven, wordt een positief ion gevormd. Het element dat het elektron accepteert, is nu negatief geladen. Omdat positieve en negatieve ladingen elkaar aantrekken, blijven deze ionen bij elkaar en vormen een ionische binding, of een verbinding tussen ionen. De elementen binden zich aan elkaar waarbij het elektron van het ene element overwegend bij het andere element blijft. Wanneer Na+ en Cl- ionen zich verbinden tot NaCl, blijft een elektron van een natriumatoom bij de andere zeven van het chlooratoom, en trekken de natrium- en chloride-ionen elkaar aan in een raster van ionen met een netto nullading.
Covalente bindingen
Een ander type sterke chemische binding tussen twee of meer atomen is een covalente binding. Deze bindingen ontstaan wanneer een elektron wordt gedeeld tussen twee elementen en zijn de sterkste en meest voorkomende vorm van chemische binding in levende organismen. Covalente bindingen worden gevormd tussen de elementen waaruit de biologische moleculen in onze cellen zijn opgebouwd. In tegenstelling tot ionische bindingen, dissociëren covalente bindingen niet in water.
De waterstof- en zuurstofatomen die samen watermoleculen vormen, zijn met elkaar verbonden door covalente bindingen. Het elektron van het waterstofatoom verdeelt zijn tijd tussen de buitenste schil van het waterstofatoom en de onvolledige buitenste schil van het zuurstofatoom. Om de buitenste schil van een zuurstofatoom volledig te vullen, zijn twee elektronen van twee waterstofatomen nodig, vandaar het subscript “2” in H2O. De elektronen worden gedeeld tussen de atomen, waarbij ze hun tijd onderling verdelen om de buitenste schil van elk atoom te “vullen”. Dit delen is een lagere energietoestand voor alle betrokken atomen dan wanneer zij zouden bestaan zonder dat hun buitenste schillen gevuld zijn.
Er zijn twee soorten covalente bindingen: polaire en niet-polaire. Niet-polaire covalente bindingen ontstaan tussen twee atomen van hetzelfde element of tussen verschillende elementen die de elektronen gelijk delen. Bijvoorbeeld, een zuurstofatoom kan zich binden met een ander zuurstofatoom om hun buitenste schillen te vullen. Deze binding is apolair omdat de elektronen gelijkelijk over elk zuurstofatoom worden verdeeld. Er ontstaan twee covalente bindingen tussen de twee zuurstofatomen omdat zuurstof twee gedeelde elektronen nodig heeft om zijn buitenste schil te vullen. Stikstofatomen vormen drie covalente bindingen (ook wel drievoudige covalente genoemd) tussen twee stikstofatomen omdat elk stikstofatoom drie elektronen nodig heeft om zijn buitenste schil te vullen. Een ander voorbeeld van een apolaire covalente binding is te vinden in het methaanmolecuul (CH4). Het koolstofatoom heeft vier elektronen in zijn buitenste schil en heeft er nog vier nodig om die te vullen. Het krijgt deze vier van vier waterstofatomen, waarbij elk atoom er een levert. Deze elementen delen de elektronen gelijkelijk, waardoor vier apolaire covalente bindingen ontstaan (figuur 5).
In een polaire covalente binding brengen de door de atomen gedeelde elektronen meer tijd door dichter bij de ene atoomkern dan bij de andere atoomkern. Door de ongelijke verdeling van de elektronen tussen de verschillende kernen ontstaat een licht positieve (δ+) of licht negatieve (δ-) lading. De covalente bindingen tussen waterstof- en zuurstofatomen in water zijn polaire covalente bindingen. De gedeelde elektronen brengen meer tijd door in de buurt van de zuurstofkern, waardoor deze een kleine negatieve lading krijgt, dan in de buurt van de waterstofkernen, waardoor deze moleculen een kleine positieve lading krijgen.

Figuur 5. De watermolecule (links) toont een polaire binding met een licht positieve lading op de waterstofatomen en een licht negatieve lading op de zuurstof. Voorbeelden van apolaire bindingen zijn methaan (midden) en zuurstof (rechts).
Hydrogeenbindingen
Ionische en covalente bindingen zijn sterke bindingen die veel energie vergen om te verbreken. Maar niet alle bindingen tussen elementen zijn ionische of covalente bindingen. Er kunnen ook zwakkere bindingen ontstaan. Dit zijn bindingen die ontstaan tussen positieve en negatieve ladingen en die niet veel energie nodig hebben om te breken. Twee zwakke bindingen die vaak voorkomen zijn waterstofbruggen en van der Waals interacties. Deze bindingen geven aanleiding tot de unieke eigenschappen van water en de unieke structuren van DNA en eiwitten.
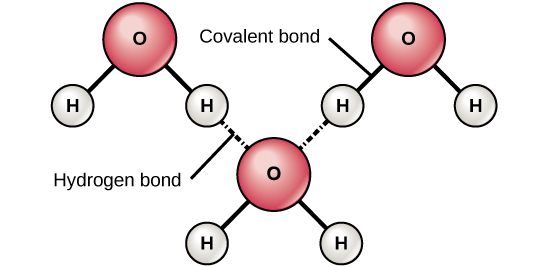
Figuur 6. Waterstofbruggen vormen zich tussen licht positieve (δ+) en licht negatieve (δ-) ladingen van polaire covalente moleculen, zoals water.
Wanneer polaire covalente bindingen worden gevormd die een waterstofatoom bevatten, heeft het waterstofatoom in die binding een licht positieve lading. Dit komt omdat het gedeelde elektron sterker naar het andere element wordt getrokken en weg van de waterstofkern. Omdat het waterstofatoom licht positief is (δ+), zal het worden aangetrokken door naburige negatieve partiële ladingen (δ-). Wanneer dit gebeurt, ontstaat er een zwakke wisselwerking tussen de δ+ lading van het waterstofatoom van het ene molecuul en de δ- lading van het andere molecuul. Deze interactie wordt een waterstofbrug genoemd. Dit type binding komt vaak voor; het vloeibare karakter van water wordt bijvoorbeeld veroorzaakt door de waterstofbruggen tussen watermoleculen (figuur 6). Waterstofbruggen geven water de unieke eigenschappen die het leven in stand houden. Zonder waterstofbruggen zou water bij kamertemperatuur een gas zijn in plaats van een vloeistof.
Waterstofbruggen kunnen zich vormen tussen verschillende moleculen en ze hoeven niet altijd een watermolecuul te omvatten. Waterstofatomen in polaire bindingen binnen een molecuul kunnen bindingen vormen met andere aangrenzende moleculen. Zo houden waterstofbruggen twee lange DNA-strengen bij elkaar om het DNA-molecuul zijn karakteristieke dubbelstrengsstructuur te geven. Waterstofbruggen zijn ook verantwoordelijk voor een deel van de driedimensionale structuur van eiwitten.
van der Waals Interacties
Zoals waterstofbruggen, zijn van der Waals interacties zwakke aantrekkingen of interacties tussen moleculen. Zij komen voor tussen polaire, covalent gebonden, atomen in verschillende moleculen. Sommige van deze zwakke aantrekkingen worden veroorzaakt door tijdelijke partiële ladingen die worden gevormd wanneer elektronen rond een kern bewegen. Deze zwakke interacties tussen moleculen zijn belangrijk in biologische systemen.
Sectiesamenvatting
Materie is alles wat ruimte inneemt en massa heeft. Het is opgebouwd uit atomen van verschillende elementen. Alle 92 elementen die in de natuur voorkomen, hebben unieke eigenschappen waardoor ze op verschillende manieren kunnen worden gecombineerd tot verbindingen of moleculen. Atomen, die bestaan uit protonen, neutronen en elektronen, zijn de kleinste eenheden van een element die alle eigenschappen van dat element behouden. Elektronen kunnen worden afgestaan of gedeeld tussen atomen om bindingen te creëren, met inbegrip van ionische, covalente en waterstofbruggen, evenals van der Waals interacties.
Aanvullende zelfcontrole-oefeningen
1. Kijk naar figuur 2: hoeveel neutronen hebben (K) kalium-39 en kalium-40 respectievelijk?
2. Waarom zijn waterstofbruggen en van der Waals interacties noodzakelijk voor cellen?
Antwoorden
1. Kalium-39 heeft twintig neutronen. Kalium-40 heeft eenentwintig neutronen.
2. Waterstofbruggen en van der Waals interacties vormen zwakke associaties tussen verschillende moleculen. Zij zorgen voor de structuur en vorm die nodig zijn voor eiwitten en DNA in cellen, zodat deze goed functioneren. Waterstofbruggen geven water ook zijn unieke eigenschappen, die nodig zijn voor het leven.