N2O(亜酸化窒素)は窒素の酸化物で、笑気ガスと呼ばれるものである。
- N2Oのルイス構造の描き方
- ルイス構造に続く共鳴構造の描き方
- 窒素原子と酸素原子の酸化数について説明します。
すでにN2Oのルイス構造を知っている場合は、このチュートリアルの最初のセクションをスキップして、直接ルイス構造のパートに進むことができます。
N2Oのルイス構造
N2Oのルイス構造を描くにはいくつかのステップを踏まなければなりません。
価電子数
まず、酸素原子と窒素原子の価電子がいくつあれば分子ができるかを知っておく必要があります。
窒素原子の価電子数=5
N2O分子の窒素原子数=2
窒素原子が与える電子数=5*2=10
酸素原子の価電子数=6
すべての電子が与える合計電子数 10 + 6 = 16
反発する電子の数(σ+π+価電子対の和) = 16/2 = 8
N2Oの中心原子
通常窒素原子は酸素原子より高い価数を示せるので、中心原子になる確率は最も高いと言えますが、N2Oは酸素原子の中心原子として、また、NO3は窒素原子の中心原子を示します。
つまり、窒素原子の1つを中心原子として、その周りに他の原子が配置されるわけです。
原子の電荷
分子を描くとき、原子の電荷が少ないと分子が安定するので、原子の電荷を最小限にするように注意しなければならない。
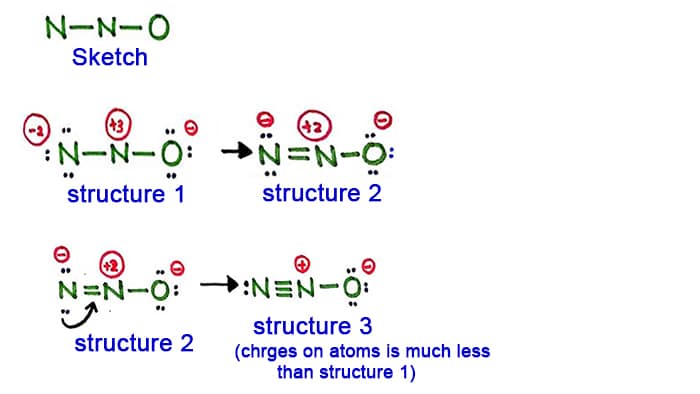
構造1
構造1を見ると、N2O分子のすべての原子に正と電荷があることがわかります。 だからこの構造は安定な構造とは思えない。
側面の窒素原子(中央の窒素原子ではない)の単独対を変換して新しい結合を作ります。
構造2
左側の窒素原子の長い対が窒素原子の間に結合を形成するようになりました。 つまり、今、窒素原子の間に二重結合があるのです。 これによって、原子の電荷密度は減少します。
しかし、まだ原子に電荷があることがわかります。
Structure 3
窒素原子(左側)のもう一つの長対は、窒素原子間の結合を形成するようになりました。
この構造では、原子の電荷がさらに減少します。
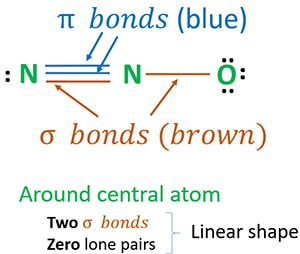
構造3は、N2Oの構造として最も安定なものです。 中心原子の周りに
- 2つのシグマ(σ)結合
- ゼロ孤立対
N2O分子の中心原子周りの形
N2O分子には2つの窒素原子と一つの酸素原子が含まれています。
分子の形を決めるには、中心原子の周りの孤立対の数とσ結合の数が重要である。
N2Oの形状は、中心原子(窒素)の周りに2つのシグマ結合とゼロの孤立対があるため、線形です。
N2O共鳴構造を描き、N2Oの最も安定な構造を特定することができます。 N2Oの窒素の酸化数は最も安定な構造から決定される。
N2O 共鳴構造
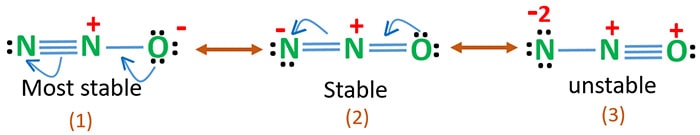
酸素の電気陰性度は窒素より高いです。 これは、酸素原子の負の電荷は、窒素原子の負の電荷よりも安定であることを意味します。 つまり、酸素は窒素よりも電子を好むということです。
構造3は酸素原子に正の電荷があるため、N2Oの最も不安定な共鳴となります。
構造2はある程度安定している。
構造1は酸素が負の電荷を持っているため、最も安定な共鳴です。
N2Oの酸化状態、数
最も安定な共鳴構造について、N2Oの酸化状態を計算することができます。 しかし、現実には1つの窒素原子が+2酸化状態、もう1つの窒素原子が0酸化状態である。 酸素の酸化数は-2です。
式より酸化数
ほとんどの場合、酸素の酸化数は-2であることがわかります。 N2Oには窒素原子が2つ入っています。 窒素の酸化数をxとすると、N2O分子の全体の電荷は0です。
分子内の各元素の酸化数のいくつかは0に等しいはずです。