Az N2O (dinitrogén-oxid) a nitrogén oxidja, amelyet nevetőgáznak is neveznek. Ebben a tananyagban a következőket fogjuk megtanulni a dinitrogén-oxid gázról.
- Hogyan rajzoljuk meg az N2O lewis szerkezetét
- Rezonancia szerkezetek rajzolása a lewis szerkezetet követve
- A nitrogén és oxigén atomok oxidációs számai.
Ha már ismered az N2O lewis szerkezetét, akkor átugorhatod a bemutató első részét, és közvetlenül a lewis szerkezet részhez léphetsz.
N2O lewis szerkezete
Az N2O lewis szerkezetének megrajzolásához több lépést kell követni. ezek mindegyikét részletesen elmagyarázzuk ebben az oktatóanyagban, és egy kezdő is megtanulhatja a lewis szerkezet megrajzolásának alapjait.
Valenciahéj elektronjainak száma
Először is tudnunk kell, hogy az oxigén- és a nitrogénatomok valenciahéjainak hány elektronját kapjuk a molekula kialakításához.
A nitrogénatom valenciahéjának elektronjainak száma = 5
A nitrogénatomok száma az N2O molekulában = 2
A nitrogénatomok által adott elektronok száma = 5*2 = 10
Az oxigénatom valenciahéjának elektronjainak száma = 6
Az összes elektron által adott elektronok száma. atomok = 10 + 6 = 16
A teljes elektron taszító párok száma (σ + π + magányos párok összege a valenciahéjakban) = 16/2 = 8
A N2O központi atomja
A nitrogénatomnak van a legnagyobb esélye arra, hogy központi atom legyen, mint az oxigénatomnak, mert a nitrogén magas valenciát tud felmutatni, mint az oxigén.
Az egyik nitrogénatom tehát központi atomként helyezkedik el, a többi atom pedig körülötte. Most elképzelhetjük az N2O vázlatát, és az alábbi ábrán látható.
Az atomok töltései
Amikor egy molekulát rajzolunk, mindig ügyelnünk kell arra, hogy az atomok töltéseit minimalizáljuk, mert ha az atomok töltései alacsonyak, akkor a molekula stabilitása nagy.
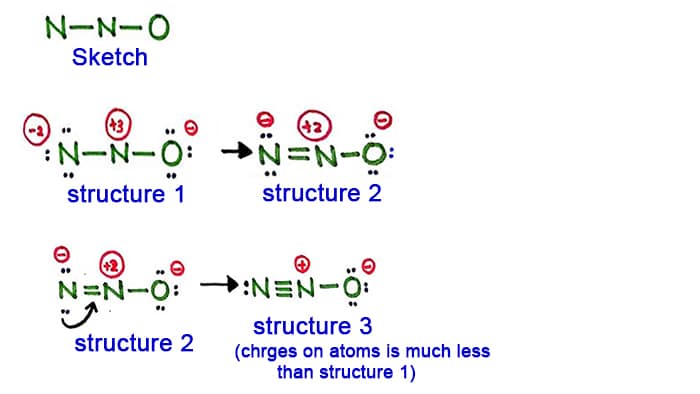
Szerkezet 1
Nézzük az 1. szerkezetet, az N2O molekulában minden atomon pozitív és töltés van. Tehát ez a szerkezet nem tűnik stabil szerkezetnek. Ezért meg kell próbálnunk egy másik szerkezetet rajzolni az 1. szerkezet megváltoztatásával.
Készítsünk egy új kötést úgy, hogy a nitrogénatomban oldalt (nem a középső nitrogénatomban) egy magányos párt alakítunk át.
2. szerkezet
A nitrogénatomban (bal oldalon) most egy hosszú pár okoz kötést a nitrogénatomok között. Így most már kettős kötés van a nitrogénatomok között. Ezzel az atomokon lévő töltések sűrűsége csökken.
De, láthatjuk, még mindig vannak töltések az atomokon. Próbáljunk meg tehát egy másik szerkezetet az N2O-nak, hogy csökkentsük a töltések sűrűségét, ha ez lehetséges.
3. szerkezet
A nitrogénatomban (bal oldalon) most egy másik hosszú pár okoz kötést a nitrogénatomok között. Így most már hármas kötés van a nitrogénatomok között.
Ebben a szerkezetben az atomok töltései tovább csökkennek. Most a középső nitrogénatomnak csak +1 töltése van, az oxigénatomnak pedig -1 töltése.
A 3. szerkezet a legjobb (legstabilabb) szerkezet, amit az N2O-ra rajzolhatunk. A központi atomja körül
- két szigma (σ) kötés
- nulla magányos pár
A N2O molekula alakja a központi atom körül
A N2O molekula két nitrogénatomot és egy oxigénatomot tartalmaz. Először meg kell próbálnunk megrajzolni az N2O legstabilabb lewis szerkezetét, hogy eldöntsük az N2O molekula alakját.
A magányos párok száma és a σ kötések száma a központi atom körül fontos a molekula alakjának megállapításához.
A két szigma kötés és a központi atom (nitrogén) körüli nulla magányos pár miatt az N2O molekula alakja lineáris.
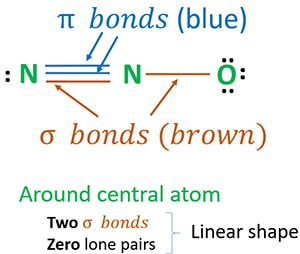
Az N2O legstabilabb szerkezetének meghatározásához N2O rezonancia szerkezeteket rajzolhatunk. A nitrogén oxidációs számait az N2O-ban a legstabilabb szerkezetek alapján döntjük el. Végül felépítjük az N2O molekula alakját.
N2O rezonancia szerkezetek
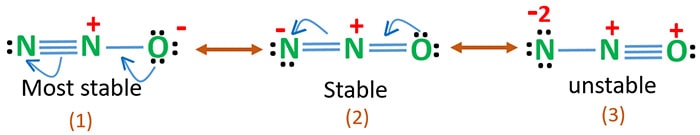
Az oxigén elektronegativitása nagyobb, mint a nitrogéné. Ez azt jelenti, hogy az oxigénatom negatív töltése stabilabb, mint a nitrogénatom negatív töltése. Egyébként mondhatjuk, hogy az oxigén jobban szereti az elektronokat, mint a nitrogén.
A 3. szerkezet az N2O leginstabilabb rezonanciája, mert az oxigénatomon pozitív töltés van.
A 2-es szerkezetnek van némi stabilitása.
Az 1. szerkezet a legstabilabb rezonancia, mert az oxigén negatív töltéssel rendelkezik.
N2O oxidációs állapotai, számai
A legstabilabb rezonancia szerkezethez kiszámíthatjuk az N2O oxidációs állapotát.
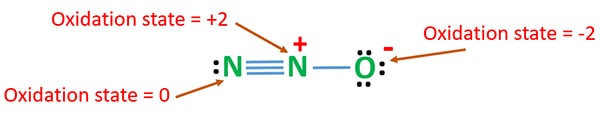
N2O oxidációs állapota
Az N2O-ban lévő nitrogén oxidációs száma +1. A valóságban azonban az egyik nitrogénatom +2 oxidációs állapotú, a másik nitrogénatom pedig 0 oxidációs állapotú. Az oxigén oxidációs száma -2.
Oxidációs szám az egyenletből
A legtöbb esetben tudjuk, hogy az oxigén oxidációs száma -2. Az N2O-ban két nitrogénatom van. Vegyük a nitrogén oxidációs számát x-nek. Az N2O molekula teljes töltése 0.
A molekula egyes elemeinek oxidációs számai közül néhánynak meg kell egyeznie a nullával.