Lernziele
Am Ende dieses Abschnitts werden Sie in der Lage sein:
- Beschreiben Sie die Materie und die Elemente
- Beschreiben Sie die Beziehung zwischen Protonen, Neutronen und Elektronen und die Art und Weise, wie Elektronen zwischen Atomen gespendet oder geteilt werden können
Auf seiner grundlegendsten Ebene besteht das Leben aus Materie. Materie nimmt Raum ein und hat Masse. Alle Materie besteht aus Elementen, Substanzen, die nicht aufgespalten oder chemisch in andere Substanzen umgewandelt werden können. Jedes Element besteht aus Atomen, von denen jedes eine konstante Anzahl von Protonen und einzigartige Eigenschaften besitzt. Es wurden insgesamt 118 Elemente definiert, von denen jedoch nur 92 in der Natur vorkommen und weniger als 30 in lebenden Zellen zu finden sind. Die restlichen 26 Elemente sind instabil und existieren daher nicht sehr lange oder sind theoretisch und müssen erst noch entdeckt werden.
Jedes Element wird durch sein chemisches Symbol bezeichnet (z. B. H, N, O, C und Na) und besitzt einzigartige Eigenschaften. Diese einzigartigen Eigenschaften ermöglichen es den Elementen, sich auf bestimmte Weise zu kombinieren und miteinander zu verbinden.
Atome
Ein Atom ist der kleinste Bestandteil eines Elements, der alle chemischen Eigenschaften dieses Elements besitzt. Ein Wasserstoffatom hat zum Beispiel alle Eigenschaften des Elements Wasserstoff, d.h. es existiert bei Raumtemperatur als Gas und verbindet sich mit Sauerstoff zu einem Wassermolekül. Wasserstoffatome können nicht in etwas Kleineres zerlegt werden, ohne dass die Eigenschaften des Wasserstoffs beeinträchtigt werden. Würde man ein Wasserstoffatom in subatomare Teilchen zerlegen, hätte es nicht mehr die Eigenschaften von Wasserstoff.
Auf der grundlegendsten Ebene sind alle Organismen aus einer Kombination von Elementen aufgebaut. Sie enthalten Atome, die sich zu Molekülen verbinden. In mehrzelligen Organismen, wie z. B. Tieren, können Moleküle miteinander interagieren, um Zellen zu bilden, die sich zu Geweben zusammenschließen, aus denen sich Organe bilden. Diese Kombinationen setzen sich fort, bis ganze mehrzellige Organismen gebildet werden.

Abbildung 1. Atome bestehen aus Protonen und Neutronen, die sich im Kern befinden, und Elektronen, die den Kern umgeben.
Alle Atome enthalten Protonen, Elektronen und Neutronen (Abbildung 1). Die einzige Ausnahme ist Wasserstoff (H), der aus einem Proton und einem Elektron besteht. Ein Proton ist ein positiv geladenes Teilchen, das sich im Kern eines Atoms befindet und eine Masse von 1 und eine Ladung von +1 hat. Ein Elektron ist ein negativ geladenes Teilchen, das sich in der Umgebung des Kerns bewegt. Mit anderen Worten, es befindet sich außerhalb des Kerns. Es hat eine vernachlässigbare Masse und eine Ladung von -1.
Neutronen befinden sich wie Protonen im Kern eines Atoms. Sie haben eine Masse von 1 und keine Ladung. Die positiven (Protonen) und negativen (Elektronen) Ladungen gleichen sich in einem neutralen Atom aus, das eine Nettoladung von Null hat.
Da Protonen und Neutronen jeweils eine Masse von 1 haben, ist die Masse eines Atoms gleich der Anzahl der Protonen und Neutronen dieses Atoms. Die Anzahl der Elektronen spielt bei der Gesamtmasse keine Rolle, weil ihre Masse so gering ist.
Wie bereits erwähnt, hat jedes Element seine eigenen einzigartigen Eigenschaften. Jedes Element enthält eine unterschiedliche Anzahl von Protonen und Neutronen, wodurch es seine eigene Ordnungszahl und Massenzahl erhält. Die Ordnungszahl eines Elements ist gleich der Anzahl der Protonen, die das Element enthält. Die Massenzahl ist die Anzahl der Protonen plus die Anzahl der Neutronen des Elements. Daher ist es möglich, die Anzahl der Neutronen zu bestimmen, indem man die Ordnungszahl von der Massenzahl subtrahiert.
Diese Zahlen geben Auskunft über die Elemente und darüber, wie sie reagieren, wenn sie kombiniert werden. Verschiedene Elemente haben unterschiedliche Schmelz- und Siedepunkte und befinden sich bei Raumtemperatur in unterschiedlichen Zuständen (flüssig, fest oder gasförmig). Sie verbinden sich auch auf unterschiedliche Weise. Einige bilden bestimmte Arten von Bindungen, andere nicht. Wie sie sich verbinden, hängt von der Anzahl der vorhandenen Elektronen ab. Aufgrund dieser Eigenschaften sind die Elemente im Periodensystem der Elemente angeordnet, einer Tabelle der Elemente, die die Ordnungszahl und die relative Atommasse jedes Elements enthält. Das Periodensystem enthält auch wichtige Informationen über die Eigenschaften der Elemente (Abbildung 2), die häufig durch eine farbliche Kennzeichnung angegeben werden. Die Anordnung des Periodensystems zeigt auch, wie die Elektronen in jedem Element angeordnet sind, und liefert wichtige Details darüber, wie Atome miteinander reagieren, um Moleküle zu bilden.
Isotope sind verschiedene Formen desselben Elements, die die gleiche Anzahl von Protonen, aber eine unterschiedliche Anzahl von Neutronen haben. Einige Elemente, wie z. B. Kohlenstoff, Kalium und Uran, haben natürlich vorkommende Isotope. Kohlenstoff-12, das häufigste Isotop von Kohlenstoff, enthält sechs Protonen und sechs Neutronen. Daher hat es eine Massenzahl von 12 (sechs Protonen und sechs Neutronen) und eine Ordnungszahl von 6 (was es zu Kohlenstoff macht). Kohlenstoff-14 enthält sechs Protonen und acht Neutronen. Daher hat es eine Massenzahl von 14 (sechs Protonen und acht Neutronen) und eine Ordnungszahl von 6, d. h. es ist immer noch das Element Kohlenstoff. Diese beiden alternativen Formen des Kohlenstoffs sind Isotope. Einige Isotope sind instabil und verlieren Protonen, andere subatomare Teilchen oder Energie, um stabilere Elemente zu bilden. Diese werden radioaktive Isotope oder Radioisotope genannt.
Art Connection

Abbildung 2. Das Periodensystem ist nach den Eigenschaften der Elemente in Spalten und Zeilen geordnet und liefert wichtige Informationen über die Elemente und darüber, wie sie miteinander interagieren und Moleküle bilden können. Die meisten Periodensysteme enthalten einen Schlüssel oder eine Legende zu den enthaltenen Informationen.
Wie viele Neutronen haben (K) Kalium-39 bzw. Kalium-40?
Evolution in Aktion
Kohlenstoffdatierung

Abbildung 3. Das Alter von kohlenstoffhaltigen Überresten, die weniger als 50.000 Jahre alt sind, wie z. B. dieses Pygmäenmammut, kann mit Hilfe der Kohlenstoffdatierung bestimmt werden. (credit: Bill Faulkner/NPS)
Kohlenstoff-14 (14C) ist ein natürlich vorkommendes Radioisotop, das in der Atmosphäre durch kosmische Strahlung erzeugt wird. Dies ist ein kontinuierlicher Prozess, so dass immer mehr 14C erzeugt wird. Wenn sich ein lebender Organismus entwickelt, entspricht der relative Gehalt an 14C in seinem Körper der 14C-Konzentration in der Atmosphäre. Wenn ein Organismus stirbt, nimmt er kein 14C mehr auf, so dass das Verhältnis abnimmt. 14C zerfällt durch den so genannten Betazerfall in 14N; bei diesem langsamen Prozess wird Energie freigesetzt.
Nach etwa 5.730 Jahren ist nur noch die Hälfte der Ausgangskonzentration von 14C in 14N umgewandelt worden. Die Zeit, die vergeht, bis die Hälfte der ursprünglichen Konzentration eines Isotops in seine stabilere Form zerfallen ist, wird als Halbwertszeit bezeichnet. Da die Halbwertszeit von 14C lang ist, wird es zur Altersbestimmung von ehemals lebenden Objekten, wie z. B. Fossilien, verwendet. Anhand des Verhältnisses zwischen der in einem Objekt gefundenen 14C-Konzentration und der in der Atmosphäre nachgewiesenen 14C-Menge kann die Menge des Isotops bestimmt werden, die noch nicht zerfallen ist. Anhand dieser Menge lässt sich das Alter des Fossils auf etwa 50.000 Jahre berechnen (Abbildung 3). Isotope mit längeren Halbwertszeiten, wie Kalium-40, werden zur Berechnung des Alters älterer Fossilien verwendet. Mithilfe der Kohlenstoffdatierung können Wissenschaftler die Ökologie und Biogeografie von Organismen rekonstruieren, die in den letzten 50 000 Jahren gelebt haben.
Konzept in Aktion
In dieser Simulation erfährst du mehr über Atome und Isotope und wie du ein Isotop von einem anderen unterscheiden kannst.
Chemische Bindungen
Wie Elemente miteinander interagieren, hängt davon ab, wie ihre Elektronen angeordnet sind und wie viele Öffnungen für Elektronen im äußersten Bereich eines Atoms vorhanden sind. Die Elektronen befinden sich auf Energieniveaus, die Schalen um den Kern bilden. Die nächstgelegene Schale kann bis zu zwei Elektronen aufnehmen. Die dem Kern am nächsten liegende Schale wird immer zuerst gefüllt, bevor eine andere Schale gefüllt werden kann. Wasserstoff hat ein Elektron; daher ist nur ein Platz in der untersten Schale besetzt. Helium hat zwei Elektronen und kann daher die unterste Schale mit seinen beiden Elektronen vollständig ausfüllen. Wenn du dir das Periodensystem ansiehst, wirst du feststellen, dass Wasserstoff und Helium die einzigen beiden Elemente in der ersten Reihe sind. Das liegt daran, dass sie nur in ihrer ersten Schale Elektronen haben. Wasserstoff und Helium sind die einzigen beiden Elemente, die die unterste Schale und keine weiteren Schalen haben.
Das zweite und dritte Energieniveau kann bis zu acht Elektronen enthalten. Die acht Elektronen sind in vier Paaren angeordnet, und eine Position in jedem Paar wird mit einem Elektron besetzt, bevor die Paare vervollständigt werden.
Wenn Sie sich das Periodensystem noch einmal ansehen (Abbildung 2), werden Sie feststellen, dass es sieben Reihen gibt. Diese Reihen entsprechen der Anzahl der Schalen, die die Elemente in der jeweiligen Reihe haben. Die Elemente in einer bestimmten Reihe haben eine zunehmende Anzahl von Elektronen, wenn die Spalten von links nach rechts verlaufen. Obwohl jedes Element die gleiche Anzahl von Schalen hat, sind nicht alle Schalen vollständig mit Elektronen gefüllt. In der zweiten Reihe des Periodensystems finden Sie Lithium (Li), Beryllium (Be), Bor (B), Kohlenstoff (C), Stickstoff (N), Sauerstoff (O), Fluor (F) und Neon (Ne). Sie alle haben Elektronen, die nur die erste und zweite Schale besetzen. Lithium hat nur ein Elektron in seiner äußersten Schale, Beryllium hat zwei Elektronen, Bor hat drei und so weiter, bis die gesamte Schale mit acht Elektronen gefüllt ist, wie es bei Neon der Fall ist.
Nicht alle Elemente haben genügend Elektronen, um ihre äußersten Schalen zu füllen, aber ein Atom ist am stabilsten, wenn alle Elektronenpositionen in der äußersten Schale besetzt sind. Aufgrund dieser freien Plätze in den äußersten Schalen kommt es zur Bildung chemischer Bindungen oder zu Wechselwirkungen zwischen zwei oder mehr gleichen oder verschiedenen Elementen, die zur Bildung von Molekülen führen. Um eine größere Stabilität zu erreichen, neigen Atome dazu, ihre äußeren Schalen vollständig auszufüllen und sich mit anderen Elementen zu verbinden, um dieses Ziel zu erreichen, indem sie Elektronen teilen, Elektronen von einem anderen Atom aufnehmen oder einem anderen Atom Elektronen spenden. Da die äußersten Schalen der Elemente mit niedriger Ordnungszahl (bis hin zu Kalzium mit der Ordnungszahl 20) acht Elektronen aufnehmen können, wird dies als Oktettregel bezeichnet. Ein Element kann Elektronen abgeben, aufnehmen oder mit anderen Elementen teilen, um seine äußere Schale zu füllen und die Oktettregel zu erfüllen.

Abbildung 4. Elemente neigen dazu, ihre äußersten Schalen mit Elektronen aufzufüllen. Dazu können sie entweder Elektronen von anderen Elementen abgeben oder aufnehmen.
Wenn ein Atom nicht die gleiche Anzahl von Protonen und Elektronen enthält, nennt man es ein Ion. Da die Anzahl der Elektronen nicht gleich der Anzahl der Protonen ist, hat jedes Ion eine Nettoladung. Positive Ionen werden durch den Verlust von Elektronen gebildet und werden Kationen genannt. Negative Ionen werden durch die Aufnahme von Elektronen gebildet und werden Anionen genannt. Die Namen der anionischen Elemente enden auf -ide.
Natrium zum Beispiel hat nur ein Elektron in seiner äußersten Schale. Es kostet Natrium weniger Energie, dieses eine Elektron abzugeben, als sieben weitere Elektronen aufzunehmen, um die äußere Schale zu füllen. Wenn Natrium ein Elektron verliert, hat es nun 11 Protonen und nur 10 Elektronen, so dass es eine Gesamtladung von +1 hat. Es wird nun als Natriumion bezeichnet.
Das Chloratom hat sieben Elektronen in seiner äußeren Schale. Auch hier ist es für Chlor energieeffizienter, ein Elektron zu gewinnen als sieben zu verlieren. Daher neigt es dazu, ein Elektron zu gewinnen, um ein Ion mit 17 Protonen und 18 Elektronen zu bilden, was ihm eine negative Nettoladung (-1) verleiht. Es wird nun als Chloridion bezeichnet. Diese Bewegung von Elektronen von einem Element zum anderen wird als Elektronentransfer bezeichnet. Wie Abbildung 4 zeigt, hat ein Natriumatom (Na) nur ein Elektron in seiner äußersten Schale, während ein Chloratom (Cl) sieben Elektronen in seiner äußersten Schale hat. Ein Natriumatom gibt ein Elektron ab, um seine Schale zu leeren, und ein Chloratom nimmt dieses Elektron an, um seine Schale aufzufüllen und Chlorid zu bilden. Beide Ionen erfüllen nun die Oktettregel und haben vollständige äußere Schalen. Da die Anzahl der Elektronen nicht mehr gleich der Anzahl der Protonen ist, sind sie nun Ionen und haben eine Ladung von +1 (Natrium) oder -1 (Chlorid).
Ionische Bindungen
Es gibt vier Arten von Bindungen oder Wechselwirkungen: ionische, kovalente, Wasserstoffbrücken und van-der-Waals-Wechselwirkungen. Ionische und kovalente Bindungen sind starke Wechselwirkungen, die einen größeren Energieaufwand erfordern, um aufgebrochen zu werden. Wenn ein Element ein Elektron aus seiner äußeren Schale abgibt, wie im obigen Beispiel des Natriumatoms, wird ein positives Ion gebildet. Das Element, das das Elektron aufnimmt, ist nun negativ geladen. Da sich positive und negative Ladungen anziehen, bleiben diese Ionen zusammen und bilden eine Ionenbindung oder eine Bindung zwischen Ionen. Die Elemente binden sich aneinander, wobei das Elektron des einen Elements überwiegend beim anderen Element verbleibt. Wenn sich Na+- und Cl- Ionen zu NaCl verbinden, bleibt ein Elektron des Natriumatoms bei den anderen sieben des Chloratoms, und die Natrium- und Chloridionen ziehen sich gegenseitig in einem Ionengitter mit einer Nettoladung von Null an.
Kovalente Bindungen
Eine andere Art von starker chemischer Bindung zwischen zwei oder mehr Atomen ist eine kovalente Bindung. Diese Bindungen entstehen, wenn ein Elektron zwischen zwei Elementen geteilt wird, und sind die stärkste und häufigste Form der chemischen Bindung in lebenden Organismen. Kovalente Bindungen entstehen zwischen den Elementen, aus denen die biologischen Moleküle in unseren Zellen bestehen. Anders als Ionenbindungen dissoziieren kovalente Bindungen nicht in Wasser.
Die Wasserstoff- und Sauerstoffatome, die sich zu Wassermolekülen verbinden, sind durch kovalente Bindungen miteinander verbunden. Das Elektron des Wasserstoffatoms teilt seine Zeit zwischen der äußeren Schale des Wasserstoffatoms und der unvollständigen äußeren Schale des Sauerstoffatoms auf. Um die äußere Schale eines Sauerstoffatoms vollständig aufzufüllen, werden zwei Elektronen von zwei Wasserstoffatomen benötigt, daher der tiefgestellte Index „2“ in H2O. Die Elektronen werden zwischen den Atomen aufgeteilt, um die äußere Schale jedes Atoms zu „füllen“. Diese gemeinsame Nutzung stellt für alle beteiligten Atome einen niedrigeren Energiezustand dar, als wenn sie ohne gefüllte Außenschalen existieren würden.
Es gibt zwei Arten von kovalenten Bindungen: polare und unpolare. Unpolare kovalente Bindungen entstehen zwischen zwei Atomen desselben Elements oder zwischen verschiedenen Elementen, die sich die Elektronen gleichmäßig teilen. So kann sich beispielsweise ein Sauerstoffatom mit einem anderen Sauerstoffatom verbinden, um deren äußere Schalen aufzufüllen. Diese Verbindung ist unpolar, da die Elektronen gleichmäßig zwischen den einzelnen Sauerstoffatomen verteilt sind. Zwischen den beiden Sauerstoffatomen bilden sich zwei kovalente Bindungen, da Sauerstoff zwei gemeinsame Elektronen benötigt, um seine äußerste Schale zu füllen. Stickstoffatome bilden drei kovalente Bindungen (auch dreifach kovalent genannt) zwischen zwei Stickstoffatomen, da jedes Stickstoffatom drei Elektronen benötigt, um seine äußerste Schale zu füllen. Ein weiteres Beispiel für eine unpolare kovalente Bindung findet sich im Methanmolekül (CH4). Das Kohlenstoffatom hat vier Elektronen in seiner äußersten Schale und benötigt vier weitere, um sie zu füllen. Diese vier erhält es von vier Wasserstoffatomen, wobei jedes Atom eines zur Verfügung stellt. Diese Elemente teilen sich die Elektronen gleichmäßig, wodurch vier unpolare kovalente Bindungen entstehen (Abbildung 5).
In einer polaren kovalenten Bindung halten sich die von den Atomen gemeinsam genutzten Elektronen näher an einem Kern auf als an dem anderen Kern. Durch die ungleiche Verteilung der Elektronen auf die verschiedenen Kerne entsteht eine leicht positive (δ+) oder leicht negative (δ-) Ladung. Die kovalenten Bindungen zwischen Wasserstoff- und Sauerstoffatomen in Wasser sind polare kovalente Bindungen. Die gemeinsam genutzten Elektronen halten sich länger in der Nähe des Sauerstoffkerns auf, was diesem eine kleine negative Ladung verleiht, als in der Nähe der Wasserstoffkerne, was diesen Molekülen eine kleine positive Ladung verleiht.

Abbildung 5. Das Wassermolekül (links) zeigt eine polare Bindung mit einer leicht positiven Ladung der Wasserstoffatome und einer leicht negativen Ladung des Sauerstoffs. Beispiele für unpolare Bindungen sind Methan (Mitte) und Sauerstoff (rechts).
Wasserstoffbindungen
Ionische und kovalente Bindungen sind starke Bindungen, deren Bruch erhebliche Energie erfordert. Aber nicht alle Bindungen zwischen Elementen sind ionische oder kovalente Bindungen. Es können auch schwächere Bindungen entstehen. Dabei handelt es sich um Anziehungskräfte zwischen positiven und negativen Ladungen, für deren Auflösung nicht viel Energie erforderlich ist. Zwei häufig auftretende schwache Bindungen sind Wasserstoffbrücken und van-der-Waals-Wechselwirkungen. Diese Bindungen führen zu den einzigartigen Eigenschaften von Wasser und den einzigartigen Strukturen von DNA und Proteinen.
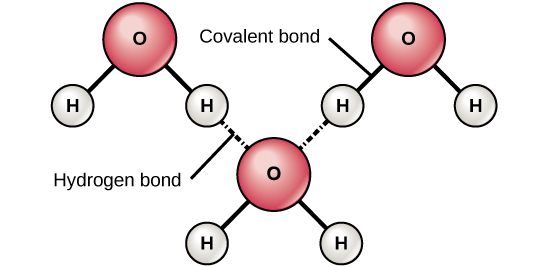
Abbildung 6. Wasserstoffbrückenbindungen bilden sich zwischen leicht positiven (δ+) und leicht negativen (δ-) Ladungen polarer kovalenter Moleküle, wie z. B. Wasser.
Wenn polare kovalente Bindungen, die ein Wasserstoffatom enthalten, entstehen, hat das Wasserstoffatom in dieser Bindung eine leicht positive Ladung. Das liegt daran, dass das gemeinsame Elektron stärker zum anderen Element und vom Wasserstoffkern weg gezogen wird. Da das Wasserstoffatom leicht positiv ist (δ+), wird es von benachbarten negativen Teilladungen (δ-) angezogen. In diesem Fall kommt es zu einer schwachen Wechselwirkung zwischen der δ+-Ladung des Wasserstoffatoms des einen Moleküls und der δ–Ladung des anderen Moleküls. Diese Wechselwirkung wird als Wasserstoffbrückenbindung bezeichnet. Diese Art von Bindung ist weit verbreitet; so ist beispielsweise die flüssige Beschaffenheit von Wasser auf die Wasserstoffbrücken zwischen den Wassermolekülen zurückzuführen (Abbildung 6). Wasserstoffbrücken verleihen dem Wasser die einzigartigen Eigenschaften, die das Leben erhalten. Ohne Wasserstoffbrückenbindungen wäre Wasser bei Raumtemperatur eher ein Gas als eine Flüssigkeit.
Wasserstoffbrücken können sich zwischen verschiedenen Molekülen bilden, und sie müssen nicht immer ein Wassermolekül einschließen. Wasserstoffatome in polaren Bindungen innerhalb eines beliebigen Moleküls können Bindungen mit anderen benachbarten Molekülen eingehen. So halten beispielsweise Wasserstoffbrücken zwei lange DNA-Stränge zusammen und verleihen dem DNA-Molekül seine charakteristische Doppelstrangstruktur. Wasserstoffbrücken sind auch für einen Teil der dreidimensionalen Struktur von Proteinen verantwortlich.
Van-der-Waals-Wechselwirkungen
Wie Wasserstoffbrücken sind van-der-Waals-Wechselwirkungen schwache Anziehungen oder Wechselwirkungen zwischen Molekülen. Sie treten zwischen polaren, kovalent gebundenen Atomen in verschiedenen Molekülen auf. Einige dieser schwachen Anziehungskräfte werden durch vorübergehende Teilladungen verursacht, die entstehen, wenn sich Elektronen um einen Kern bewegen. Diese schwachen Wechselwirkungen zwischen Molekülen sind in biologischen Systemen wichtig.
Zusammenfassung des Abschnitts
Materie ist alles, was Raum einnimmt und Masse hat. Sie setzt sich aus Atomen verschiedener Elemente zusammen. Alle 92 Elemente, die in der Natur vorkommen, haben einzigartige Eigenschaften, die es ihnen ermöglichen, sich auf verschiedene Weise zu verbinden und Verbindungen oder Moleküle zu bilden. Atome, die aus Protonen, Neutronen und Elektronen bestehen, sind die kleinsten Einheiten eines Elements, die alle Eigenschaften des jeweiligen Elements besitzen. Elektronen können zwischen Atomen abgegeben oder geteilt werden, um Bindungen zu schaffen, einschließlich Ionen-, Kovalenz- und Wasserstoffbindungen sowie Van-der-Waals-Wechselwirkungen.
Zusätzliche Übungen zur Selbstkontrolle
1. Betrachte Abbildung 2: Wie viele Neutronen haben Kalium-39 und Kalium-40?
2. Warum sind Wasserstoffbrücken und van-der-Waals-Wechselwirkungen für Zellen notwendig?
Antworten
1. Kalium-39 hat zwanzig Neutronen. Kalium-40 hat einundzwanzig Neutronen.
2. Wasserstoffbrücken und van der Waals-Wechselwirkungen bilden schwache Verbindungen zwischen verschiedenen Molekülen. Sie sorgen für die Struktur und Form, die für Proteine und DNA in den Zellen notwendig sind, damit sie richtig funktionieren. Wasserstoffbrücken verleihen dem Wasser auch seine einzigartigen Eigenschaften, die für das Leben notwendig sind.