N2O (protoxid de azot) este un oxid de azot și este numit gaz de râs. În acest tutorial, vom învăța următoarele aspecte ale gazului protoxid de azot.
- Cum se desenează structura lewis pentru N2O
- Desenarea structurilor de rezonanță după structura lewis
- Numerele de oxidare ale atomilor de azot și oxigen.
Dacă știți deja structura lewis a N2O, puteți sări peste prima secțiune a acestui tutorial și puteți trece direct la partea cu structura lewis.
- Structura Lewis a N2O
- Numărul de electroni din învelișul de valență
- Actomul central al N2O
- Carcini pe atomi
- Structura 1
- Structura 2
- Structura 3
- Forma moleculei de N2O în jurul atomului central
- Structurile de rezonanță ale N2O
- Statele de oxidare, numerele de N2O
- Starea de oxidare a N2O
- Numărul de oxidare din ecuație
Structura Lewis a N2O
Există mai mulți pași care trebuie urmați pentru a desena structura lewis a N2O. aAlții dintre ei sunt explicați în detaliu în acest tutorial și un începător poate învăța elementele de bază ale desenării structurii lewis.
Numărul de electroni din învelișul de valență
În primul rând, trebuie să știm câți electroni din învelișurile de valență ale atomilor de oxigen și azot vor fi furnizați pentru a forma molecula.
Numărul de electroni din învelișul de valență al atomului de azot = 5
Numărul de atomi de azot din molecula N2O = 2
Numărul de electroni dat de atomii de azot = 5*2 = 10
Numărul de electroni din învelișul de valență al atomului de oxigen = 6
Total electroni dați de toate atomi = 10 + 6 = 16
Numărul total al perechilor de respingere a electronilor (suma perechilor σ + π + singure din învelișurile de valență) = 16/2 = 8
Actomul central al N2O
De obicei, atomul de azot are cea mai mare posibilitate de a fi atomul central decât atomul de oxigen, deoarece azotul poate prezenta valențe mari decât oxigenul.
Deci, unul dintre atomii de azot este situat ca atom central, iar ceilalți atomi sunt situați în jurul lui. Acum ne putem imagina o schiță pentru N2O și este figurată mai jos.
Carcini pe atomi
Când se desenează o moleculă, trebuie să fim atenți să minimizăm întotdeauna sarcinile pe atomi deoarece atunci când sarcinile atomilor sunt mici, stabilitatea moleculei respective este mare.
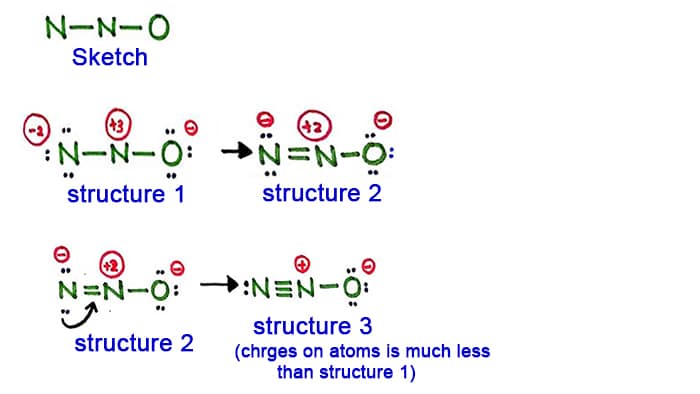
Structura 1
Vezi structura 1, există sarcini pozitive și sarcini pe fiecare atom din molecula N2O. Deci această structură nu pare a fi o structură stabilă. Prin urmare, ar trebui să încercăm să desenăm o altă structură modificând structura 1.
Faceți o nouă legătură prin transformarea unei perechi singuratice în atomul de azot din lateral (nu în atomul de azot din centru).
Structura 2
O pereche lungă în atomul de azot (partea stângă) este acum cauzată pentru a forma o legătură între atomii de azot. Deci acum există o legătură dublă între atomii de azot. Odată cu aceasta, densitatea sarcinilor de pe atomi este diminuată.
Dar, puteți vedea, există încă sarcini pe atomi. Deci, să încercăm o altă structură pentru N2O pentru a scădea sarcinile, dacă este posibil.
Structura 3
O altă pereche lungă în atomul de azot (partea stângă) este acum cauzată de formarea unei legături între atomii de azot. Deci acum există o legătură triplăîntre atomii de azot.
În această structură, sarcinile pe atomi sunt diminuate și mai mult. Acum, atomul de azot central are doar o sarcină +1, iar atomul de oxigen are o sarcină -1.
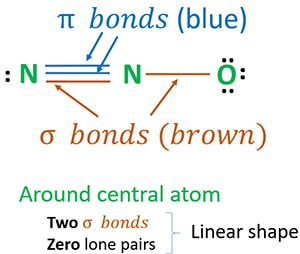
Structura 3 este cea mai bună structură (cea mai stabilă) pe care o putem desena pentru N2O. Atomul său central conține, în jurul său,
- două legături sigma (σ)
- zero perechi singuratice
Forma moleculei de N2O în jurul atomului central
Molcula de N2O conține doi atomi de azot și unul de oxigen. Mai întâi ar trebui să încercăm să desenăm cea mai stabilă structură lewis a N2O pentru a decide forma moleculei de N2O.
Numărul de perechi singuratice și numărul de legături σ în jurul atomului central sunt importante pentru a găsi forma unei molecule.
Datorită celor două legături sigma și zero perechi lone în jurul atomului central (azot), forma moleculei de N2O este liniară.
Potem desena structuri de rezonanță N2O pentru a identifica cea mai stabilă structură a N2O. Numerele de oxidare ale azotului din N2O se decid din structurile cele mai stabile. În cele din urmă construim forma moleculei de N2O.
Structurile de rezonanță ale N2O
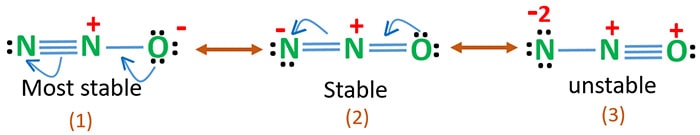
Electronegativitatea oxigenului este mai mare decât a azotului. Aceasta înseamnă că o sarcină negativă pe atomul de oxigen este mai stabilă decât o sarcină negativă pe atomul de azot. Altfel, putem spune că oxigenului îi plac mai mult electronii decât azotul.
Structura 3 este cea mai instabilă rezonanță a N2O, deoarece există o sarcină pozitivă pe atomul de oxigen.
Structura 2 are o oarecare stabilitate.
Structura 1 este cea mai stabilă rezonanță deoarece oxigenul deține sarcina negativă.
Statele de oxidare, numerele de N2O
Pot fi calculate stările de oxidare ale N2O pentru structura de rezonanță cea mai stabilă.
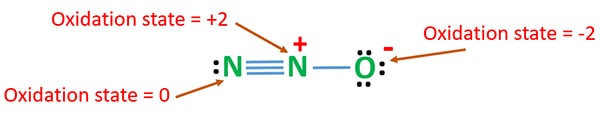
Starea de oxidare a N2O
Numărul de oxidare al azotului din N2O este +1. Dar în situația reală, un atom de azot se află la starea de oxidare +2, iar celălalt atom de azot se află la starea de oxidare 0. Numărul de oxidare al oxigenului este -2.
Numărul de oxidare din ecuație
Știm că în cele mai multe ocazii, numărul de oxidare al oxigenului este -2. Există doi atomi de azot în N2O. Luați numărul de oxidare al azotului este x. Sarcina totală a moleculei de N2O este 0.
Câteva dintre numerele de oxidare ale fiecărui element din moleculă trebuie să fie egale cu zero.
.