N2O (podtlenek azotu) jest tlenkiem azotu i jest nazywany gazem rozweselającym. W tym tutorialu, będziemy uczyć się następujących rzeczy o podtlenku azotu.
- Jak narysować strukturę lewisa dla N2O
- Rysowanie struktur rezonansowych po strukturze lewisa
- Liczby utlenienia atomów azotu i tlenu.
Jeżeli znasz już strukturę lewisa dla N2O, możesz pominąć pierwszą część tego poradnika i przejść bezpośrednio do części o strukturze lewisa.
Struktura Lewisa dla N2O
Jest kilka kroków do wykonania przy rysowaniu struktury Lewisa dla N2O. Wszystkie z nich są wyjaśnione szczegółowo w tym samouczku i początkujący może nauczyć się podstaw rysowania struktury Lewisa.
Liczba elektronów powłoki walencyjnej
Po pierwsze, powinniśmy wiedzieć, ile elektronów powłok walencyjnych atomów tlenu i azotu zostanie dostarczonych do utworzenia cząsteczki.
Liczba elektronów w powłoce walencyjnej atomu azotu = 5
Liczba atomów azotu w cząsteczce N2O = 2
Liczba elektronów przekazanych przez atomy azotu = 5*2 = 10
Liczba elektronów w powłoce walencyjnej atomu tlenu = 6
Łączna liczba elektronów przekazanych przez wszystkie atomy = 10 + 6 = 16
Liczba całkowitych par elektronów odpychających (suma par σ + π + samotnych w powłokach walencyjnych) = 16/2 = 8
Centralny atom N2O
Zazwyczaj atom azotu ma największą możliwość bycia atomem centralnym niż atom tlenu, ponieważ azot może wykazywać wysoką walencyjność niż tlen.
Więc jeden z atomów azotu znajduje się jako atom centrum i inne atomy znajdują się wokół niego. Teraz możemy sobie wyobrazić szkic dla N2O i jest on przedstawiony poniżej.
Ładunki na atomach
Gdy rysujemy cząsteczkę, powinniśmy zawsze uważać, aby zminimalizować ładunki na atomach, ponieważ gdy ładunki atomów są niskie, stabilność tej cząsteczki jest duża.
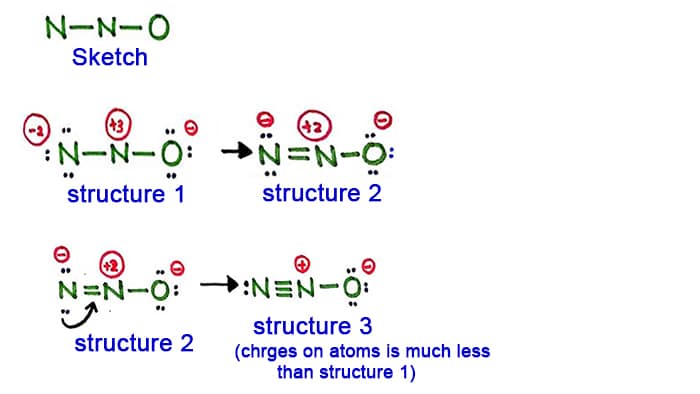
Struktura 1
Patrząc na strukturę 1, na każdym atomie w cząsteczce N2O są ładunki dodatnie i dodatnie. Więc ta struktura nie wydaje się być stabilną strukturą. Dlatego powinniśmy spróbować narysować inną strukturę poprzez zmianę struktury 1.
Make nowego wiązania przez konwersję samotnej pary w atomie azotu w bok (nie w centrum atom azotu).
Struktura 2
Długa para w atomie azotu (po lewej stronie) jest teraz spowodowane do tworzenia wiązania między atomami azotu. Więc teraz jest podwójne wiązanie między atomami azotu. Z tym, gęstość ładunków na atomach są zmniejszone.
Ale, można zobaczyć, są ładunki nadal na atomach. Więc spróbujmy innej struktury dla N2O, aby obniżyć ładunki, jeśli to możliwe.
Struktura 3
Kolejna długa para w atomie azotu (po lewej stronie) jest teraz spowodowana, aby utworzyć wiązanie między atomami azotu. Więc teraz jest potrójne wiązanie między atomami azotu.
W tej strukturze, ładunki na atomach są zmniejszone ponadto. Teraz środkowy atom azotu ma tylko ładunek +1, a atom tlenu ma ładunek -1.
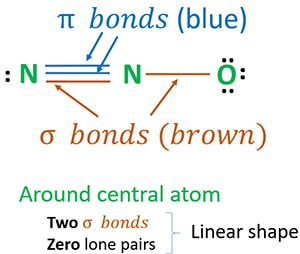
Struktura 3 jest najlepszą (najbardziej stabilną) strukturą jaką możemy narysować dla N2O. Jej atom centralny zawiera, wokół niego,
- dwa wiązania sigma (σ)
- zero samotnych par
Kształt cząsteczki N2O wokół atomu centralnego
Cząsteczka N2O zawiera dwa atomy azotu i jeden atomu tlenu. Najpierw powinniśmy spróbować narysować najbardziej stabilną strukturę Lewisa N2O, aby zdecydować o kształcie cząsteczki N2O.
Liczba par samotnych i liczba wiązań σ wokół atomu centrum są ważne dla znalezienia kształtu cząsteczki.
Dzięki dwóm wiązaniom sigma i zerowej liczbie samotnych par wokół atomu centrum (azotu), kształt cząsteczki N2O jest liniowy.
Możemy narysować struktury rezonansowe N2O, aby zidentyfikować najbardziej stabilną strukturę N2O. Numery utleniania azotu w N2O jest określona z najbardziej stabilnych struktur. Na koniec budujemy kształt cząsteczki N2O.
Struktury rezonansowe N2O
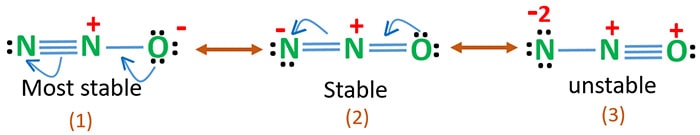
Elektronegatywność tlenu jest większa niż azotu. Oznacza to, że ujemny ładunek na atomie tlenu jest bardziej stabilny niż ujemny ładunek na atomie azotu. Inaczej możemy powiedzieć, że tlen lubi elektrony bardziej niż azot.
Struktura 3 jest najbardziej niestabilnym rezonansem N2O, ponieważ na atomie tlenu znajduje się ładunek dodatni.
Struktura 2 ma pewną stabilność.
Struktura 1 jest najbardziej stabilnym rezonansem, ponieważ tlen posiada ładunek ujemny.
Stany utleniania, liczby N2O
Możemy obliczyć stany utleniania N2O dla najbardziej stabilnej struktury rezonansowej.
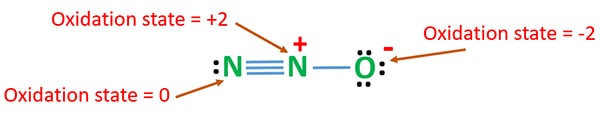
Stan utleniania N2O
Liczba utleniania azotu w N2O wynosi +1. Ale w rzeczywistej sytuacji, jeden atom azotu jest na +2 stan utleniania i inny atom azotu jest na 0 stan utleniania. Liczba utleniania tlenu wynosi -2.
Liczba utlenienia z równania
Wiemy, że w większości przypadków liczba utlenienia tlenu wynosi -2. W N2O znajdują się dwa atomy azotu. Przyjmijmy, że liczba utlenienia azotu wynosi x. Całkowity ładunek cząsteczki N2O wynosi 0.
Część liczb utlenienia każdego pierwiastka w cząsteczce powinna być równa zeru.