N2O (distikstofmonoxide) is een stikstofoxide en wordt lachgas genoemd. In deze tutorial, gaan we leren de volgende dingen van lachgas.
- Hoe de lewis structuur te tekenen voor N2O
- Tekenen van resonantie structuren volgens de lewis structuur
- Oxidatiegetallen van stikstof en zuurstof atomen.
Als u de lewis-structuur van N2O al kent, kunt u het eerste deel van deze tutorial overslaan en direct naar het lewis-structuurgedeelte gaan.
Lewis-structuur van N2O
Er zijn verschillende stappen die moeten worden gevolgd bij het tekenen van de lewis-structuur van N2O. Al deze stappen worden in detail uitgelegd in deze tutorial en een beginner kan zo de basisbeginselen van het tekenen van de lewis-structuur leren.
Aantal elektronen van valentieschil
Eerst moeten we weten hoeveel elektronen van valentieschillen van zuurstof- en stikstofatomen zullen worden geleverd om het molecuul te vormen.
Aantal elektronen in de valentieschil van het stikstofatoom = 5
Aantal stikstofatomen in het N2O-molecuul = 2
Aantal elektronen gegeven door de stikstofatomen = 5*2 = 10
Aantal elektronen in de valentieschil van het zuurstofatoom = 6
Totaal aantal elektronen gegeven door de alle atomen = 10 + 6 = 16
Aantal totaal afstotende elektronenparen (som van σ + π + eenzame paren in valentieschillen) = 16/2 = 8
Centrumatoom van N2O
Natuurlijk heeft het stikstofatoom de grootste kans om het centrumatoom te zijn dan het zuurstofatoom omdat stikstof een hogere valantie kan vertonen dan zuurstof.
Dus één van de stikstofatomen bevindt zich als centrumatoom en de andere atomen bevinden zich er omheen. Nu kunnen we ons een schets voor N2O voorstellen en deze is hieronder afgebeeld.
Ladingen op atomen
Wanneer een molecuul wordt getekend, moeten we er altijd op letten de ladingen op atomen zo klein mogelijk te houden, want als de ladingen van atomen laag zijn, is de stabiliteit van dat molecuul groot.
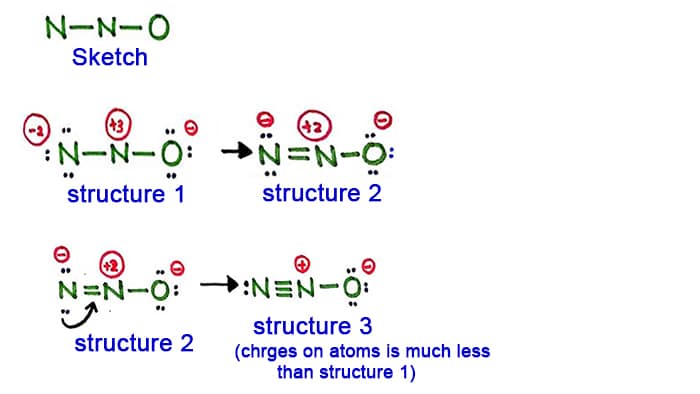
Structuur 1
Kijk naar de structuur 1, er zijn positieve en ladingen op elke atoom in het N2O-molecuul. Dus deze structuur lijkt geen stabiele structuur te zijn. Daarom moeten we proberen een andere structuur te tekenen door de structuur 1 te veranderen.
Maak een nieuwe binding door een lone paar in het stikstofatoom aan de zijkant (niet in het middelste stikstofatoom) om te zetten.
Structuur 2
Een lone paar in het stikstofatoom (linkerkant) wordt nu veroorzaakt om een binding tussen stikstofatomen te vormen. Er is nu dus een dubbele binding tussen stikstofatomen. Daarmee is de ladingsdichtheid op atomen afgenomen.
Maar, u ziet het, er zijn nog steeds ladingen op atomen. Dus laten we een andere structuur proberen voor N2O om de ladingen te verlagen als dat mogelijk is.
Structuur 3
Een ander langpaar in het stikstofatoom (linkerkant) wordt nu veroorzaakt door een binding tussen stikstofatomen. Er is nu dus een drievoudige binding tussen stikstofatomen.
In deze structuur zijn de ladingen op atomen verder verlaagd. Nu heeft het middelste stikstofatoom nog maar een lading van +1 en het zuurstofatoom een lading van -1.
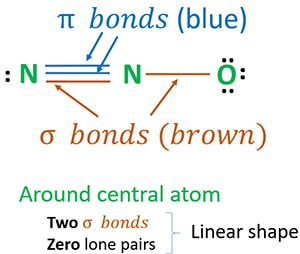
Structuur 3 is de beste (meest stabiele) structuur die we voor N2O kunnen tekenen. Het middelste atoom bevat, eromheen,
- twee sigma (σ) bindingen
- nul lone pairs
Vorm van N2O molecuul rond middelste atoom
N2O molecuul bevat twee stikstofatomen en één zuurstofatoom. Eerst moeten we proberen de meest stabiele lewisstructuur van N2O te tekenen om de vorm van N2O-molecuul te bepalen.
Aantal eenzame paren en aantal σ-bindingen rond het middelste atoom zijn belangrijk voor het vinden van de vorm van een molecuul.
Door twee sigma-bindingen en nul lone pairs rond het centrumatoom (stikstof) is de vorm van N2O-molecuul lineair.
We kunnen N2O resonantiestructuren tekenen om de meest stabiele structuur van N2O te bepalen. Oxidatiegetallen van stikstof in N2O wordt bepaald door de meest stabiele structuren. Tenslotte bouwen we de vorm van N2O-molecule.
N2O resonantiestructuren
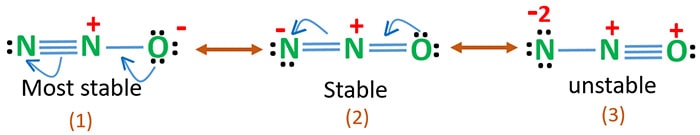
De elektronegativiteit van zuurstof is hoger dan die van stikstof. Dit betekent dat een negatieve lading op een zuurstofatoom stabieler is dan een negatieve lading op een stikstofatoom. Anders kunnen we zeggen dat zuurstof meer van elektronen houdt dan stikstof.
Structuur 3 is de meest onstabiele resonantie van N2O omdat het zuurstofatoom een positieve lading heeft.
Structuur 2 heeft enige stabiliteit.
Structuur 1 is de meest stabiele resonantie omdat zuurstof de negatieve lading heeft.
Oxidatietoestanden, getallen van N2O
We kunnen oxidatietoestanden van N2O berekenen voor de meest stabiele resonantiestructuur.
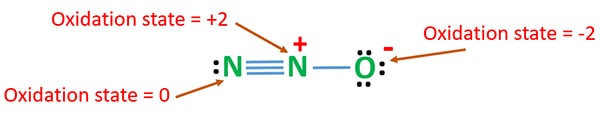
Oxidatietoestand van N2O
Oxidatiegetal van stikstof in N2O is +1. Maar in werkelijkheid heeft een stikstofatoom een oxidatietoestand van +2 en het andere stikstofatoom een oxidatietoestand van 0. Het oxidatiegetal van zuurstof is -2.
Oxidatiegetal uit vergelijking
We weten dat in de meeste gevallen het oxidatiegetal van zuurstof -2 is. Er zijn twee stikstofatomen in N2O. Neem oxidatiegetal van stikstof is x. Totale lading van N2O molecuul is 0.
Enkele van de oxidatiegetallen van elk element in het molecuul moet gelijk zijn aan nul.