N2O (óxido nitroso) é um óxido de nitrogênio e é chamado de gás risonho. Neste tutorial, vamos aprender a seguir o gás óxido nitroso.
- Como desenhar a estrutura de Lewis para N2O
- Traçar estruturas de ressonância seguindo a estrutura de Lewis
- Números de oxidação de átomos de nitrogênio e oxigênio.
Se você já conhece a estrutura lewis do N2O, você pode pular a primeira seção deste tutorial e pode ir diretamente para a parte da estrutura lewis.
Lewis structure of N2O
Existem vários passos a seguir para desenhar a estrutura lewis do N2O. aAl deles são explicados em detalhes neste tutorial e um iniciante pode aprender o básico do desenho da estrutura lewis.
Número de elétrons de concha de valência
Primeiro, devemos saber, quantos elétrons de concha de valência de átomos de oxigênio e nitrogênio serão fornecidos para formar a molécula.
Número de electrões na concha de valência do átomo de azoto = 5
Número de átomos de azoto na molécula N2O = 2
Número de electrões dados pelos átomos de azoto = 5*2 = 10
Número de electrões na concha de valência do átomo de oxigénio = 6
Total de electrões dados pelos todos átomos = 10 + 6 = 16
Número total de pares repulsores de elétrons (soma de σ + π + pares isolados em conchas de valância) = 16/2 = 8
Átomo central de N2O
O átomo de nitrogêniosualmente tem a maior possibilidade de ser o átomo central do que o átomo de oxigênio porque o nitrogênio pode mostrar valância alta do que o oxigênio.
Então um dos átomos de nitrogênio está localizado como o átomo central e outros átomos estão localizados ao redor dele. Agora podemos imaginar um esboço para N2O e ele é figura abaixo.
Cargas nos átomos
Quando uma molécula está sendo retirada, devemos ter cuidado para minimizar sempre as cargas nos átomos porque quando as cargas dos átomos são baixas, a estabilidade dessa molécula é grande.
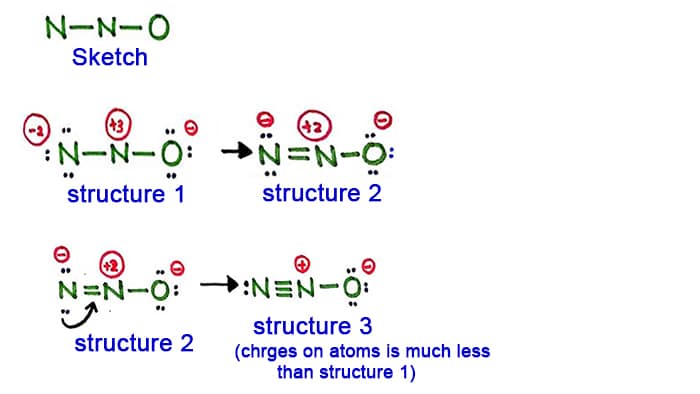
Estrutura 1
Leve a estrutura 1, há cargas positivas e cargas em cada átomo da molécula N2O. Portanto, esta estrutura não parece ser uma estrutura estável. Portanto devemos tentar desenhar outra estrutura mudando a estrutura 1.
Faça uma nova ligação convertendo um par solitário no átomo de nitrogênio no lado (não no átomo central de nitrogênio).
Estrutura 2
Um par longo no átomo de nitrogênio (lado esquerdo) é agora causado para formar uma ligação entre os átomos de nitrogênio. Então agora há uma ligação dupla entre os átomos de nitrogênio. Com isso, a densidade das cargas sobre os átomos diminui.
Mas, você pode ver, ainda há cargas sobre os átomos. Então vamos tentar outra estrutura para N2O para baixar as cargas se possível.
Estrutura 3
Outro par longo no átomo de nitrogênio (lado esquerdo) é agora causado para formar uma ligação entre os átomos de nitrogênio. Então agora há uma tripla ligação entre os átomos de azoto.
Nesta estrutura, as cargas sobre os átomos são reduzidas. Agora o átomo central de nitrogênio tem apenas +1 carga e o átomo de oxigênio tem -1 carga.
A estrutura 3 é a melhor (mais estável) estrutura que podemos desenhar para N2O. Seu átomo central contém, ao redor dele,
- dois sigma (σ) ligações
- pares isolados a zero
Forma da molécula N2O ao redor do átomo central
Molécula N2O contém dois átomos de nitrogênio e um de oxigênio. Primeiro devemos tentar desenhar a estrutura lewis mais estável de N2O para decidir a forma da molécula N2O.
Número de pares solitários e número de ligações em σ ao redor do átomo central são importantes para encontrar a forma de uma molécula.
Devido a duas ligações sigma e zero pares solitários ao redor do átomo central (nitrogênio), a forma da molécula N2O é linear.
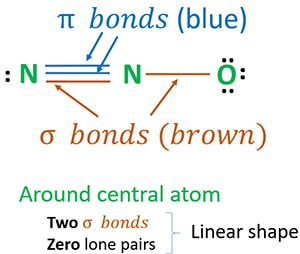
Podemos desenhar estruturas de ressonância N2O para identificar a estrutura mais estável de N2O. Os números de oxidação de nitrogênio em N2O são decididos a partir da maioria das estruturas estáveis. Finalmente construímos a forma da molécula N2O.
Estruturas de ressonância N2O
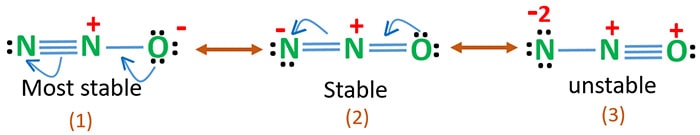
Electronegatividade do oxigênio é maior que a do nitrogênio. Isto significa que uma carga negativa sobre o átomo de oxigênio é mais estável do que uma carga negativa sobre o átomo de nitrogênio. Caso contrário, podemos dizer que o oxigênio gosta mais dos elétrons do que do nitrogênio.
Estrutura 3 é a ressonância mais instável de N2O porque há uma carga positiva sobre o átomo de oxigênio.
Estrutura 2 tem alguma estabilidade.
Estrutura 1 é a ressonância mais estável porque o oxigénio detém a carga negativa.
Estados de oxidação, números de N2O
Podemos calcular os estados de oxidação de N2O para a estrutura de ressonância mais estável.
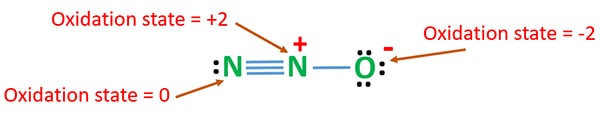
Estado de oxidação de N2O
O número de oxidação de nitrogênio em N2O é +1. Mas na situação real, um átomo de nitrogênio está em +2 estado de oxidação e outro átomo de nitrogênio está em 0 estado de oxidação. O número de oxidação do oxigênio é -2.
Número de oxidação da equação
Sabemos que na maioria das vezes, o umber de oxidação do oxigênio é -2. Há dois átomos de nitrogênio em N2O. O número de oxidação do nitrogênio é x. A carga total da molécula N2O é 0,
Alguns números de oxidação de cada elemento da molécula devem ser iguais a zero.