US Pharm. 2018;43(9):21-26.
ABSTRACT: La terapia ormonale sostitutiva (TOS) è il trattamento più efficace per i sintomi vasomotori e genitourinari associati alla menopausa. Gli effetti avversi associati alla TOS dipendono da vari fattori, tra cui il dosaggio, la via, la durata di utilizzo, i tempi di inizio e la scelta dell’agente. La decisione di iniziare la TOS dovrebbe includere una valutazione del rischio, e la TOS dovrebbe essere individualizzata per il paziente. Le molte opzioni di TOS esistenti sono disponibili in una vasta gamma di dosaggi e forme di dosaggio. I farmacisti dovrebbero essere in grado di consigliare i pazienti sulla TOS e sui suoi effetti collaterali.
La donna media vivrà un terzo della sua vita in menopausa o oltre la menopausa.1 Il trattamento dei sintomi della menopausa ha acquisito un’importanza crescente a causa delle patologie associate all’invecchiamento nelle donne.2 La terapia ormonale sostitutiva (HRT), un termine usato per descrivere la terapia estrogenica, la terapia combinata estrogeno-progesterone, o la terapia agonista o antagonista del recettore degli estrogeni, continua a svolgere un ruolo importante nell’attenuazione dei sintomi perimenopausali e postmenopausali.3 Anche se l’esperienza di ogni donna è diversa, i sintomi vasomotori (VMS) e i sintomi vulvovaginali sono due dei disturbi più comuni associati ai cambiamenti ormonali coinvolti nella menopausa.4
Sintomi della menopausa
I VMS sono alcuni dei sintomi più comuni e più fastidiosi della menopausa. Le vampate di calore, caratterizzate da un’improvvisa sensazione di calore nella parte superiore del petto e del viso che dura da 2 a 4 minuti, si verificano in circa il 75% delle donne in menopausa.1 Altri possibili VMS sono la sudorazione, le palpitazioni e l’ansia.1 I VMS sono stati associati a una diminuzione della qualità del sonno, irritabilità, difficoltà di concentrazione e una ridotta qualità della vita.3 Inoltre, questi sintomi sono stati collegati a rischi cardiovascolari, ossei e cognitivi.5-9 La TOS è stata a lungo riconosciuta come il trattamento più efficace per la VMS.4,10
Oltre alla fastidiosa VMS, molte donne sperimentano sintomi vulvovaginali. Si stima che dal 10% al 40% delle donne sperimentino l’atrofia vaginale.3 L’atrofia vaginale può causare dolore, bruciore e prurito vulvare, secchezza vaginale, perdite vaginali, dispareunia (rapporti sessuali difficili o dolorosi) e spotting o sanguinamento dopo il rapporto.1 Questi sintomi tendono a verificarsi nella tarda fase postmenopausale e possono portare a disagio da abiti aderenti, mentre si sta seduti o si fa esercizio, o con l’attività sessuale.1 La TOS topica è tipicamente raccomandata per il trattamento dei sintomi vulvovaginali.1
Oltre ad alleviare i sintomi precedentemente indicati, esistono prove che la TOS standard a basso dosaggio può anche prevenire le fratture dell’anca, della colonna vertebrale e non spinali in postmenopausa.10 I benefici della TOS per la VMS e i sintomi genitourinari includono miglioramenti nella vescica iperattiva, diminuzione dei disturbi del sonno, riduzione del rischio di diabete di tipo 2, potenziale protezione dalla malattia coronarica (CAD) e dall’infarto del miocardio, diminuzione del rischio di osteoporosi o frattura e una potenziale riduzione della mortalità per tutte le cause.1,10 I benefici che la TOS conferisce alla densità ossea, tuttavia, diminuiscono rapidamente dopo la sospensione. Inoltre, anche se alcuni prodotti hanno l’approvazione della FDA per la prevenzione dell’osteoporosi, nessuno di loro è attualmente approvato per il trattamento dell’osteoporosi. I principali rischi associati all’uso di questi agenti includono tromboembolia venosa (TEV), ictus ischemico, aumento dell’incidenza del cancro endometriale (se un estrogeno non opposto è usato in una donna con un utero), e aumento del rischio di cancro al seno quando la TOS è usata oltre 3 a 5 anni.4,10
Prodotti TOS disponibili
Una vasta gamma di prodotti TOS sono disponibili in varie forme di dosaggio.4 Tra le preparazioni orali, le opzioni includono estrogeni equini coniugati (CEE), estradiolo 17-beta micronizzato (micronizzato per migliorare l’assorbimento), estrogeni esterificati, estradiolo etinilico (una preparazione estrogenica altamente potente che viene utilizzata a dosaggi molto più bassi per la TOS che per la contraccezione orale), compresse di combinazione estrogeno-progestinica e una compressa di combinazione CEE/bazedoxifene.4
La compressa CEE/bazedoxifene, una combinazione di estrogeni e un modulatore selettivo del recettore degli estrogeni, è disponibile negli Stati Uniti per il trattamento della VMS in menopausa e la prevenzione dell’osteoporosi. In questa combinazione, il bazedoxifene previene l’iperplasia endometriale indotta dagli estrogeni, rendendo inutile la somministrazione di un progestinico. Tuttavia, il bazedoxifene è associato a un aumento del rischio di TEV.4 L’uso del bazedoxifene è risultato sicuro se studiato fino a 7 anni nel trattamento dell’osteoporosi, ma la combinazione è stata studiata solo per durate più brevi.11,12 Gli studi sulla VMS di durata fino a 2 anni non hanno dimostrato alcun aumento dell’incidenza di sensibilità al seno o del rischio di cancro al seno.3 Le attuali linee guida raccomandano l’uso di CEE/bazedoxifene in donne in postmenopausa con un utero e senza controindicazioni per trattare la VMS e aiutare a prevenire la perdita ossea, ma non specificano la durata della terapia.1 Sulla base delle prove disponibili, il trattamento della VMS con CEE/bazedoxifene fino a 2 anni sembra sicuro; la sicurezza dell’uso oltre i 2 anni rimane poco chiara.
HRT è disponibile anche in varie applicazioni topiche. Sono disponibili preparazioni transdermiche di cerotto di 17-beta estradiolo o combinazioni estrogeno-progestiniche. Altre preparazioni topiche includono pacchetti di gel o pompe dosatrici, spray ed emulsioni.4 Iniezioni di deposito possono anche essere considerati, ma questi prodotti sono raramente utilizzati nell’impostazione di HRT.4 Un riassunto delle formulazioni HRT sistemica disponibile è dato in TABELLA 1.13-15
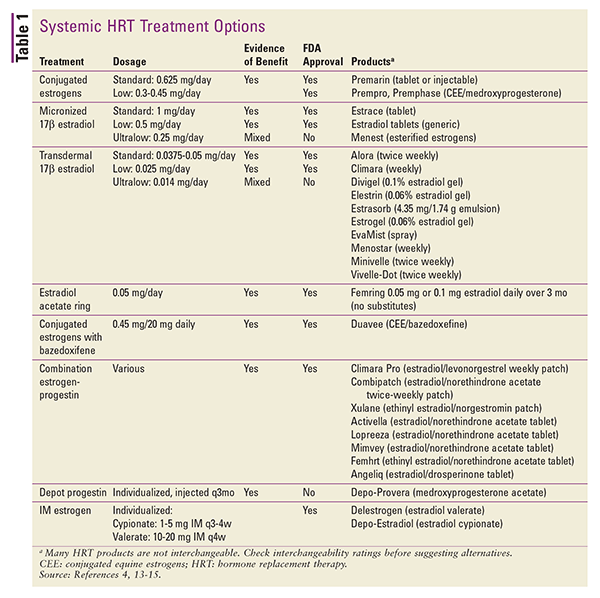
Nella conversione da una forma di dosaggio ad un altro, le differenze nella via di somministrazione e potenza del prodotto può essere contabilizzato utilizzando gli equivalenti di dose stimato.4 Gli equivalenti di dose per preparazioni orali sono i seguenti: 1 mg di 17-beta estradiolo micronizzato equivale a 1,25 mg di piperazina estrone solfato. Nelle conversioni tra preparazioni estrogeniche orali e transdermiche, 0,05 mg/24 ore transdermiche equivalgono a circa 0,625 mg al giorno per bocca.4
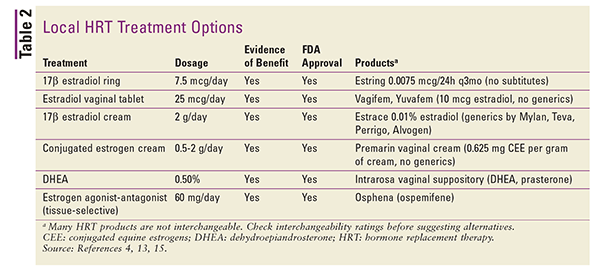
Le preparazioni locali sono generalmente a basso dosaggio e sono usate specificamente per la gestione dei sintomi dell’atrofia vulvovaginale.4 Dosi più elevate possono essere usate per il trattamento della VMS sistemica, ma questo non è generalmente raccomandato.4 Le preparazioni locali includono anelli vaginali, compresse e creme. Fare riferimento alla TABELLA 2 per un riassunto delle formulazioni locali di TOS disponibili.4,13,15
Raccomandazioni attuali delle linee guida
Tre organizzazioni – l’American College of Obstetricians and Gynecologists, la North American Menopause Society (NAMS), e l’Endocrine Society – hanno prodotto linee guida sull’uso della TOS in menopausa. Come indicato in queste linee guida, le indicazioni per la TOS includono la gestione della VMS associata alla menopausa e il trattamento degli effetti vulvovaginali in assenza di sintomi sistemici fastidiosi.1,3,4 Gli estrogeni da soli o in combinazione con un progestinico sono stati trovati per ridurre la VMS settimanale del 75% e ridurre significativamente la gravità dei sintomi rispetto al placebo.4
Nelle donne di età inferiore ai 60 anni che sono meno di 10 anni dopo la menopausa, hanno una VMS fastidiosa e non hanno controindicazioni alla TOS o un eccesso di rischio cardiovascolare o di cancro al seno, l’uso della terapia a base di soli estrogeni è raccomandato per quelle senza utero. L’aggiunta di un progestinico è raccomandata nelle pazienti con un utero per prevenire l’iperplasia endometriale e il potenziale cancro endometriale.1,3,4 Attualmente, l’esposizione progestinica richiesta non è chiara, ma molti fornitori danno progestinici in un ciclo di 14 giorni ogni mese.4 Per le donne di età superiore ai 60 anni o che sono più di 10 anni dopo la menopausa, la considerazione di altre terapie (non ormonali) è raccomandata invece della TOS.3
Nelle donne con un rischio elevato di malattia cardiovascolare (CVD; definito come >10% di rischio a 10 anni di CVD secondo lo strumento di stima del rischio cardiovascolare dell’American College of Cardiology/American Heart Association), le terapie non ormonali sono preferite.3 Nelle donne con rischio moderato di CVD, gli estrogeni transdermici con o senza progestinici sono preferiti alla terapia orale, poiché queste preparazioni hanno meno effetti sulla pressione sanguigna, sui lipidi e sul metabolismo dei carboidrati.1 Nelle pazienti con un rischio elevato di TEV, è preferibile l’uso di vie nonorali alla dose efficace più bassa. Infine, nelle pazienti con rischio elevato o intermedio di cancro al seno, la preferenza è data alle terapie non ormonali.4
Se si sceglie la TOS, tutte le linee guida raccomandano l’uso della dose efficace più bassa.1,4,10 Un vantaggio delle dosi più basse di TOS è il miglior profilo di effetti collaterali rispetto ai regimi ad alte dosi.4 Non esiste attualmente una via di terapia preferita per il trattamento della VMS; pertanto, la via di somministrazione dovrebbe essere guidata dalle preferenze del paziente. Va notato che i prodotti transdermici possono essere associati a una minore incidenza di effetti avversi, come il TEV, ma gli studi sono ancora in corso.10
Per il trattamento dei sintomi genitourinari nelle donne senza una storia di tumori ormono-dipendenti, possono essere usati estrogeni vaginali a basso dosaggio.1 Per i soli sintomi vaginali, le linee guida raccomandano di non aggiungere progestinici indipendentemente dalla presenza dell’utero. Questa terapia può anche essere appropriata in pazienti con una storia di tumori ormono-dipendenti, ma in questi casi, la scelta della terapia dovrebbe essere basata su un processo decisionale condiviso che include la discussione dei rischi e dei benefici. I potenziali benefici degli estrogeni vaginali includono un rapido miglioramento dei sintomi vaginali e urinari e la possibile prevenzione delle infezioni ricorrenti del tratto urinario. Le terapie non estrogeniche approvate dall’FDA e conformi alle linee guida utilizzate per alleviare la dispareunia comprendono l’ospemifene e il deidropiandrosterone intravaginale.16,17
La terapia a base di soli progestinici, il testosterone, le terapie alternative non ormonali a base di piante e gli ormoni bioidentici composti mancano di dati e generalmente non sono raccomandati.1,4 Il NAMS afferma che i medici possono considerare la TOS composta in situazioni in cui una paziente non è in grado di tollerare le terapie approvate dalla FDA.3 Le opzioni di trattamento non ormonale per i sintomi vasomotori includono inibitori selettivi della ricaptazione della serotonina e inibitori selettivi della ricaptazione della serotonina-norepinefrina, clonidina e gabapentin, e il trattamento non ormonale per i sintomi vaginali include lubrificanti, agonisti-antagonisti estrogenici e rimedi erboristici.4 Le prove a sostegno dell’uso delle terapie non ormonali variano, e non tutte le opzioni hanno prove comprovate o un’indicazione approvata dalla FDA.4
Il monitoraggio della TOS dovrebbe includere regolari screening del cancro al seno durante e dopo il completamento della terapia. Le emorragie ricorrenti non programmate dovrebbero essere valutate rapidamente.1 La durata della terapia dovrebbe essere rivista almeno annualmente, ed è preferibile la durata più breve del trattamento.1 Quando i pazienti e i fornitori decidono di interrompere la TOS, può essere utilizzata una strategia di interruzione graduale o brusca. L’evidenza è carente per quanto riguarda i metodi di interruzione; pertanto, si raccomanda una decisione condivisa per il processo di interruzione.1,4
Interazioni farmaco-farmaco
La maggior parte dei prodotti HRT disponibili in commercio (TABELLA 1) sono sottoposti a metabolismo epatico mediato dal sistema CYP450.15 In particolare, i prodotti estrogeni sono parzialmente metabolizzati dal CYP3A4; pertanto, forti induttori del CYP3A4 possono ridurre l’efficacia della TOS estrogenica e forti inibitori possono aumentare le concentrazioni sieriche di estrogeni. Inoltre, altri substrati farmacologici per questi enzimi possono interferire con il metabolismo della TOS.15
Effetti collaterali gravi e comuni
I principali effetti collaterali associati alla TOS includono CVD, cancro al seno, cancro endometriale o ovarico, ictus e VTE.1 L’uso di estrogeni non contrastati aumenta il rischio di iperplasia endometriale e cancro, da cui la raccomandazione di aggiungere un progestinico nelle donne con un utero. Per quanto riguarda il rischio di cancro al seno, sembra esserci un piccolo rischio di sviluppare il cancro al seno quando una donna assume estrogeni per 5 anni.3 La letteratura attuale non è coerente nel determinare il rischio di sviluppare il cancro alle ovaie dalla TOS.3 Sono necessari più studi randomizzati e controllati per accertare il vero rischio di sviluppare il cancro alle ovaie con l’uso della TOS.1 Gli effetti della TOS sulla malattia coronarica (CAD), l’ictus e il TEV variano a seconda dell’età della donna al momento dell’inizio o dal momento dell’inizio della menopausa. Sembra che le donne che assumono la TOS per più di 10 anni dall’inizio della menopausa siano a maggior rischio di sviluppare CAD.3 In generale, gli studi suggeriscono che le formulazioni orali e transdermiche a basso dosaggio conferiscono un minor rischio di ictus e TEV rispetto alla TOS a dosaggio standard.3 Le pazienti che hanno più di 60 anni quando iniziano la TOS o che sono a più di 10 anni dall’inizio della menopausa sono a maggior rischio per questi effetti avversi. Inoltre, le donne che assumono la TOS con estrogeni da soli o in combinazione sono a maggior rischio di calcoli biliari, colecistite e colecistectomia.3 Il rischio di malattia della colecisti è stato associato all’uso della TOS orale e potrebbe non esistere con le formulazioni topiche o transdermiche.1,3
Contraindicazioni
Le linee guida della società professionale non hanno specificato una lista di controindicazioni assolute o relative alla TOS.2 Pertanto, come per la maggior parte delle decisioni cliniche, è importante una valutazione personalizzata dei rischi e dei benefici. In generale, la TOS dovrebbe essere evitata in pazienti con sanguinamento vaginale inspiegabile; storia di ictus o attacco ischemico transitorio; infarto miocardico; embolia polmonare o TEV; cancro al seno o all’endometrio; malattia epatica attiva; deficit noto di proteina C, proteina S, o antitrombina o altri disturbi trombofilici; e gravidanza nota o sospetta.1 Inoltre, cautela dovrebbe essere esercitata in pazienti con diabete, malattia della cistifellea, ipertrigliceridemia (>400 mg/giorno), ipoparatiroidismo, meningioma benigno, rischio intermedio o alto per il cancro al seno, alto rischio di malattie cardiache o emicrania con aura.2
Punti di consulenza
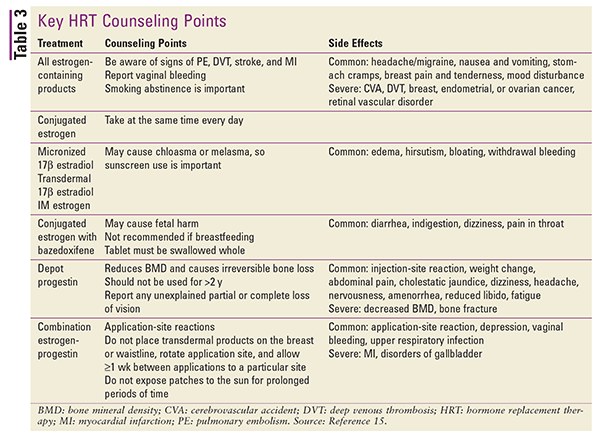
Riferimento alla TABELLA 3 per un riassunto dei punti di consulenza chiave per i pazienti e degli effetti collaterali per i vari tipi di TOS.15
Conclusione
La TOS, disponibile in un’ampia gamma di preparazioni, è il trattamento più efficace sia per la sindrome di VMS che per i sintomi genitourinari. Poiché i rischi associati alla TOS sono diversi per ogni donna, il trattamento dovrebbe essere individualizzato e finalizzato a massimizzare l’efficacia, a minimizzare la durata della terapia e a ridurre il rischio di effetti avversi. Negli scenari in cui la TOS non è un’opzione, sono disponibili opzioni di trattamento non ormonale sia per la VMS che per i sintomi genitourinari, ma l’efficacia e l’approvazione FDA di questi prodotti variano; pertanto, i dati di efficacia per questi prodotti dovrebbero essere rivisti.
1. Stuenkel CA, Davis SR, Gompel A, et al. Trattamento dei sintomi della menopausa: una linea guida di pratica clinica della Endocrine Society. J Clin Endocrinol Metab. 2015;100(11):3975-4011.
2. Shifren JL, Schiff I. Ruolo della terapia ormonale nella gestione della menopausa. Obstet Gynecol. 2010;115(4):839-855.
3. The NAMS 2017 Hormone Therapy Position Statement Advisory Panel. La dichiarazione di posizione sulla terapia ormonale del 2017 della Società nordamericana della menopausa. Menopausa. 2017;24(7):728-753.
4. ACOG Practice Bulletin No. 141: gestione dei sintomi della menopausa. Obstet Gynecol. 2014;123(1):202-216.
5. Thurston RC, Sutton-Tyrrell K, Everson-Rose SA, et al. vampate di calore e malattia cardiovascolare subclinica: risultati dallo studio della salute delle donne attraverso lo studio del cuore nazione. Circolazione. 2008;118(12):1234-1240.
6. Thurston RC, Kuller LH, Edmundowicz D, Matthews KA. Storia di vampate di calore e calcificazione aortica tra le donne in postmenopausa. Menopausa. 2010;17(2):256-261.
7. Thurston RC, Sutton-Tyrrell K, Everson-Rose SA, et al. Vampate di calore e spessore della media intima carotidea tra le donne di mezza età. Menopausa. 2011;18(4):352-358.
8. Crandall CJ, Aragaki A, Cauley JA, et al. Associazioni di sintomi vasomotori in menopausa con incidenza di frattura. J Clin Endocrinol Metab. 2015;100(2):524-534.
9. Maki PM. Memoria verbale e menopausa. Maturitas. 2015;82(3):288-290.
10. North American Menopause Society. La dichiarazione di posizione 2012 terapia ormonale di: La Società Nord Americana Menopausa. Menopausa. 2012;19(3):257-271.
11. Palacios S, Silverman SL, de Villiers TJ, et al. Uno studio randomizzato, controllato con placebo di 7 anni per valutare l’efficacia a lungo termine e la sicurezza di bazedoxifene in donne in postmenopausa con osteoporosi: effetti sulla densità ossea e frattura. Menopause. 2015;22(8):806-813.
12. Archer DF, Freeman EW, Komm BS, et al. Pooled analysis degli effetti degli estrogeni coniugati/bazedoxifene sui sintomi vasomotori negli estrogeni selettivi, menopausa e risposta alle prove di terapia. J Womens Health (Larchmt). 2016;25(11):1102-1111.
13. FDA. Libro arancione: prodotti farmaceutici approvati con valutazioni di equivalenza terapeutica. Dettagli del prodotto per ANDA 204726. www.accessdata.fda.gov/scripts/cder/ob/results_product.cfm?Appl_Type=A&Appl_No=204726. Accessed March 18, 2018.
14. FDA. Drugs@FDA: Prodotti farmaceutici approvati dalla FDA. www.accessdata.fda.gov/scripts/cder/daf/index.cfm. Accessed June 17, 2018.
15. DrugDex . Greenwood Village, CO: Truven Health Analytics, Inc. www.micromedexsolutions.com. Acceduto il 15 giugno 2018.
16. Constantine G, Graham S, Portman DJ, et al. Funzione sessuale femminile migliorata con ospemifene in donne in postmenopausa con atrofia vulvare e vaginale: risultati di uno studio randomizzato, controllato con placebo. Climacteric. 2015;18(2):226-232.
17. Labrie F, Archer DF, Koltun W, et al. Efficacia del deidroepiandrosterone intravaginale (DHEA) sulla dispareunia da moderata a grave e secchezza vaginale, sintomi di atrofia vulvovaginale e della sindrome genitourinaria della menopausa. Menopause. 2016;23(3):243-256.