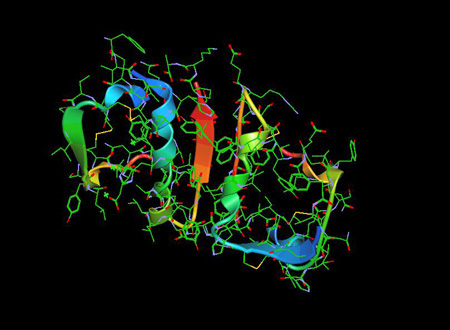
La Molecola di Insulina 1ZNI PDB è un ormone pancreatico che gioca un ruolo essenziale nella regolazione del glucosio nel sangue così come il metabolismo dei lipidi e dei carboidrati.
Per la Struttura 3-D della Molecola di Insulina usando Jsmol Clicca
Panoramica
L’insulina è un ormone polipeptidico prodotto dalle cellule β del pancreas che è principalmente responsabile della regolazione del glucosio nel sangue e dello stoccaggio di carboidrati e lipidi. Il diabete di tipo 1 è dovuto a una produzione inadeguata di insulina causata dalla distruzione e dalla perdita delle cellule β del pancreas che producono insulina. Il diabete di tipo 2 è dovuto a una relativa resistenza all’insulina. È considerata il principale ormone anabolico del corpo. (1)
Struttura della proteina
L’insulina è stata trovata come polipeptide nel 1928 e la sua sequenza di aminoacidi è stata identificata nel 1952. Si tratta infatti di un dipeptide, contenente rispettivamente le catene A e B, legate da ponti disolfuro, e contenente 51 aminoacidi, con un peso molecolare di 5802. Il suo punto isoelettrico è a pH 5.5.5 La catena A comprende 21 aminoacidi e la catena B 30 aminoacidi. La catena A ha un’elica N-terminale legata a un’elica C-terminale antiparallela; la catena B ha un segmento centrale elicoidale. Le due catene sono unite da 2 legami disolfuro, che uniscono le eliche N e C-terminali della catena A all’elica centrale della catena B. Nella pro-insulina, un peptide di collegamento collega l’N-terminale della catena A al C-terminale della catena B.
Nei vertebrati, la sequenza aminoacidica dell’insulina è fortemente conservata. L’insulina bovina differisce da quella umana solo per tre residui aminoacidici e l’insulina suina per uno. Anche l’insulina di alcune specie di pesci è abbastanza simile a quella umana da essere clinicamente efficace nell’uomo. L’insulina in alcuni invertebrati è abbastanza simile in sequenza all’insulina umana, e ha effetti fisiologici simili. La forte omologia vista nella sequenza dell’insulina di diverse specie suggerisce che è stata conservata attraverso gran parte della storia evolutiva animale. Il C-peptide della proinsulina, tuttavia, differisce molto di più tra le specie; è anche un ormone, ma secondario.
L’insulina viene prodotta e immagazzinata nel corpo come un esamero (un’unità di sei molecole di insulina), mentre la forma attiva è il monomero. L’esamero è una forma inattiva con stabilità a lungo termine, che serve a mantenere l’insulina altamente reattiva protetta, ma prontamente disponibile. La conversione esammero-monomero è uno degli aspetti centrali delle formulazioni di insulina per iniezione. L’esamero è molto più stabile del monomero, il che è auspicabile per motivi pratici; tuttavia, il monomero è un farmaco che reagisce molto più velocemente perché la velocità di diffusione è inversamente correlata alla dimensione delle particelle.
Meccanismi di secrezione dell’insulina
L’insulina viene prodotta nel pancreas e nel corpo di Brockmann (in alcuni pesci), e rilasciata quando viene rilevato uno dei diversi stimoli. Questi stimoli includono le proteine ingerite e il glucosio nel sangue prodotto dal cibo digerito. I carboidrati possono essere polimeri di zuccheri semplici o gli stessi zuccheri semplici. Se i carboidrati includono il glucosio, allora quel glucosio sarà assorbito nel flusso sanguigno e il livello di glucosio nel sangue inizierà a salire. Nelle cellule bersaglio, l’insulina avvia una trasduzione del segnale, che ha l’effetto di aumentare l’assorbimento e l’immagazzinamento del glucosio. Infine, l’insulina viene degradata, terminando la risposta.
Nei mammiferi, l’insulina viene sintetizzata nel pancreas nelle cellule beta. Da un milione a tre milioni di isole pancreatiche formano la parte endocrina del pancreas, che è principalmente una ghiandola esocrina. La parte endocrina rappresenta solo il 2% della massa totale del pancreas. All’interno degli isolotti pancreatici, le cellule beta costituiscono il 65-80% di tutte le cellule.
Rilascio di insulina
Regolazione del glucosio nel sangue Le cellule beta degli isolotti di Langerhans rilasciano insulina in due fasi. La prima fase di rilascio è attivata rapidamente in risposta all’aumento dei livelli di glucosio nel sangue e dura circa 10 minuti. La seconda fase è un rilascio prolungato e lento di vescicole di nuova formazione innescato indipendentemente dallo zucchero, con un picco in 2 o 3 ore. La riduzione della prima fase di rilascio dell’insulina può essere il primo difetto rilevabile delle cellule beta che predice l’insorgenza del diabete di tipo 2. Il rilascio di prima fase e la sensibilità all’insulina sono predittori indipendenti del diabete.
Livelli di insulina nel sangue
Il livello di insulina nel sangue può essere misurato in unità internazionali, come µIU/mL o in concentrazione molare, come pmol/L, dove 1 µIU/mL corrisponde a 6,945 pmol/L. Un tipico livello ematico tra i pasti è di 8-11 μIU/mL (57-79 pmol/L).
Meccanismo d’azione – Trasduzione del segnale dell’insulina
Trasduzione del segnale Gli effetti dell’insulina sono iniziati dal suo legame con un recettore presente nella membrana cellulare. La molecola del recettore contiene una subunità α e una subunità β. Due molecole sono unite per formare quello che è conosciuto come un omodimero. L’insulina si lega alle subunità α dell’omodimero, che si affaccia sul lato extracellulare delle cellule. Le subunità β hanno un’attività enzimatica tirosin-chinasica che viene innescata dal legame con l’insulina. Questa attività provoca l’autofosforilazione delle subunità β e successivamente la fosforilazione di proteine all’interno della cellula note come substrati del recettore dell’insulina (IRS). La fosforilazione dell’IRS attiva una cascata di trasduzione del segnale che porta all’attivazione di altre chinasi nonché di fattori di trascrizione che mediano gli effetti intracellulari dell’insulina.
Azione dell’insulina degli effetti fisiologici
le azioni dell’insulina a livello del metabolismo umano globale includono: Aumento dell’assunzione cellulare di alcune sostanze, in particolare il glucosio nel tessuto muscolare e adiposo (circa due terzi delle cellule del corpo) Aumento della replicazione del DNA e della sintesi proteica attraverso il controllo dell’assorbimento degli aminoacidi Modifica dell’attività di numerosi enzimi.
Regolatore del metabolismo degli endocannabinoidi. L’insulina è un importante regolatore del metabolismo degli endocannabinoidi (CE) e il trattamento con insulina ha dimostrato di ridurre i CE intracellulari, il 2-arachidonilglicerolo (2-AG) e l’anandamide (AEA), che corrispondono a cambiamenti di espressione sensibili all’insulina negli enzimi del metabolismo CE. Negli adipociti insulino-resistenti, i modelli di espressione degli enzimi indotti dall’insulina sono disturbati in modo coerente con un’elevata sintesi della CE e una ridotta degradazione della CE. I risultati suggeriscono che gli adipociti insulino-resistenti non riescono a regolare il metabolismo della CE e a diminuire i livelli intracellulari della CE in risposta alla stimolazione dell’insulina, per cui gli individui insulino-resistenti obesi mostrano concentrazioni aumentate di CE. Questa disregolazione contribuisce all’eccessivo accumulo di grasso viscerale e al ridotto rilascio di adiponectina dal tessuto adiposo addominale, e inoltre all’insorgenza di diversi fattori di rischio cardiometabolico che sono associati all’obesità e al diabete di tipo 2.
1- Voet D, Voet JG (2011). Biochimica (4th ed.). New York: Wiley.
2-Gisela Wilcox (2005) Insulina e resistenza all’insulina, Clin Biochem Rev. 2005 maggio; 26(2): 19-39.
3- Rhoades RA, Bell DR (2009). Fisiologia medica: principi per la medicina clinica (3rd ed.). Filadelfia: Lippincott Williams & Wilkins. pp. 644-47.
4-Gerich JE (febbraio 2002). “È ridotto rilascio di insulina di prima fase la prima anomalia rilevabile in individui destinati a sviluppare il diabete di tipo 2?”. Diabete. 51 (Suppl 1): S117–21. doi:10.2337/diabetes.51.2007.s117. PMID 11815469.
5- Lorenzo C, Wagenknecht LE, Rewers MJ, Karter AJ, Bergman RN, Hanley AJ, Haffner SM (settembre 2010). “Indice di disposizione, l’efficacia del glucosio e la conversione al diabete di tipo 2: l’Insulin Resistance Atherosclerosis Study (IRAS)”. Diabete
6- Un dizionario delle unità di misura Archiviato 2013-10-28 alla Wayback Machine. Da Russ Rowlett, l’Università del North Carolina a Chapel Hill. June 13, 2001
7- Iwase H, Kobayashi M, Nakajima M, Takatori T (gennaio 2001). “Il rapporto tra insulina e C-peptide può essere usato per fare una diagnosi forense di sovradosaggio di insulina esogena”. Forensic Science International. 115 (1-2): 123-27. doi:10.1016/S0379-0738(00)00298-X. PMID 11056282.
8- Xiang Z (giugno 2006). “Progressi nella modellazione della struttura della proteina omologia”. Current Protein & Scienza dei peptidi. 7 (3): 217-27. doi:10.2174/138920306777452312. PMC 1839925. PMID 16787261.
9- Zagrovic B, Neve CD, Shirts MR, Pande VS (novembre 2002). “Simulazione del ripiegamento di una piccola proteina alfa-elica in dettaglio atomistico utilizzando il calcolo distribuito a livello mondiale”. Journal of Molecular Biology. 323 (5): 927-37.
10-D’Eon TM, Pierce KA, Roix JJ, Tyler A, Chen H, Teixeira SR (maggio 2008). “Il ruolo della resistenza all’insulina degli adipociti nella patogenesi dell’obesità correlati elevazioni di endocannabinoidi”. Diabete. 57 (5): 1262-68.
11- Di Marzo V (agosto 2008). “Il sistema endocannabinoide nell’obesità e nel diabete di tipo 2”. Diabetologia. 51 (8): 1356-67. doi:10.1007/s00125-008-1048-2. PMID 18563385.