Nome generico: fluocinonide
Forma farmaceutica: Gel
Medicamente rivisto da Drugs.com. Ultimo aggiornamento il 22 giugno 2020.
- Panoramica
- Effetti collaterali
- Dosaggio
- Professionale
- Interazioni
- Più
Solo Rx
Il marchio Lidex è stato sospeso negli Stati Uniti.Se le versioni generiche di questo prodotto sono state approvate dalla FDA, potrebbero essere disponibili equivalenti generici.
- Descrizione Lidex
- Lidex – Farmacologia clinica
- Farmacocinetica
- Indicazioni e uso per Lidex
- Contraindicazioni
- Precauzioni
- Generale
- Informazioni per il paziente
- Test di laboratorio
- Carcinogenesi, mutagenesi e compromissione della fertilità
- Categoria di gravidanza C
- Madri che allattano
- Uso pediatrico
- Reazioni avverse
- Sovradosaggio
- Dosaggio e amministrazione di Lidex
- Come viene fornito Lidex
- Domande frequenti
- Più informazioni su Lidex (fluocinonide topico)
- Risorse dei consumatori
- Risorse professionali
- Guide correlate al trattamento
Descrizione Lidex
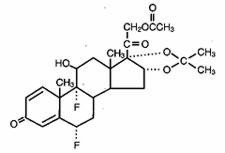
Lidex® (fluocinonide) Gel 0,05% è destinato alla somministrazione topica. Il componente attivo è il corticosteroide fluocinonide, che è l’estere 21-acetato del fluocinolone acetonide e ha il nome chimico pregna-1,4-diene-3,20-dione,21-(acetiloxy)-6,9-difluoro-11-hydroxy-16,17–,(6α,11β,16α)-. Ha la seguente struttura chimica:
Lidex Gel contiene fluocinonide 0,5 mg/g in una base gel appositamente formulata composta da carbomer 940, edetato disodico, gallato di popile, glicole propilenico, idrossido di sodio e/o acido cloridrico (per regolare il pH), e acqua (purificata). Questo veicolo tixotropico chiaro e incolore è senza grasso, non macchia e completamente miscibile con l’acqua.
In questa formulazione, il principio attivo è totalmente in soluzione.
Lidex – Farmacologia clinica
I corticosteroidi topici condividono azioni antinfiammatorie, antipruriginose e vasocostrittrici.
Il meccanismo dell’attività antinfiammatoria dei corticosteroidi topici non è chiaro. Vari metodi di laboratorio, compresi i test vasocostrittori, sono utilizzati per confrontare e prevedere le potenze e/o l’efficacia clinica dei corticosteroidi topici. Ci sono alcune prove che suggeriscono che esiste una correlazione riconoscibile tra la potenza del vasocostrittore e l’efficacia terapeutica nell’uomo.
Farmacocinetica
Il grado di assorbimento percutaneo dei corticosteroidi topici è determinato da molti fattori che includono il veicolo, l’integrità della barriera epidermica e l’uso di medicazioni occlusive.
I corticosteroidi topici possono essere assorbiti dalla pelle intatta normale. L’infiammazione e/o altri processi patologici nella pelle aumentano l’assorbimento percutaneo. Le medicazioni occlusive aumentano sostanzialmente l’assorbimento percutaneo dei corticosteroidi topici. Pertanto, le medicazioni occlusive possono essere un valido complemento terapeutico per il trattamento delle dermatosi resistenti (vedere DOSAGGIO E AMMINISTRAZIONE).
Una volta assorbiti attraverso la pelle, i corticosteroidi topici sono gestiti attraverso vie farmacocinetiche simili ai corticosteroidi somministrati per via sistemica. I corticosteroidi sono legati alle proteine plasmatiche in vari gradi. I corticosteroidi sono metabolizzati principalmente nel fegato e sono poi escreti dai reni. Alcuni dei corticosteroidi topici e i loro metaboliti sono anche escreti nella bile.
Indicazioni e uso per Lidex
Lidex Gel è indicato per il sollievo delle manifestazioni infiammatorie e pruritiche delle dermatosi corticosteroide-responsive.
Contraindicazioni
I corticosteroidi topici sono controindicati in quei pazienti con una storia di ipersensibilità a qualsiasi componente della preparazione.
Precauzioni
Generale
L’assorbimento sistemico di corticosteroidi topici ha prodotto soppressione reversibile dell’asse ipotalamo-ipofisi-surrene (HPA), manifestazioni della sindrome di Cushing, iperglicemia e glucosuria in alcuni pazienti.
Le condizioni che aumentano l’assorbimento sistemico includono l’applicazione degli steroidi più potenti, l’uso su grandi superfici, l’uso prolungato e l’aggiunta di medicazioni occlusive.
Pertanto, i pazienti che ricevono una grande dose di un potente steroide topico applicato su una grande superficie o sotto una medicazione occlusiva dovrebbero essere valutati periodicamente per la prova di soppressione dell’asse HPA utilizzando il cortisolo libero urinario e test di stimolazione ACTH. Se la soppressione dell’asse HPA è notato, un tentativo dovrebbe essere fatto per ritirare il farmaco, per ridurre la frequenza di applicazione, o per sostituire uno steroide meno potente.
Recupero della funzione dell’asse HPA è generalmente pronta e completa dopo la sospensione del farmaco. Raramente, segni e sintomi di astinenza da steroidi possono verificarsi, richiedendo corticosteroidi sistemici supplementari.
I bambini possono assorbire quantità proporzionalmente maggiori di corticosteroidi topici e quindi essere più suscettibili alla tossicità sistemica (vedere PRECAUZIONI-Uso pediatrico). Se si sviluppa un’irritazione, i corticosteroidi topici devono essere sospesi e deve essere istituita una terapia appropriata.
Come per qualsiasi prodotto corticosteroideo topico, l’uso prolungato può produrre atrofia della pelle e dei tessuti sottocutanei. Quando usato su aree intertriginose o flessorie, o sul viso, questo può verificarsi anche con l’uso a breve termine.
In presenza di infezioni dermatologiche, l’uso di un appropriato agente antifungino o antibatterico dovrebbe essere istituito. Se una risposta favorevole non si verifica immediatamente, il corticosteroide deve essere interrotto fino a quando l’infezione è stata adeguatamente controllata.
Informazioni per il paziente
I pazienti che utilizzano corticosteroidi topici devono ricevere le seguenti informazioni e istruzioni:
- Questo farmaco deve essere usato come indicato dal medico. È solo per uso esterno. Evitare il contatto con gli occhi.
- I pazienti devono essere avvisati di non usare questo farmaco per qualsiasi disturbo diverso da quello per cui è stato prescritto.
- L’area cutanea trattata non deve essere fasciata o altrimenti coperta o avvolta in modo da essere occlusiva a meno che non sia diretto dal medico.
- I pazienti devono riferire qualsiasi segno di reazioni avverse locali, specialmente sotto la medicazione occlusiva.
- I genitori dei pazienti pediatrici devono essere avvisati di non usare pannolini aderenti o pantaloni di plastica su un bambino trattato nella zona del pannolino, come questi indumenti possono costituire medicazioni occlusive.
Test di laboratorio
I seguenti test possono essere utili nella valutazione della soppressione dell’asse HPA:
Test del cortisolo libero urinario
Test di stimolazione dell’ACTH
Carcinogenesi, mutagenesi e compromissione della fertilità
Studi a lungo termine sugli animali non sono stati eseguiti per valutare il potenziale cancerogeno o l’effetto sulla fertilità dei corticosteroidi topici.
Gli studi per determinare la mutagenicità con prednisolone e idrocortisone hanno rivelato risultati negativi.
Categoria di gravidanza C
I corticosteroidi sono generalmente teratogeni negli animali da laboratorio quando somministrati per via sistemica a livelli di dosaggio relativamente bassi. I corticosteroidi più potenti hanno dimostrato di essere teratogeni dopo applicazione cutanea in animali da laboratorio. Non ci sono studi adeguati e ben controllati in donne incinte sugli effetti teratogeni dei corticosteroidi applicati per via topica. Pertanto, i corticosteroidi topici dovrebbero essere usati durante la gravidanza solo se il potenziale beneficio giustifica il potenziale rischio per il feto. I farmaci di questa classe non dovrebbero essere usati estensivamente su pazienti incinte, in grandi quantità, o per periodi prolungati di tempo.
Madri che allattano
Non è noto se la somministrazione topica di corticosteroidi potrebbe risultare in un assorbimento sistemico sufficiente a produrre quantità rilevabili nel latte materno. I corticosteroidi somministrati per via sistemica sono secreti nel latte materno in quantità tali da non avere un effetto deleterio sul bambino. Tuttavia, cautela deve essere esercitata quando i corticosteroidi topici sono somministrati a una donna che allatta.
Uso pediatrico
I pazienti pediatrici possono dimostrare una maggiore suscettibilità alla soppressione dell’asse HPA indotta dai corticosteroidi topici e alla sindrome di Cushing rispetto ai pazienti maturi a causa di una maggiore superficie cutanea rispetto al rapporto peso corporeo.
La soppressione dell’asse ipotalamo-ipofisi-surrene (HPA), la sindrome di Cushing e l’ipertensione intracranica sono stati riportati nei bambini che ricevono corticosteroidi topici. Manifestazioni di soppressione surrenale nei bambini includono ritardo di crescita lineare, aumento di peso ritardato, bassi livelli di cortisolo nel plasma e assenza di risposta alla stimolazione ACTH. Manifestazioni di ipertensione intracranica includono fontanelle rigonfie, mal di testa e papilledema bilaterale.
La somministrazione di corticosteroidi topici ai bambini dovrebbe essere limitata alla quantità minima compatibile con un regime terapeutico efficace. La terapia cronica con corticosteroidi può interferire con la crescita e lo sviluppo dei bambini.
Reazioni avverse
Le seguenti reazioni avverse locali sono riportate raramente con corticosteroidi topici, ma possono verificarsi più frequentemente con l’uso di medicazioni occlusive. Queste reazioni sono elencate in un ordine approssimativamente decrescente di occorrenza:
| Bruciore | Dermatite periorale |
| Prude | Dermatite allergica da contatto |
| Irritazione | Macerazione della pelle |
| Secchezza | Infezione secondaria |
| Follicolite | Atrofia della pelle |
| Ipertricosi | Striae |
| Eruzioni acneiformi | Miliaria |
| Ipopigmentazione |
Sovradosaggio
I corticosteroidi applicati topicamente possono essere assorbiti in quantità sufficiente per produrre effetti sistemici (vedi PRECAUZIONI).
Dosaggio e amministrazione di Lidex
Lidex Gel viene generalmente applicato all’area interessata come una pellicola sottile da due a quattro volte al giorno a seconda della gravità della condizione.
La medicazione occlusiva può essere utilizzata per la gestione della psoriasi o condizioni recalcitranti.
Se si sviluppa un’infezione, l’uso di medicazioni occlusive deve essere interrotto e deve essere istituita una terapia antimicrobica adeguata.
Come viene fornito Lidex
Lidex® (fluocinonide) Gel 0.05% è fornito in
tubo da 15 g – NDC 99207-507-13
tubo da 30 g – NDC 99207-507-14
tubo da 60 g – NDC 99207-507-17
conservare a temperatura ambiente 15°-30°C (59°-86°F).
Prodotto per:
MEDICIS, The Dermatology Company®
Scottsdale, AZ 85258
Aprile 2001
IN-5071/S
| Lidex fluocinonide gel |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
Etichettatore – MEDICIS
Domande frequenti
- Si usa per la perdita dei capelli?
- Qual è un sostituto della fluocinonide in crema?
- La fluocinonide è una crema antifungina?
- Per quanto tempo si deve usare la fluocinonide?
- A cosa serve la fluocinonide in crema?
- La fluocinonide può essere usata per trattare un’eruzione da edera velenosa?
- È uno steroide?
- È un antibiotico?
Più informazioni su Lidex (fluocinonide topico)
- Effetti collaterali
- Durante la gravidanza o l’allattamento
- Informazioni sul dosaggio
- Interazioni farmacologiche
- 8 recensioni
- Disponibilità generica
- Classe del farmaco: steroidi topici
Risorse dei consumatori
- Lettura avanzata
- Lidex Mild (lettura avanzata)
- Lidex Regular (lettura avanzata)
Risorse professionali
- Informazioni sulla prescrizione
- Soluzione topica Lidex (FDA)
- Unguento Lidex (FDA)
Altre marche Vanos, Lidex-E
Guide correlate al trattamento
- Dermatite atopica
- Eczema
- Dermatite
- Psoriasi
Discorso medico