General Overview
Una grande frazione di microorganismi non solo risiede dentro di noi ma vive anche su di noi. Infatti, la pelle umana ospita un mix eterogeneo di batteri, funghi e virus per lo più non patogeni che probabilmente contribuiscono alla salute della superficie della pelle (Figura 1). Il Propionibacterium acnes (P. acnes) è un anaerobo Gram-positivo ubiquitario, a crescita lenta, a forma di bastoncello, che non forma spore (Figura 2), presente in tutti i siti del corpo, compresi i follicoli sebacei del viso e del collo (Funke et al., 1997; Grice e Segre, 2011; Findley e Grice, 2014). È spesso considerato parte del nostro microbiota commensale nei siti di barriera (Cogen et al., 2008) che si stabilisce attraverso meccanismi di tolleranza immunitaria adattativa durante il primo periodo neonatale (Scharschmidt et al., 2015). Sebbene la distribuzione topografica dell’anaerobo nei siti sebacei sia significativa, la distribuzione spaziale e personale di P. acnes è più individuale che sito-specifica (Oh et al., 2014). Inoltre, la biogeografia e l’individualità di P. acnes è altamente dinamica in quanto i cambiamenti di salute o le variazioni di pH, temperatura, umidità e/o contenuto di sebo possono anche influenzare la gamma di nicchie occupate dal microrganismo (Grice et al., 2009). Simile alla distribuzione dei microbi della pelle, le condizioni della pelle possono anche modellare la funzione del P. acnes in termini di espansione del patogeno nella malattia. Per esempio, P. acnes è stato collegato a insulti cutanei come l’acne vulgaris nel viso e nel collo, e l’ipermelanosi maculare progressiva sulla schiena (Bojar e Holland, 2004; Kurokawa et al., 2009; Barnard et al., 2016). Inoltre, alcuni fenotipi di P. acnes associati a malattie hanno la capacità di persistere su impianti corporei e dispositivi chirurgici causando una vasta gamma di condizioni infettive post-operatorie, come endocarditi, endoftalmiti e infezioni del sistema nervoso intravascolare (Perry e Lambert, 2011; Portillo et al., 2013). Le caratteristiche spiacevoli di P. acnes si estendono anche alla ghiandola prostatica dove l’invasione dei tessuti e la deposizione intracellulare del batterio è stata frequentemente notata nelle cellule epiteliali ghiandolari e nei macrofagi circolanti; un fenomeno che si pensa possa contribuire indirettamente all’iperplasia prostatica benigna (BPH) e al cancro alla prostata (Tanabe et al, 2006; Alexeyev et al., 2007; Fassi-Fehri et al., 2011; Mak et al., 2012; Bae et al., 2014; Davidsson et al., 2016). Tuttavia, non è chiaro quali siano i meccanismi sottostanti utilizzati da P. acnes per indurre infezione, infiammazione e/o metastasi al di fuori della pelle. Ciò che è noto con una certa certezza è che i cheratinociti, i sebociti e/o gli adipociti infettati dai batteri secernono diverse chemochine e citochine pro-infiammatorie, nonché fattori antimicrobici (ad es, cathelicidin) che suggeriscono meccanismi specifici di malattia (Graham et al., 2004; Nagy et al., 2006; Lee et al., 2010; Zhou et al., 2015; Sanford et al., 2016; Yu et al., 2016).
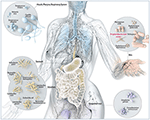
Figura 1. Illustrazione schematica dei microbi comuni che si trovano nei siti di barriera negli esseri umani, compreso P. acnes. Mentre il P. acnes è presente su tutte le superfici esterne e interne (cioè, epitelio orale e gastrointestinale, congiuntiva), è più prevalente sulla pelle umana. Lì risiede nei follicoli piliferi del viso e della schiena, dove è associato alla comune malattia della pelle, l’acne vulgaris. Per la maggior parte, P acnes è ancora considerato un microrganismo per lo più benigno e commensale, tuttavia, i rapporti sul suo lato opportunistico maligno sono in aumento. Adattato e con gentile permesso da Bryan Christie Design (http://bryanchristiedesign.com/).
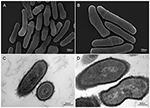
Figura 2. Immagini al microscopio elettronico a scansione e a trasmissione (SEM e TEM) del ceppo KPA di P. acnes (A, B = SEM; C, D = TEM). I recenti progressi nelle tecniche di isolamento e di coltura stanno rivelando che le infezioni da P. acnes sono state grossolanamente sottovalutate, gettando una nuova luce su questa specie batterica opportunista. Microscopia di Volker Brinkmann, Max Planck Institute for Infection Biology, Berlino, Germania. Barra della scala = 200/300nm.
Sarcoidosi
La sarcoidosi è una malattia di eziologia sconosciuta che porta all’infiammazione di organi diversi come polmoni, fegato, pelle e linfatici. Un collegamento putativo della sarcoidosi con P. acnes fu proposto per la prima volta quando il batterio fu isolato da lesioni sarcoidi della pelle e dei linfonodi (Eishi et al., 2002; Yamada et al., 2002). Questi risultati sono stati significativamente confermati (de Brouwer et al., 2015), e ulteriormente ampliati da vari esperimenti in vitro che dimostrano la capacità di invasione di P. acnes in linee cellulari HEK293T (rene embrionale umano) e A549 (carcinoma epiteliale alveolare umano) (Tanabe et al., 2006). Il lavoro più recente nel liquido di lavaggio bronco-alveolare (BAL) e nelle cellule sarcoidi ha mostrato una significativa upregulation di una risposta immunitaria specifica per P. acnes (Schupp et al., 2015). Inoltre, gli esperimenti sui topi hanno dimostrato che il P. acnes vitale può indurre granulomi polmonari simili a quelli osservati nei pazienti con sarcoidosi (Werner et al., 2017). Una panoramica generale che dettaglia il legame tra sarcoidosi e P. acnes è ulteriormente fornita da Eishi (2013).
Gli studi che tentano di caratterizzare le vie di segnalazione attivate da P. acnes durante l’infezione hanno mostrato che il fattore nucleare-kappaB , un fattore trascrizionale che regola l’espressione dei geni coinvolti nelle cascate immunitarie e infiammatorie è attivato da P. acnes (Kim et al., 2002). Più in generale, è stato dimostrato che il recettore toll-like 2 (TLR2) è un recettore critico per la risposta NF-κB-dipendente a P. acnes, rivelando la capacità di questo batterio di provocare l’attivazione selettiva dei geni dell’immunità innata (Inohara e Nuñez, 2001; Chamaillard et al., 2003; Moreira e Zamboni, 2012). Inoltre, il ruolo della genetica dell’ospite è stato esaminato nei casi di sarcoidosi che erano associati all’infezione da P. acnes. I polimorfismi a singolo nucleotide (SNPs) nel dominio di oligomerizzazione a legame nucleotidico (NOD) delle proteine NOD1 e NOD2 sono stati correlati all’infezione da P. acnes tra 73 pazienti con sarcoidosi e 52 polmoniti interstiziali e 215 controlli sani (Tanabe et al., 2006). NOD1 e NOD2 sono recettori intracellulari di riconoscimento del modello che possono percepire le molecole batteriche come i peptidoglicani. Sulla stessa linea, esperimenti in vitro hanno dimostrato che l’internalizzazione di P. acnes in cellule HEK293T può provocare l’attivazione di NOD1 e NOD2, suggerendo un meccanismo di malattia basato su infiammazione cronica o immunosoppressione locale (Tanabe et al., 2006). Questi risultati suggeriscono anche che il P. acnes invasivo può agire come ligando batterico per causare l’attivazione aberrante del recettore NOD in alcuni individui con una suscettibilità di lunga durata alla sarcoidosi. Tuttavia, gli esperimenti futuri devono chiarire l’esatta cronologia meccanicistica di se o come l’attivazione aberrante di NF-κB mediata da P. acnes può indurre la formazione del granuloma in un modo NOD1/NOD2-dipendente.
Anche se il P. acnes invasivo potrebbe essere una possibile eziologia della sarcoidosi e forse di altre malattie, chiarire la causalità e la correlazione tra P. acnes e la patologia è oscura in quanto l’eterogeneità del ceppo batterico, la genetica dell’ospite così come gli ambienti dell’ospite devono essere considerati ogni volta che uno studio collega un microbioma ad uno stato di malattia.
Iperplasia prostatica benigna (BPH) e cancro alla prostata
I processi infiammatori cronici o ricorrenti sono stati a lungo implicati nella progressione di BPH e cancro alla prostata (De Marzo et al., 1999; Nelson et al., 2004; Sfanos et al., 2014). L’infiammazione è attribuita alla presenza di biomarcatori specifici come l’elevata interleuchina (IL)-6, il fattore di necrosi tumorale alfa (TNFα) e la proteina della fase acuta, la proteina C reattiva (Mechergui et al., 2009; Menschikowski et al., 2013; Yu et al., 2015). Lavori recenti sui fluidi urologici (cioè, urina, liquido seminale, secrezioni prostatiche) così come le biopsie prostatiche suggeriscono un significativo spostamento condizionale verso alcune specie microbiche che possono essere utilizzate come indice diagnostico (Yu et al., 2015; Ni et al, 2016).
Una buona quantità di lavori sta suggerendo che la specifica associazione di P. acnes con la prostata e l’invasione delle cellule epiteliali prostatiche in particolare (Figura 3) possa contribuire alla patologia dell’IPB o del cancro alla prostata con una componente infiammatoria (Sfanos et al., 2013; Davidsson et al., 2016). Tuttavia, attualmente non è chiaro se P. acnes rappresenti un vero agente infettivo della prostata, un commensale o un microbione prostatico accidentale. È plausibile che i P. acnes localizzati nella prostata siano derivati dalla pelle introdotti accidentalmente, per esempio durante una biopsia prostatica – un punto di vista che dovrebbe sollevare preoccupazioni per alcuni scenari di workup diagnostico.
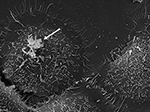
Figura 3. SEM di P. acnes ceppo P6 (freccia) in vitro su cellule epiteliali prostatiche coltivate RWPE1. Il comportamento invasivo delle cellule epiteliali della prostata di P. acnes è ben documentato sia in studi in vivo che su cellule, dove un processo di invasione mediato dalla vimentina sembra probabile (Mak et al., 2012). Microscopia di Volker Brinkmann, Max Planck Institute for Infection Biology, Berlino, Germania. Barra della scala = 2 μm.
Qualunque sia la via di ingresso o il potenziale patogeno, un numero significativo di tessuti prostatici ottenuti tramite resezione transuretrale per IPB, o prostatectomia radicale per cancro, sono stati precedentemente testati positivi per aggregati di P. acnes apparentemente residenti all’interno di macrofagi vaganti (Alexeyev et al., 2007; Bae et al., 2014). Ulteriori rapporti basati su campioni umani hanno fornito ulteriori prove di un legame tra BPH o cancro alla prostata e P. acnes utilizzando vari approcci tecnici, tra cui la coltivazione, la microscopia confocale per la visualizzazione del batterio e l’ibridazione in situ, l’immunoistochimica (Figura 4) e il profiling basato sulla PCR del 16S rRNA batterico (Hochreiter et al., 2000; Cohen et al., 2005; Sfanos et al., 2008; Fassi-Fehri et al., 2011; Bae et al., 2014; Davidsson et al., 2016). Ulteriori prove provengono da studi su animali che indicano che l’inoculazione di P. acnes nella prostata e nella vescica murina o di ratto porta a una risposta infiammatoria manifesta e a lungo termine e a una vasta gamma di disturbi cellulari all’interno della ghiandola prostatica (Olsson et al., 2012; Shinohara et al., 2013).
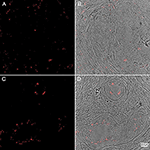
Figura 4. Immunoistochimica di campioni di tessuto prostatico umano colorati con l’anticorpo P. acnes (rosso). Adattato con il permesso di Fassi-Fehri et al., 2011 (Figura supplementare 2B). Presenza di P. acnes in campioni di tessuto prostatico umano con iperplasia prostatica benigna (A, B); o adenocarcinoma (C, D). In entrambi i casi è stata rilevata un’estesa carica batterica.
I tentativi di analizzare filogeneticamente i ceppi di P. acnes associati alla malattia dalle ghiandole prostatiche cancerose hanno rivelato che la maggior parte degli isolati prostatici appartiene a cladi filogenetiche che sono rare sulla pelle umana, indicando che una contaminazione derivata dalla pelle durante il campionamento è improbabile (Mak et al., 2013; Davidsson et al., 2016). Sulla stessa linea, percorsi infiammatori simili a quelli descritti per la sarcoidosi, tra cui NF-κB, IL-6, STAT3 e COX2, sembrano essere attivati da P. acnes sia in condizioni in situ che in vitro (Drott et al., 2010; Fassi-Fehri et al., 2011; Mak et al., 2013; Tsai et al., 2013; Bae et al., 2014). Anche se l’eziologia precisa di questi cambiamenti infiammatori non è ancora chiara, diverse vie di recettori di riconoscimento dei modelli legati alla membrana sono ampiamente distribuite nei sistemi urinari e genitali dei mammiferi che riconoscono avidamente componenti batteriche e virali (Jorgensen e Seed, 2012; Gambara et al., 2013). Questi recettori delle cellule ospiti, per esempio i TLR, promuovono la produzione di citochine che è una caratteristica fondamentale dell’immunità innata contro i patogeni microbici. Collettivamente, questi risultati suggeriscono che attraverso la loro capacità di innescare vari aspetti dell’immunità, i P. acnes invasori possono agire come driver primario e/o amplificatore della gravità della malattia.
Spondilodiscite e mal di schiena
Una delle diverse complicazioni post-operatorie che coinvolgono P. acnes è l’infiammazione del disco intervertebrale e lo spazio intervertebrale circostante (diskite) dopo la discectomia (Harris et al., 2005). L’infezione degenerativa concomitante delle vertebre adiacenti (spondilodiscite) può essere una caratteristica comune e la causa principale di gravi danni neurologici e dolore se il trattamento è ritardato (Uçkay et al., 2010). Oltre all’introduzione chirurgica involontaria proprio nella colonna vertebrale, gli agenti patogeni possono arrivare anche attraverso l’apporto di sangue arterioso e venoso spinale (diffusione ematogena). Mentre Staphylococcus aureus, Escherichia coli e Proteus sono le specie più comunemente isolate, P. acnes è il patogeno anaerobico più abbondante in questo contesto e probabilmente sottovalutato a causa delle difficoltà di coltura. Ci sono state alcune prove cliniche che i pazienti con ernia nucleare (nucleus pulposus) del disco infettati da patogeni anaerobici in generale, e P. acnes in particolare, hanno maggiori probabilità di sviluppare infiammazione ed edema delle vertebre adiacenti (Modic changes tipo I) e dolore alla schiena (Albert et al., 2013; Urquhart et al., 2015). I follow-up clinici e su animali stanno ora corroborando i risultati iniziali che mostrano che la proliferazione locale di P. acnes causa l’upregulation dei marcatori infiammatori e la degenerazione del disco coerente con i cambiamenti Modic (Aghazadeh et al., 2016; Dudli et al., 2016). C’è ora anche una prima evidenza clinica che suggerisce che l’infezione batterica del disco intervertebrale con P. acnes e/o Staphylococcus epidermidis può effettivamente precedere tutti gli altri problemi come causa principale di ernia del disco e cambiamenti patologici associati (Rajasekaran et al., 2017).
Malattia di Parkinson (PD)
Il cervello degenerante è caratterizzato da danni al sistema neurale che possono essere attribuiti all’aggregazione atipica e alla deposizione di proteine mutanti o mal ripiegate (ad esempio, corpi di Lewy e neuriti di Lewy) come chiaramente documentato nella PD idiopatica (Taylor et al., 2002). Ciò che generalmente non viene apprezzato è che il cervello è anche suscettibile di invadere agenti patogeni che vanno da virus e batteri a funghi. Questi agenti patogeni, o più specificamente i loro componenti endogeni e/o metaboliti, possono produrre deficit neurologici centrali che vanno da sottili segni di demenza e distonia, che derivano da un’infezione cronica e ricorrente (De Chiara et al., 2012; Bibi et al., 2014), a più gravi malattie del motoneurone come per esempio osservato con il retrovirus endogeno umano K (Li et al., 2015). Quindi, è chiaro che gli esseri umani hanno un carico sistemico tremendamente pesante di microbi (Potgieter et al., 2015; Spadoni et al., 2015) che possono incidentalmente contribuire alla patologia delle malattie neurodegenerative progressive con componente proteica atipica. Certamente, questa ipotesi di lavoro sta guadagnando un notevole sostegno in quanto i comportamenti cognitivi, emotivi o patologici sembrano essere indirettamente influenzati dalla distribuzione spaziale e personale dei microbi che agiscono attraverso l’asse intestino-cervello (Figura 5) (Collins et al., 2012; Dinan et al., 2013; Mayer et al., 2014; Burokas et al., 2015). Infatti, un recente studio caso-controllo ha dimostrato che la variazione microbica nel tratto gastrointestinale, sia tra gli individui che all’interno degli stessi, corrisponde più significativamente alle variazioni fenotipiche nel PD (Scheperjans et al., 2015; Vizcarra et al., 2015). Anche se i meccanismi sottostanti che collegano la composizione del microbiota con le differenze nel PD non sono chiari, la scoperta di cui sopra potrebbe almeno spiegare l’alta prevalenza di anomalie gastrointestinali viste nei pazienti PD (Dobbs et al., 2016). Collegando ulteriormente il microbiota alla gravità del PD, le biopsie della mucosa sigmoidea e il materiale fecale raccolto da pazienti con PD hanno mostrato la presenza di specie batteriche opportunistiche e pro-infiammatorie che spesso causano costipazione cronica, sindrome dell’intestino irritabile e colite ulcerosa (Keshavarzian et al., 2015). Collettivamente, questi risultati iniziali suggeriscono che le relazioni tra diverse comunità microbiche nell’intestino sono una comorbidità comune nel PD, e che le firme individuali uniche dell’ecosistema intestinale possono rafforzare i classici disturbi motori del PD.
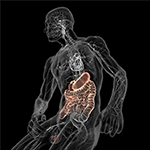
Figura 5. Illustrazione schematica dell’asse intestino-cervello (colorato) con il sistema digestivo pieno di microbi da un lato e il cervello con i suoi centri di omeostasi (ipotalamo e ipofisi) dall’altro. Entrambi sono collegati attraverso il sistema nervoso cardiovascolare e autonomo, compreso il nervo vago (nervo cranico X) che potrebbe facilitare la transizione microbica nel sistema nervoso centrale (SNC). Gentilmente con il permesso di Bryan Christie Design (http://bryanchristiedesign.com/).
In questo contesto, la domanda da porsi è se ci sono prove che P. acnes gioca un ruolo nella fisiopatologia del PD. Perché questa possibilità si verifichi, devono essere soddisfatte due condizioni: (1) l’infezione da P. acnes deve precedere la comparsa dei sintomi classici della malattia come il tremore, l’avviamento motorio e la lentezza dei movimenti; e (2) l’inoculazione di P. acnes deve indurre sufficientemente i sintomi del PD e/o portare alla perdita di neuroni di proiezione della dopamina nel nucleo del mesencefalo noto come substantia nigra pars compacta. Finora, il nostro laboratorio ha rilevato cluster di P. acnes localizzato ai neuroni del mesencefalo e strutture corticali vicine di cervelli PD autopsied (Figura 6). Questa scoperta inaspettata aggiunge ulteriore credito di P. acnes indirettamente contribuendo a attacchi locali di infiammazione simili a quelli visti in sarcoidosi e BPH. Una questione aperta è la misura in cui P. acnes può migliorare indirettamente alcune caratteristiche patologiche del PD. Poiché il PD è un disturbo altamente eterogeneo, è improbabile che un meccanismo di malattia si applichi a tutti i fenotipi di PD. Tuttavia, è intrigante ipotizzare che i microbi della pelle residenti possano iniziare o amplificare la progressione della PD attraverso fattori infiammatori e/o di predisposizione genetica.

Figura 6. Immunoistochimica di campioni di tessuto del mesencefalo umano PD colorati per P. acnes (verde; A+B), microtubuli neuronali (MAP2; rosso; A) e nuclei (DAPI; blu; A+B). L’autofluorescenza della lipofuscina legata all’età è stata estinta con Sudan Black B. Presenza di P. acnes (freccia) nello spazio periplasmatico di un neurone umano (A) tra nucleo (n) e citoscheletro; o neutrofilo (B) con il suo caratteristico nucleo multilobato dentro un capillare del mesencefalo (Cap). Questi risultati sono tipici del PD e assenti nella maggior parte delle sezioni di controllo. I movimenti retrogradi lungo i nervi cranici, le microlesioni indotte da traumi, così come il sistema linfatico di recente scoperta, rappresentano potenziali vie microbiche nel SNC.
Se P. acnes può accedere alle cellule della dopamina nel mesencefalo, qual è la via più probabile di inoculazione e infezione? Anche se la pelle è fisicamente compartimentata dal cervello, l’inoculazione incrociata rimane un fattore di rischio. Per esempio, le narici potrebbero potenzialmente ospitare ceppi patogeni di P. acnes che poi si trasferirebbero al parenchima cerebrale per iperattivare i macrofagi locali chiamati microglia; un fenomeno che è una caratteristica costante della patologia del PD (rivista da Chao et al., 2014). Le ricerche sulle infezioni nosocomiali dimostrano che specie batteriche diverse come Pneumococcus sp. (Zwijnenburg et al., 2001) e Salmonella sp. (Bollen et al., 2008) vagano facilmente lungo il nervo olfattivo (nervo cranico 1; CN 1) e infine nel bulbo olfattivo. Un’altra potenziale via d’ingresso per i microbi nocivi o per le pericolose proteine mal ripiegate è il nervo vago (nervo cranico 10; CN 10). Infatti, in alcune circostanze, aggregati misfolded sotto forma di corpi di Lewy e neuriti di Lewy sembrano migrare dal nervo vago al cervello, fornendo ulteriori prove che batteri patogeni in associazione con proteine tossiche possano potenzialmente contribuire alla vulnerabilità neuronale selettiva (Holmqvist et al., 2014). È interessante notare che i nuclei cerebrali di CN 1 e CN 10 sono tra i primi siti a mostrare preferenzialmente la deposizione di corpi di Lewy e neuriti di Lewy nel corso della progressione del PD (Braak et al., 2004). Questa particolare osservazione non solo evidenzia una probabile via di ingresso dei batteri nel cervello, ma fornisce anche un potenziale meccanismo per l’osservazione che la vagotomia troncale diminuisce significativamente il rischio di PD (Svensson et al., 2015). Il legame tra trauma cranico e PD (Harris et al., 2013; Jafari et al., 2013; Pearce et al., 2015), insieme alla nozione di un microbioma ematico diversificato (Potgieter et al., 2015), implica un vasto potenziale di opportunismo patogeno quando si verificano violazioni traumatiche nella barriera ematoencefalica. Con la recente scoperta di un sistema linfatico cerebrale (glymphatic) (Iliff et al., 2012; Hitscherich et al., 2016) un’altra potenziale via di infezione cerebrale deve essere considerata.
Insieme, ci sono prove precliniche e alcune cliniche per implicare indirettamente P. acnes come una variabile indipendente che influenza l’incidenza o la gravità del PD. Questa evidenza è completata da rapporti che associano un grave disturbo della pelle, l’acne inversa, con la malattia di Alzheimer (Wang et al., 2010). Da una prospettiva terapeutica, la possibilità che il P. acnes guidi o amplifichi le caratteristiche principali del PD rappresenta una risorsa importante per gli approcci antibiotici alle malattie neurodegenerative. E dal punto di vista della ricerca, sarebbe degno di esaminare più da vicino i pazienti con disturbi della pelle per le prove di neuropatologia con insorgenza più precoce e un fenotipo di malattia più grave.
Future prospettive
La revisione presentata in questo articolo delinea un lato oscuro inaspettato di P. acnes rispetto alla patologia. La persistenza intracellulare di P. acnes è implicata nelle malattie dei polmoni e della ghiandola prostatica e forse del cervello. Questa è una chiara testimonianza della patogenicità dei batteri derivati dalla pelle in alcuni fenotipi di malattia. Ulteriori indagini dovranno concentrarsi su diverse domande incombenti nella biologia di P. acnes: (1) quali sono le interazioni cruciali di P. acnes nella suscettibilità alle malattie? (2) Quali sono i meccanismi utilizzati da P. acnes per influenzare la progressione della malattia? (3) Se alcune popolazioni di P. acnes possono aumentare la suscettibilità alla gravità della malattia, ci sono altre configurazioni di P. acnes che sono protettive? (4) Prova di concetto che l’infezione da P. acnes si associa direttamente alla patologia della malattia, o più specificamente, lo studio di concetto mostra la causalità o solo la correlazione? E infine (5) La patologia causata da P. acnes può essere trattata con la terapia antibiotica convenzionale e le applicazioni diagnostiche?
Contributi degli autori
JL, KER, JC, KR, CH, AM, HB, e GT hanno preparato il manoscritto. JL e MS hanno preparato le figure.
Finanziamento
Il finanziamento intramurale a JL è stato fornito dal NYIT College of Osteopathic Medicine.
Conflict of Interest Statement
Gli autori dichiarano che la ricerca è stata condotta in assenza di qualsiasi relazione commerciale o finanziaria che possa essere interpretata come un potenziale conflitto di interessi.