In questa serie, Colin Baker della Bedford School fornisce dimostrazioni spettacolari, progettate per catturare l’immaginazione dello studente. Le dimostrazioni sono facili da preparare, sicure da smaltire e funzionano.
Nulla tende a imprimere fatti chimici nella mente tanto quanto l’esibizione di esperimenti interessanti – Samuel Parkes, 1816
Nel settembre 1931, il chimico americano Wallace Carothers, lavorando nei laboratori della DuPont, riportò una ricerca su molecole ‘giganti’ chiamate polimeri basata sulla comprensione della struttura chimica della lana. Il suo lavoro si concentrò su una fibra chiamata semplicemente ’66’, un numero derivato dalla sua struttura molecolare. Nel 1935 nacque il nylon, la “fibra miracolosa”, che ebbe un enorme successo nel suo mercato iniziale, la calzetteria femminile. Quando gli Stati Uniti entrarono nella seconda guerra mondiale, nel dicembre 1941, il War Production Board destinò tutta la produzione di nylon all’uso militare, compresi i paracaduti e le gomme dei bombardieri B29.

Fonte: Colin Baker
La reazione tra decanedioil dicloruro e 1,6-diaminoesano
Un cloruro diacido in un solvente organico forma uno strato immiscibile con una diamina alifatica in acqua. All’interfaccia, dove le due soluzioni incolori si incontrano, si forma un polimero bianco a catena lunga. Questa pellicola di polimero può essere tirata dall’interfaccia e viene immediatamente sostituita man mano che viene rimossa. Se si smette di tirare, sembra che non accada nulla – la reazione si ferma, ma viene ripresa immediatamente quando si ricomincia a tirare. La reazione può avvenire per diverse ore.

Fonte: Colin Baker
Kit
- Cicloesano, 100cm3 (irritante, altamente infiammabile);
- Decanedioil dicloruro, 5.0cm3;
- Acqua distillata, 100cm3;
- Carbonato di sodio anidro, 10g;
- 1,6-diamminoesano, 5.0g;
- Due becher, 250cm3;
- Beaker, 5cm3;
- Pinzette;
- Bacchette di vetro.
Sicurezza
Il dicloruro di decanedioile e l’1,6-diaminoesano sono corrosivi. Sono dannosi se ingeriti o inalati, e a contatto con la pelle causano ustioni. Sono gravi irritanti. Il cicloesano è altamente infiammabile e irritante.
Procedura
Prepara le seguenti due soluzioni:
Soluzione A: dicloruro di decanedioile in cicloesano. Metti 100cm3 di cicloesano in un becher da 250cm3, aggiungi 5,0cm3 di dicloruro di decanedioile e mescola per scioglierlo. Questa soluzione si conserva per circa quattro settimane.
Soluzione B: 1,6-diaminoesano in carbonato di sodio acquoso. Metti 100cm3 di acqua distillata in un becher da 250cm3, aggiungi 10g di carbonato di sodio anidro e mescola per scioglierlo. Aggiungere 5.0g di 1,6-diaminoesano solido e mescolare per sciogliere.
Versate 2cm3 di soluzione A in un becher da 5cm3. Aggiungere con attenzione un volume uguale di soluzione B. La soluzione A contiene il solvente organico, è più densa dello strato acquoso e quindi è lo strato inferiore. Afferra la pellicola di poliammide (un solido bianco) che inizia a formarsi all’interfaccia di queste due soluzioni con una pinzetta e tirala lentamente fuori dal becher. Avvolgi la fibra intorno a una bacchetta di vetro e continua a tirare. Fermate il processo quando uno dei reagenti è esaurito.
Consigli speciali
Si deve fare attenzione quando si aggiunge la seconda soluzione per evitare di mescolarla. Dimostrate come la fibra può essere estratta in un filo continuo e poi organizzate una gara per vedere quale coppia di studenti può produrre la fibra più lunga. Dovrebbero essere in grado di produrre fino a 5m prima che la fibra si spezzi. Rapidamente si renderanno conto che hanno bisogno di aiuto per sostenere la fibra – divido la classe in due grandi gruppi armati ciascuno di bacchette di vetro. I miei studenti hanno prodotto fibre che superano i 30m, anche tentando di girare gli angoli. Dovrete limitare il volume massimo di ogni soluzione a 10cm3. Gli studenti devono indossare guanti ed evitare il contatto con la fibra. Se la fibra si rompe, allora dovrebbe essere avvolta in carta assorbente. Qualsiasi fuoriuscita deve essere ripulita con carta assorbente e messa nei rifiuti.
Obiettivi didattici
Le poliammidi sono polimeri in cui le unità ripetute sono tenute insieme da legami ammidici, -CO-NH-.
Nylon-6,10
Nylon-6,10 è fatto da due monomeri, uno contiene sei atomi di carbonio, l’altro 10 – da cui il nome. Il monomero a 10 carbonio è il dicloruro di decanedioile (ClOC(CH2)8 COCl), un cloruro acido con un gruppo -COCl ad ogni estremità. L’altro monomero è una catena di sei carboni con un gruppo amminico, -NH2, ad ogni estremità. Questo è 1,6-diamminoesano (H2 N(CH2)6 NH2, noto anche come esano-1,6-diammina).
Quando questi due composti polimerizzano, i gruppi amminico e acido si combinano, ogni volta con la perdita di una molecola di cloruro di idrogeno:
n ClOC-(CH2)8-COCl + n H2N-(CH2)6-NH2 → -(CO-(CH2)8-CONH-(CH2)6-NH)n – + n HCl
Questo processo di formazione del polimero che comporta la perdita di una piccola molecola è noto come polimerizzazione di condensazione.
Nylon-6,6
Questo polimero è fatto dalla condensazione di due molecole a sei carboni, acido esandioico e 1,6-diaminoesano. Nell’industria, il cicloesano è usato per fare entrambi i monomeri. Se il cicloesano viene ossidato, l’anello si apre ed entrambe le estremità della catena hanno un gruppo acido – si forma l’acido esandioico. Se questo acido viene neutralizzato con ammoniaca, si produce il sale di ammonio (NH4 OOCCH2 CH2 CH2 CH2 COONH4) che può essere disidratato (riscaldando a 350°C) e ridotto (usando H2/Ni) a 1,6-diamminoesano. La polimerizzazione di condensazione del diacido e della diammina avviene con la perdita di acqua:
n HOOC-(CH2)4 -COOH + n H2 N-(CH2)6 -NH2 → -(CO-(CH2)4 -CONH-(CH2)6 -NH)n – + n H2 O
Nylon-6
È possibile produrre nylon dal monomero singolo caprolattame (hexahydro-2H-azepin-2-one, 1).
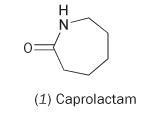
Il caprolattame contiene un legame ammidico interno. La polimerizzazione di questa molecola provoca l’apertura dell’anello e l’unione per formare una catena continua:
-(NH-(CH2)5 -CONH-(CH2)5 -CONH-(CH2)5 -CO)n –
Il nylon ha rivoluzionato l’industria tessile ed è stato il precursore di molte delle moderne fibre sintetiche. Rimane un materiale importante e ampiamente utilizzato nella produzione.