L’uso e l’importanza delle celle e delle batterie sono indiscutibili. Nella nostra vita quotidiana, facciamo uso di celle in tanti modi diversi. Ora, nei concetti passati, vi abbiamo già introdotto alle batterie in generale. Tuttavia, qui vi daremo un’analisi approfondita delle celle galvaniche. Quindi, cominciamo.
Video consigliati
Celle galvaniche
Tra le altre, una cella galvanica è un tipo di cella elettrochimica. È usata per fornire corrente elettrica facendo il trasferimento di elettroni attraverso una reazione redox. Una cella galvanica è un’idea esemplare di come l’energia può essere sfruttata usando semplici reazioni tra pochi elementi dati. È sorprendente studiare come una cella galvanica può essere impostata e utilizzata per ottenere energia.
Spiegando nei termini più semplici, una cella galvanica agisce come un dispositivo in cui avvengono reazioni simultanee di ossidazione e riduzione. Queste reazioni sono utilizzate per convertire l’energia chimica in energia elettrica, che può essere utilizzata per qualsiasi scopo commerciale.
Sfogliate altri argomenti sotto Elettrochimica
- Batterie
- Conduzione di soluzioni elettrolitiche
- Corrosione
- Celle elettrochimiche
- Celle elettrolitiche ed elettrolisi
- Celle a combustibile
- Equazione di Nernst
- Variazione della conducibilità e della conducibilità molare con la concentrazione
Funzionamento delle cellule galvaniche

Il funzionamento di una cella galvanica è abbastanza semplice. Comporta una reazione chimica che rende disponibile l’energia elettrica come risultato finale. Durante una reazione redox, una cella galvanica utilizza il trasferimento di energia tra gli elettroni per convertire l’energia chimica in energia elettrica.
La cella galvanica utilizza la capacità di separare il flusso di elettroni nel processo di ossidazione e riduzione, causando una mezza reazione e collegando ciascuno con un filo in modo che si possa formare un percorso per il flusso di elettroni attraverso tale filo. Questo flusso di elettroni è essenzialmente chiamato corrente. Tale corrente può essere fatta scorrere attraverso un filo per completare un circuito e ottenere la sua uscita in qualsiasi dispositivo come un televisore o un orologio.
Una cella galvanica può essere fatta con due metalli qualsiasi. Questi due metalli possono formare l’anodo e il catodo se lasciati in contatto tra loro. Questa combinazione permette la corrosione galvanica di quel metallo che è più anodico. È necessario un circuito di collegamento per permettere che questa corrosione abbia luogo.
Sistemazione di una cella galvanica
Per creare una cella galvanica, si dovrebbe procedere alla seguente configurazione. La cella dovrebbe idealmente includere due elettrodi. Uno di questi elettrodi, il catodo, sarà un elettrodo caricato positivamente mentre l’altro sarà l’anodo, l’elettrodo caricato negativamente.
Questi due elettrodi formeranno i due componenti essenziali della cella galvanica. La reazione chimica relativa alla riduzione avrà luogo al catodo mentre la mezza reazione di ossidazione avrà luogo all’anodo. Come già detto, due metalli qualsiasi possono essere usati per creare la reazione chimica.
Comprendere la cella galvanica con un esempio
Prendiamo un esempio in cui i due metalli coinvolti nella reazione chimica sono zinco e rame. Quando avviene la reazione chimica, lo zinco finisce per perdere due elettroni. Questo sarà assorbito dal rame per diventare rame elementare. Poiché questi due metalli saranno posti in due contenitori separati e saranno collegati da un filo conduttore, si formerà una corrente elettrica che trasferirà tutti gli elettroni da un metallo all’altro.
Al tempo stesso, i due metalli saranno immersi in una soluzione salina, diciamo, solfato di zinco e solfato di rame in questo caso. In questo caso, le due soluzioni non sono mescolate direttamente, ma possono essere unite tramite un ponte o un mezzo. Questo mezzo sarà responsabile del trasferimento degli ioni ma anche assicurarsi che le due soluzioni non vengano a mescolarsi tra loro.
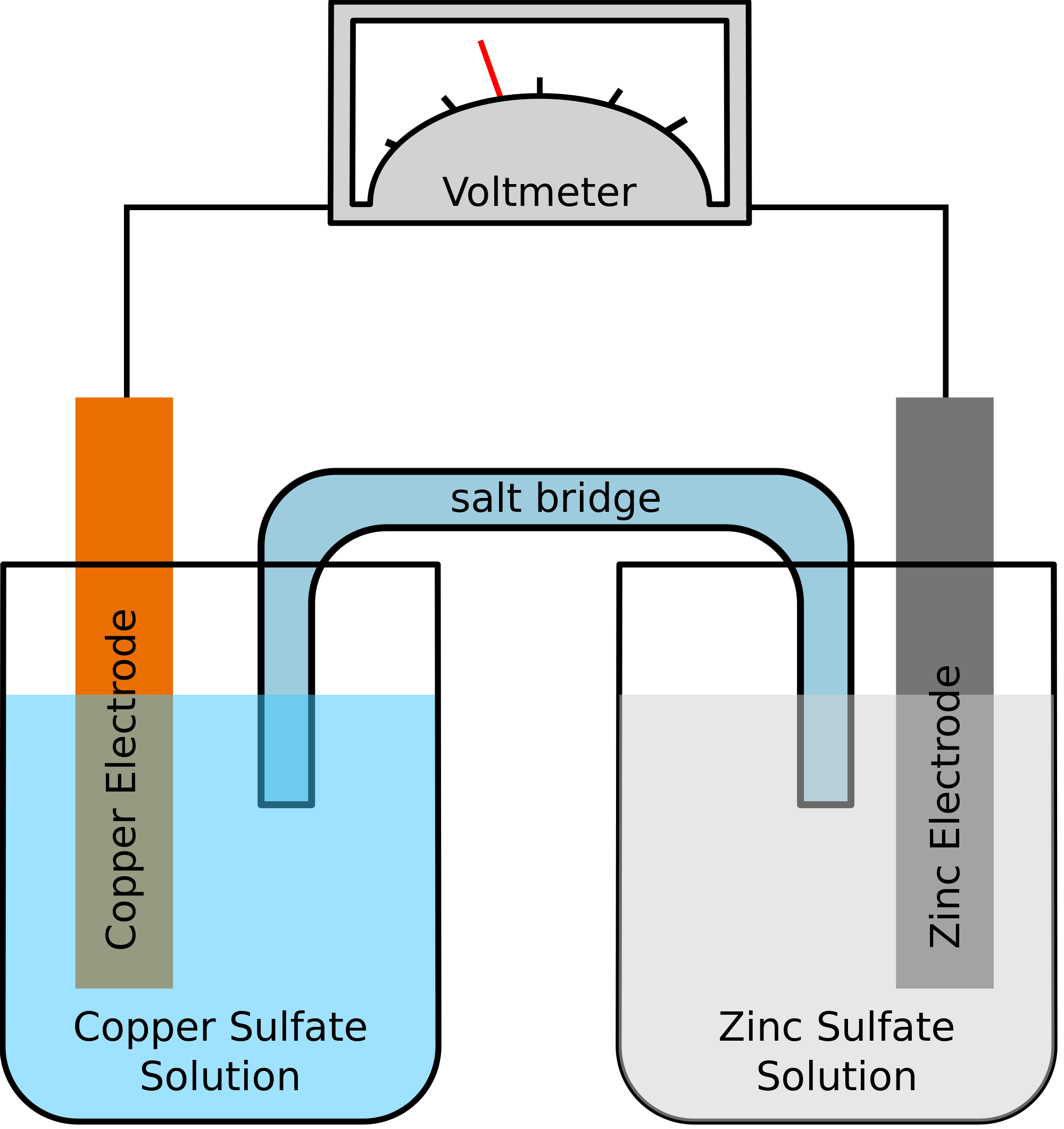
Tale ponte aiuta a completare il circuito per trasportare la carica elettrica e fa anche in modo che le soluzioni nei contenitori con i metalli rimangano neutre e non si mescolino tra loro. Finché il ponte salino non interferisce con la reazione redox, sotto la quale avvengono l’ossidazione e la riduzione, non importa quale ponte salino viene usato nella reazione chimica.
Alcuni termini importanti
Alcuni termini importanti utilizzati in una cella galvanica sono elencati di seguito:
- Limiti di fase: Si riferisce ai due metalli che agiscono come catodo e anodo.
- Ponte di sale: Il ponte di collegamento o il mezzo che permette a una reazione redox di avere luogo.
- Ossidazione e riduzione: I processi chimici che permettono alla corrente elettrica di formarsi e fluire attraverso una cella galvanica.
Esempi risolti per te
Domanda: In una cella galvanica, cosa succederebbe se non si usa un ponte di sale mentre avviene la reazione redox?
Soluzione: In assenza di un ponte salino all’interno di ogni contenitore contenente i metalli, la reazione redox inizierebbe più o meno allo stesso modo. Ma in assenza del ponte salino, la stessa finirebbe piuttosto bruscamente. Le rispettive soluzioni non saranno in grado di mantenere la loro neutralità elettrica. A parte questo, non ci sarà alcun cambiamento nella reazione chimica o alcuna alterazione di qualsiasi tipo a causa dell’assenza del ponte salino o del mezzo.