Questi cambiamenti conformazionali portano anche i residui catalitici nel sito attivo vicino ai legami chimici del substrato che saranno alterati nella reazione. Dopo il legame, uno o più meccanismi di catalisi abbassano l’energia dello stato di transizione della reazione, fornendo un percorso chimico alternativo per la reazione. Ci sono sei possibili meccanismi di catalisi “sopra la barriera” così come un meccanismo “attraverso la barriera”:
Prossimità e orientamentoModifica
Le interazioni enzima-substrato allineano i gruppi chimici reattivi e li tengono vicini in una geometria ottimale, che aumenta la velocità della reazione. Questo riduce l’entropia dei reagenti e quindi rende le reazioni di addizione o trasferimento meno sfavorevoli, poiché si ha una riduzione dell’entropia complessiva quando due reagenti diventano un unico prodotto. Tuttavia questo è un effetto generale e si vede nelle reazioni di non addizione o di trasferimento dove si verifica a causa di un aumento della “concentrazione effettiva” dei reagenti. Questo è compreso quando si considera come l’aumento della concentrazione porta all’aumento della velocità di reazione: essenzialmente quando i reagenti sono più concentrati, si scontrano più spesso e quindi reagiscono più spesso. Nella catalisi enzimatica, il legame dei reagenti all’enzima limita lo spazio conformazionale dei reagenti, tenendoli nel “giusto orientamento” e vicini l’uno all’altro, in modo che si scontrino più spesso, e con la geometria corretta, per facilitare la reazione desiderata. La “concentrazione efficace” è la concentrazione che il reagente dovrebbe avere, libero in soluzione, per sperimentare la stessa frequenza di collisione. Spesso tali concentrazioni teoriche effettive sono poco fisiche e impossibili da realizzare nella realtà – il che testimonia il grande potere catalitico di molti enzimi, con massicci aumenti di tasso rispetto allo stato non catalizzato.
Per esempio:
Reazioni simili avverranno molto più velocemente se la reazione è intramolecolare.

La concentrazione effettiva di acetato nella reazione intramolecolare può essere stimata come k2/k1 = 2 x 105 Molare.
Tuttavia, la situazione potrebbe essere più complessa, poiché i moderni studi computazionali hanno stabilito che i tradizionali esempi di effetti di prossimità non possono essere correlati direttamente agli effetti entropici degli enzimi. Inoltre, la proposta entropica originale è stata trovata per sovrastimare ampiamente il contributo dell’entropia di orientamento alla catalisi.
Donatori o accettatori di protoniModifica
Donatori e accettatori di protoni, cioè gli acidi e le basi possono donare e accettare protoni per stabilizzare le cariche in sviluppo nello stato di transizione. Questo è legato al principio generale della catalisi, quello di ridurre le barriere energetiche, poiché in generale gli stati di transizione sono stati ad alta energia, e stabilizzandoli si riduce questa alta energia, abbassando la barriera. Una caratteristica chiave della catalisi enzimatica rispetto a molte catalisi non biologiche, è che sia la catalisi acida che quella basica possono essere combinate nella stessa reazione. In molti sistemi abiotici, gli acidi (grandi) o le basi (lavandini di H+ a grande concentrazione, o specie con coppie di elettroni) possono aumentare la velocità della reazione; ma naturalmente l’ambiente può avere solo un pH complessivo (misura dell’acidità o della basicità (alcalinità)). Tuttavia, poiché gli enzimi sono grandi molecole, possono posizionare sia gruppi acidi che gruppi basici nel loro sito attivo per interagire con i loro substrati, e impiegare entrambe le modalità indipendentemente dal pH complessivo.
Spesso la catalisi generale acida o basica è impiegata per attivare gruppi nucleofili e/o elettrofili, o per stabilizzare i gruppi lascianti. Molti aminoacidi con gruppi acidi o basici sono impiegati nel sito attivo, come l’acido glutammico e aspartico, l’istidina, la cistina, la tirosina, la lisina e l’arginina, nonché la serina e la treonina. Inoltre, la spina dorsale del peptide, con gruppi N carbonilici e ammidici è spesso impiegata. La cistina e l’istidina sono molto comunemente coinvolte, poiché entrambe hanno un pKa vicino al pH neutro e possono quindi sia accettare che donare protoni.
Molti meccanismi di reazione che coinvolgono la catalisi acido/base assumono un pKa sostanzialmente alterato. Questa alterazione del pKa è possibile attraverso l’ambiente locale del residuo.
| Condizioni | Acidi | Basi |
|---|---|---|
| Ambiente idrofobico | Aumento pKa | Riduzione pKa |
| Residui adiacenti di carica simile | Aumento pKa | Riduzione pKa |
| Formazione di ponti di sale (e di legami a idrogeno ) |
Riduzione pKa | Aumento pKa |
pKa può anche essere influenzato significativamente dall’ambiente circostante, nella misura in cui i residui che sono basici in soluzione possono agire come donatori di protoni e viceversa.
Per esempio:
Triade catalitica di una serina proteasi
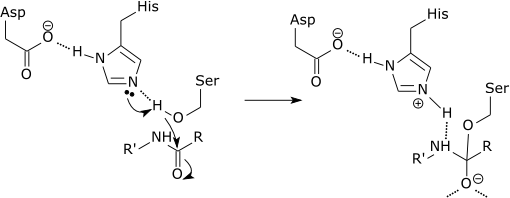
Il passo iniziale del meccanismo catalitico della serina proteasi coinvolge l’istidina del sito attivo che accetta un protone dal residuo serina. Questo prepara la serina come nucleofilo per attaccare il legame ammidico del substrato. Questo meccanismo include la donazione di un protone dalla serina (una base, pKa 14) all’istidina (un acido, pKa 6), resa possibile dall’ambiente locale delle basi.
È importante chiarire che la modifica dei pKa è una parte pura del meccanismo elettrostatico. Inoltre, l’effetto catalitico dell’esempio precedente è associato principalmente alla riduzione del pKa dell’ossianione e all’aumento del pKa dell’istidina, mentre il trasferimento di protoni dalla serina all’istidina non è catalizzato in modo significativo, poiché non è la barriera che determina il tasso.
Catalisi elettrostaticaModifica
La stabilizzazione degli stati di transizione carichi può avvenire anche tramite residui nel sito attivo che formano legami ionici (o interazioni di carica ionica parziale) con l’intermedio. Questi legami possono provenire da catene laterali acide o basiche che si trovano su aminoacidi come la lisina, l’arginina, l’acido aspartico o l’acido glutammico o provengono da cofattori metallici come lo zinco. Gli ioni metallici sono particolarmente efficaci e possono ridurre il pKa dell’acqua abbastanza da renderla un efficace nucleofilo.
Studi sistematici di simulazione al computer hanno stabilito che gli effetti elettrostatici danno, di gran lunga, il maggior contributo alla catalisi. Possono aumentare il tasso di reazione di un fattore fino a 107. In particolare, si è scoperto che l’enzima fornisce un ambiente più polare dell’acqua, e che gli stati di transizione ionici sono stabilizzati da dipoli fissi. Questo è molto diverso dalla stabilizzazione degli stati di transizione in acqua, dove le molecole d’acqua devono pagare con “energia di riorganizzazione”. Per stabilizzare gli stati ionici e carichi. Così, la catalisi è associata al fatto che i gruppi polari dell’enzima sono preorganizzati
L’ampiezza del campo elettrostatico esercitato dal sito attivo di un enzima è stato dimostrato essere altamente correlato con il miglioramento del tasso catalitico dell’enzima
Il legame del substrato di solito esclude l’acqua dal sito attivo, abbassando così la costante dielettrica locale a quella di un solvente organico. Questo rafforza le interazioni elettrostatiche tra i substrati carichi/polari e i siti attivi. Inoltre, gli studi hanno dimostrato che le distribuzioni di carica sui siti attivi sono disposte in modo da stabilizzare gli stati di transizione delle reazioni catalizzate. In diversi enzimi, queste distribuzioni di carica servono apparentemente a guidare i substrati polari verso i loro siti di legame in modo che i tassi di queste reazioni enzimatiche siano maggiori dei loro limiti apparenti controllati dalla diffusione.
Per esempio:
Meccanismo catalitico della carbossipeptidasi

L’intermedio tetraedrico è stabilizzato da un legame ionico parziale tra lo ione Zn2+ e la carica negativa dell’ossigeno.
Catalisi covalenteModifica
La catalisi covalente coinvolge il substrato che forma un legame covalente transitorio con residui nel sito attivo dell’enzima o con un cofattore. Questo aggiunge un ulteriore intermedio covalente alla reazione, e aiuta a ridurre l’energia degli stati di transizione successivi della reazione. Il legame covalente deve, in una fase successiva della reazione, essere rotto per rigenerare l’enzima. Questo meccanismo è utilizzato dalla triade catalitica di enzimi come le proteasi come la chimotripsina e la tripsina, dove si forma un intermedio acil-enzimatico. Un meccanismo alternativo è la formazione di basi di schiff usando l’ammina libera da un residuo di lisina, come visto nell’enzima aldolasi durante la glicolisi.
Alcuni enzimi utilizzano cofattori non aminoacidi come il fosfato piridossale (PLP) o la tiamina pirofosfato (TPP) per formare intermedi covalenti con molecole reagenti. Tali intermedi covalenti funzionano per ridurre l’energia degli stati di transizione successivi, in modo simile a come gli intermedi covalenti formati con i residui di aminoacidi del sito attivo permettono la stabilizzazione, ma le capacità dei cofattori permettono agli enzimi di realizzare reazioni che i residui laterali degli aminoacidi da soli non potrebbero. Gli enzimi che utilizzano tali cofattori includono l’enzima PLP-dipendente dell’aspartato transaminasi e l’enzima TPP-dipendente della piruvato deidrogenasi.
Piuttosto che abbassare l’energia di attivazione per un percorso di reazione, la catalisi covalente fornisce un percorso alternativo per la reazione (attraverso l’intermedio covalente) ed è quindi distinta dalla vera catalisi. Per esempio, l’energetica del legame covalente alla molecola di serina nella chimotripsina dovrebbe essere paragonata al ben noto legame covalente al nucleofilo nella reazione non catalizzata in soluzione. Una vera proposta di catalisi covalente (dove la barriera è più bassa della barriera corrispondente in soluzione) richiederebbe, per esempio, un legame covalente parziale allo stato di transizione da parte di un gruppo enzimatico (per esempio, un legame idrogeno molto forte), e tali effetti non contribuiscono significativamente alla catalisi.
Catalisi degli ioni metalliciModifica
Uno ione metallico nel sito attivo partecipa alla catalisi coordinando la stabilizzazione della carica e la schermatura. A causa della carica positiva di un metallo, solo le cariche negative possono essere stabilizzate attraverso gli ioni metallici. Tuttavia, gli ioni metallici sono vantaggiosi nella catalisi biologica perché non sono influenzati dai cambiamenti di pH. Gli ioni metallici possono anche agire per ionizzare l’acqua agendo come un acido di Lewis. Gli ioni metallici possono anche essere agenti di ossidazione e riduzione.
Ceppo di legameModifica
Questo è l’effetto principale del legame di adattamento indotto, dove l’affinità dell’enzima allo stato di transizione è maggiore che al substrato stesso. Questo induce riarrangiamenti strutturali che tendono i legami del substrato in una posizione più vicina alla conformazione dello stato di transizione, abbassando così la differenza di energia tra il substrato e lo stato di transizione e aiutando a catalizzare la reazione.
Tuttavia, l’effetto di tensione è, in effetti, un effetto di destabilizzazione dello stato di base, piuttosto che un effetto di stabilizzazione dello stato di transizione. Inoltre, gli enzimi sono molto flessibili e non possono applicare grandi effetti di deformazione.
Oltre alla deformazione del legame nel substrato, la deformazione del legame può anche essere indotta all’interno dell’enzima stesso per attivare i residui nel sito attivo.
Per esempio:
Substrato, substrato legato, e conformazioni dello stato di transizione del lisozima.
Il substrato, sul legame, viene distorto dalla conformazione a mezza sedia dell’anello esoso (a causa dell’ostacolo sterico con gli aminoacidi della proteina che costringono il c6 equatoriale ad essere in posizione assiale) nella conformazione a sedia
Quantum tunnelingEdit
Questi meccanismi tradizionali “sopra la barriera” sono stati sfidati in alcuni casi da modelli e osservazioni di meccanismi “attraverso la barriera” (quantum tunneling). Alcuni enzimi operano con cinetiche che sono più veloci di quanto sarebbe previsto dal ΔG‡ classico. Nei modelli “attraverso la barriera”, un protone o un elettrone possono attraversare le barriere di attivazione. Il tunneling quantistico per i protoni è stato osservato nell’ossidazione della triptamina da parte dell’ammina aromatica deidrogenasi.
Il tunneling quantistico non sembra fornire un grande vantaggio catalitico, poiché i contributi del tunneling sono simili nelle reazioni catalizzate e non catalizzate in soluzione. Tuttavia, il contributo del tunneling (che tipicamente aumenta le costanti di tasso di un fattore di ~1000 rispetto al tasso di reazione per il classico percorso “sopra la barriera”) è probabilmente cruciale per la vitalità degli organismi biologici. Questo sottolinea l’importanza generale delle reazioni di tunneling in biologia.
Nel 1971-1972 fu formulato il primo modello quantomeccanico della catalisi enzimatica.
Enzima attivoModifica
L’energia di legame del complesso enzima-substrato non può essere considerata un’energia esterna necessaria per l’attivazione del substrato. L’enzima ad alto contenuto energetico può prima trasferire qualche gruppo energetico specifico X1 dal sito catalitico dell’enzima al posto finale del primo reagente legato, poi un altro gruppo X2 dal secondo reagente legato (o dal secondo gruppo del singolo reagente) deve essere trasferito al sito attivo per finire la conversione del substrato in prodotto e la rigenerazione dell’enzima.
Possiamo presentare l’intera reazione enzimatica come due reazioni di accoppiamento:
|
S 1 + EX 1 ⟶ S 1 EX 1 ⟶ P 1 + EP 2 {\displaystyle {\ce {{S1}+ EX1 -> S1EX1 -> {P1}+ EP2}}}
 |
|
(1) |
|
S 2 + EP 2 ⟶ S 2 EP 2 ⟶ P 2 + EX 2 {\displaystyle {\ce {{S2}+ EP2 -> S2EP2 -> {P2}+ EX2}}}
 |
|
(2) |
Si può vedere dalla reazione (1) che il gruppo X1 dell’enzima attivo appare nel prodotto a causa della possibilità della reazione di scambio all’interno dell’enzima per evitare sia l’inibizione elettrostatica che la repulsione degli atomi. Quindi rappresentiamo l’enzima attivo come un potente reagente della reazione enzimatica. La reazione (2) mostra una conversione incompleta del substrato perché il suo gruppo X2 rimane nell’enzima. Questo approccio come idea era stato proposto in precedenza basandosi su ipotetiche conversioni enzimatiche estremamente elevate (enzima cataliticamente perfetto).
Il punto cruciale per la verifica del presente approccio è che il catalizzatore deve essere un complesso dell’enzima con il gruppo di trasferimento della reazione. Questo aspetto chimico è supportato dai meccanismi ben studiati delle varie reazioni enzimatiche. Si consideri la reazione di idrolisi del legame peptidico catalizzata da una proteina pura α-cimotripsina (un enzima che agisce senza un cofattore), che è un membro ben studiato della famiglia delle serina proteasi, vedi.
Presentiamo i risultati sperimentali per questa reazione come due passi chimici:
|
S 1 + EH ⟶ P 1 + EP 2 {\displaystyle {\ce {{S1}+ EH -> {P1}+ EP2}}}
 |
|
(3) |
|
EP 2 + H – O – H ⟶ EH + P 2 {\displaystyle {\ce {{EP2}+ {H-O-H}-> {EH}+ P2}}
 |
|
(4) |
dove S1 è un polipeptide, P1 e P2 sono prodotti. Il primo passo chimico (3) comprende la formazione di un intermedio covalente acil-enzima. Il secondo passo (4) è il passo di deacilazione. È importante notare che il gruppo H+, che si trova inizialmente sull’enzima, ma non nell’acqua, appare nel prodotto prima del passo di idrolisi, quindi può essere considerato come un gruppo aggiuntivo della reazione enzimatica.
Quindi, la reazione (3) mostra che l’enzima agisce come un potente reagente della reazione. Secondo il concetto proposto, il trasporto di H dall’enzima promuove la prima conversione del reagente, la rottura del primo legame chimico iniziale (tra i gruppi P1 e P2). La fase di idrolisi porta alla rottura del secondo legame chimico e alla rigenerazione dell’enzima.
Il meccanismo chimico proposto non dipende dalla concentrazione dei substrati o dei prodotti nel mezzo. Tuttavia, uno spostamento della loro concentrazione causa principalmente cambiamenti di energia libera nel primo e nell’ultimo passo delle reazioni (1) e (2) a causa dei cambiamenti nel contenuto di energia libera di ogni molecola, sia S che P, in soluzione acquosa.Questo approccio è in accordo con il seguente meccanismo di contrazione muscolare. Il passo finale dell’idrolisi dell’ATP nel muscolo scheletrico è il rilascio del prodotto causato dall’associazione delle teste di miosina con l’actina. La chiusura della fessura di legame dell’actina durante la reazione di associazione è strutturalmente accoppiata con l’apertura della tasca di legame del nucleotide sul sito attivo della miosina.
In particolare, le fasi finali dell’idrolisi dell’ATP includono il rilascio veloce del fosfato e il rilascio lento dell’ADP.Il rilascio di un anione fosfato dall’anione ADP legato nella soluzione acquosa può essere considerato come una reazione exergonica perché l’anione fosfato ha una bassa massa molecolare.
Quindi, arriviamo alla conclusione che il rilascio primario del fosfato inorganico H2PO4- porta alla trasformazione di una parte significativa dell’energia libera dell’idrolisi dell’ATP nell’energia cinetica del fosfato solvatato, producendo un flusso attivo. Questo presupposto di una trasduzione meccano-chimica locale è in accordo con il meccanismo di contrazione muscolare di Tirosh, dove la forza muscolare deriva da un’azione integrata del flusso attivo creato dall’idrolisi dell’ATP.