
Quando il gas cloro viene fatto gorgogliare attraverso un cilindro di succo di pomodoro, la miscela cloro/succo di pomodoro diventa quasi completamente bianca entro cinque minuti. Questo cambiamento spettacolare è il risultato dell’azione chimica del cloro, che agisce come agente sbiancante ossidante, sui pigmenti del succo di pomodoro. Quando vecchi ritagli di giornale, scoloriti dall’invecchiamento e dall’esposizione alla luce, vengono trattati con una soluzione acquosa di boroidride di sodio all’1%, la carta si sbianca drasticamente entro venti minuti. In questo caso, la carta è stata riportata al suo colore bianco originale grazie all’azione della boroidride di sodio che agisce come agente sbiancante riducente.
Un agente sbiancante è una sostanza che può sbiancare o decolorare altre sostanze. Le sostanze colorate contengono generalmente gruppi di atomi, chiamati cromofori, che possono assorbire la luce visibile con lunghezze d’onda specifiche e caratteristiche, e riflettere o trasmettere la parte di luce che non viene assorbita. Per esempio, se un cromoforo assorbe la luce blu, rifletterà la luce del colore complementare, e la sostanza contenente cromoforo apparirà gialla. Gli agenti sbiancanti distruggono essenzialmente i cromofori (rimuovendo così il colore), attraverso l’ossidazione o la riduzione di questi gruppi assorbenti. Pertanto, i candeggianti possono essere classificati come agenti ossidanti o agenti riducenti.
Alcuni degli usi degli agenti sbiancanti sono:
- Il candeggio di tessuti e stoffe
- Il candeggio della pasta di legno
- La rimozione delle macchie
- Lavaggio e pulizia commerciale e domestica
- Come ingredienti nei detersivi e nei prodotti per lavare i piatti
- Lo sbiancamento dei capelli
Candeggine ossidanti
Un gran numero di candeggine ossidanti sono state esaminate da Jules A. Szilard in Bleaching Agents and Techniques (1973). I candeggianti ossidanti (e gli agenti sbiancanti) di uso comune oggi sono: cloro, biossido di cloro, ipocloriti alcalini, perossido di idrogeno, composti di perossigeno e luce solare e artificiale.
Cloro (Cl 2 ). La scoperta del cloro da parte del chimico svedese Carl Wilhelm Scheele nel 1774 ha segnato l’inizio dell’era moderna del candeggio. Secondo Sidney M. Edelstein in un articolo del 1948 intitolato “The Role of Chemistry in the Development of Dyeing and Bleaching”, il chimico francese Claude-Louis Berthollet fu il primo a usare il cloro per sbiancare i tessuti di cotone e lino.
Il cloro è stato usato per sbiancare la pasta di legno. Molte fabbriche di cellulosa che impiegano il processo di spappolamento Kraft preparano l’idrossido di sodio (necessario per digerire i trucioli di legno) in loco attraverso l’elettrolisi della salamoia, una soluzione acquosa concentrata di cloruro di sodio.
2NaCl + 2H 2 O → 2NaOH + H 2 + Cl 2 (1)
Il cloro è un prodotto secondario. Il successivo sbiancamento con cloro della polpa marrone dà un prodotto che può essere utilizzato per la fabbricazione di carta da scrivere e da stampa. Sfortunatamente, i composti organici nella polpa sono sia ossidati che clorurati, producendo piccole quantità di composti organoclorurati, tra cui
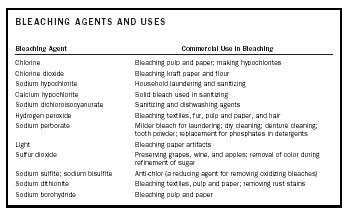
| AGENTI Sbiancanti E USI | |
| Agente sbiancante | Uso commerciale nello sbiancamento |
| Cloro | Sbiancare pasta e carta; produzione di ipocloriti |
| Biossido di cloro | Candeggio di carta kraft e farina |
| Ipoclorito di sodio | Lavaggio e sanificazione della casa |
| Calcio ipoclorito | Candeggina solida usata nella sanificazione |
| Dicloroisocianurato di sodio | Agenti per la sanificazione e il lavaggio delle stoviglie |
| Perossido di idrogeno | Candeggio di tessuti, pellicce, cellulosa e carta, e capelli |
| Perborato di sodio | Candeggina più leggera per il lavaggio; lavaggio a secco; pulizia di dentiere; polvere per denti; sostituzione dei fosfati nei detergenti |
| Luce | Sbiancamento di manufatti di carta |
| Anidride solforosa | Conservazione di uva, vino e mele; rimozione del colore durante la raffinazione dello zucchero |
| Solfito di sodio; bisolfito di sodio | Anti-cloro (un agente riducente per la rimozione di sbiancanti ossidanti) |
| Ditionite di sodio | Sbiancamento di tessuti, pasta e carta; rimozione delle macchie di ruggine |
| Sodio boroidruro | Sbiancamento di pasta e carta |
diossine. Infatti, la diossina più abbondante prodotta dal processo di cellulosa e sbiancamento, la 2,3,7,8-tetraclorodibenzo- p -diossina (2,3,7,8-TCDD), è stata trovata essere sia un cancerogeno che una tossina mortale. Così, il cloro come agente sbiancante viene sostituito dai più sicuri agenti sbiancanti biossido di cloro e perossido di idrogeno. Infatti, la tendenza nell’industria della cellulosa e della carta è verso uno sbiancamento totalmente privo di cloro (TCF). Il cloro è ora usato nell’industria dello sbiancamento principalmente per preparare soluzioni di ipoclorito e sbiancanti secchi come l’ipoclorito di calcio.
Biossido di cloro (ClO 2 ). Il biossido di cloro è stato usato come agente sbiancante sia nella sua fase gassosa che in soluzione acquosa. A causa della sua natura esplosiva, il biossido di cloro in fase gassosa è spesso diluito con azoto o anidride carbonica. Se immagazzinato o spedito, il biossido di cloro viene fatto passare in acqua fredda e conservato sotto refrigerazione.
Il biossido di cloro è preparato industrialmente tramite la riduzione del clorato di sodio da parte dell’anidride solforosa in soluzione acquosa.
2NaClO 3 + SO 2 + H 2 SO 4 → 2ClO 2 + 2NaHSO 4 (2)
Un metodo relativamente sicuro per la preparazione di ClO 2 comporta la reazione tra clorito di sodio (NaClO 2 ) e formaldeide (H 2 CO).
H 2 CO + H + + ClO 2 – → HOCl + HCOOH (3)
Quando la reazione 3 procede, il pH della soluzione scende (a causa della produzione di acido formico). L’aumentata acidità della soluzione promuove la formazione di ClO 2 , indicata nell’equazione 4.
HCOOH + HOCl + 2ClO 2 – → 2ClO 2 + Cl – + H 2 O + HCOO – (4)
In soluzione acida, il biossido di cloro si comporta come un agente ossidante. La riduzione completa di ClO 2 è mostrata nell’equazione 5.
ClO 2 + 4H + + 5 e – → Cl – + 2H 2 O (5)
I singoli passi di questa reazione di riduzione complessiva producono HClO 2 , HOCl, e Cl 2 , che si comportano tutti come agenti ossidanti. Un mezzo acido è richiesto, poiché ClO 2 si sproporziona in soluzione alcalina, come mostrato nell’equazione 6.
2ClO 2 + 2OH – → ClO 3 – + ClO 2 – + H 2 O (6)
Il biossido di cloro è usato principalmente per lo sbiancamento della pasta.
Ipocloriti (OCl – ). Le soluzioni di candeggio ipoclorite sono fatte da NaOCl e, in misura minore, Ca(OCl) 2 . Gli ipocloriti sono usati nel lavaggio, come disinfettanti, nello sbiancamento della pasta e dei tessuti, e nella rimozione dell’inchiostro dalla carta riciclata. Le soluzioni sbiancanti commerciali si ottengono facendo passare il gas di cloro attraverso idrossido di sodio acquoso freddo e diluito, come mostrato nell’equazione 7.
Cl 2 + 2OH – → OCl – + Cl – + H 2 O (7)
In alternativa, lo ione ipoclorito può essere generato dall’idrolisi dei composti organici azoto-clorurati. Alcuni dei composti azoto-cloro più importanti usati in questo modo sono gli isocianurati clorurati. Questi trovano impiego nei prodotti per la pulizia e la lavastoviglie.
Per essere una candeggina efficace, la soluzione di ipoclorito deve essere mantenuta alcalina (pH > 9,0), per sopprimere l’idrolisi di OCl – (vedi equazione 8) e prevenire la formazione di HOCl instabile.
OCl – + H 2 O → HOCl + OH – (8)
In soluzioni acide, HOCl si forma e si decompone.
3HOCl → HClO 3 + 2HCl (9)
HOCl reagirà anche con HCl, uno dei prodotti di decomposizione.
HOCl + HCl → H 2 O + Cl 2 (10)
Le soluzioni di sbiancamento con ipoclorito non devono contenere cationi di metalli pesanti, poiché questi cationi (come la luce o il calore) promuovono la decomposizione dell’HOCl, come mostrato nell’equazione 11.
2HOCl → 2HCl + O 2 (11)
I principi attivi dei candeggianti ipocloriti variano con il pH. A pH < 2, Cl 2 è il principale componente in soluzione; a pH da 4 a 6, HOCl è la specie dominante; a pH > 9, OCl – è il solo componente presente. È lo ione ipoclorito in soluzione basica che è l’ingrediente attivo nella candeggina domestica, che è tipicamente circa il 5-6% di NaOCl. Lo ione OCl – ossida i cromofori nei materiali colorati e si riduce a ioni cloruro e idrossido.
OCl – + H 2 O + 2 e – → Cl – + 2OH – (12)
Il processo di sbiancamento effettuato dal candeggiante ipoclorito commerciale è spesso migliorato dall’uso di sbiancanti ottici, composti che assorbono la luce ultravioletta incidente ed emettono luce visibile, rendendo il tessuto più luminoso e più bianco.
Perossido di idrogeno (H 2 O 2 ) . Il perossido di idrogeno può essere preparato dalla reazione di perossido di bario e acido solforico (vedi equazione 13). Poiché il solfato di bario precipita fuori, il perossido di idrogeno è facilmente separabile.
BaO 2 + H 2 SO 4 → BaSO 4 + H 2 O 2 (13)
Il perossido di idrogeno, come agente sbiancante usato nell’industria della pasta e della carta, ha il vantaggio di non essere inquinante. A causa dell’instabilità del perossido di idrogeno puro, le soluzioni acquose sono impiegate nel candeggio. A temperatura ambiente, il perossido di idrogeno si decompone molto lentamente in acqua e ossigeno.
2H 2 O 2 → H 2 O + O 2 (14)
Tuttavia, la presenza di cationi di metalli di transizione (in particolare Fe 3+ , Mn 2+ , e Cu 2+ ) e di altri catalizzatori accelera notevolmente questa reazione. Di conseguenza, il perossido di idrogeno acquoso deve essere stabilizzato con agenti complessanti che sequestrano i cationi dei metalli di transizione.
La specie sbiancante attiva nel perossido di idrogeno è l’anione peridrossile, OOH – , formato attraverso la ionizzazione di H 2 O 2 .
H 2 O 2 + H 2 O → H 3 O + + OOH – (15)
La costante di ionizzazione acida del perossido di idrogeno è molto bassa ( K a = 2 × 10 -12 ) con il risultato che le soluzioni di H 2 O 2 devono essere rese alcaline per

per aumentare la concentrazione di OOH – . In assenza di un mezzo alcalino, il perossido di idrogeno non è più efficace come agente sbiancante. Per esempio, la fase di decolorazione della tintura dei capelli utilizza spesso il perossido di idrogeno (5-6%), ma anche l’ammoniaca per fornire un mezzo alcalino.
Allo stesso tempo il pH non deve salire oltre 11, perché a questo punto la decomposizione di OOH – inizia a verificarsi.
2OOH – → O 2 + 2OH – (16)
Composti del perossigeno. Esiste un certo numero di composti solidi di perossigeno che rilasciano perossido di idrogeno quando dissolti in acqua. Questi includono il perborato di sodio (NaBO 3 z 4H 2 O o NaBO 2 z H 2 O 2 z 3H 2 O) e il carbonato di sodio perossidato (2Na 2 CO 3 z 3H 2 O 2 ). La struttura del perborato di sodio contiene il perossoanione B 2 (O 2 ) 2 (OH) 4 2- , che contiene due legami O-O che uniscono due gruppi tetraedrici BO 2 (OH) 2- . Questi composti perossigenici sono usati in detergenti, detergenti per dentiere e polveri per denti.
Sbiancamento con la luce. Lo sbiancamento che coinvolge la luce naturale del sole o la luce artificiale è stato usato per rimuovere le macchie dai manufatti di carta e per trattare i tessuti. Il materiale da sbiancare viene prima immerso in una soluzione alcalina di bicarbonato di calcio o di magnesio, e poi protetto dalle radiazioni ultraviolette coprendolo con plexiglas, Lexan o Mylar. L’esposizione alla luce viene poi lasciata avvenire da due a quattro ore, per la luce solare naturale, e da due a dodici ore, per la luce artificiale.
Candeggianti riducenti
Gli agenti riducenti usati nel candeggio includono solfiti, bisolfiti, ditioniti e boroidruri di sodio, che sono tutti usati nel candeggio di pasta e tessuti.
Solfiti (SO 3 2- ) e bisolfiti (HSO 3 – ). Lo stato di ossidazione dello zolfo sia in SO 3 2- che in HSO 3 – è +4, e l’ossidazione a +6 avviene facilmente, con la formazione di SO 4 2- e HSO 4 – , rispettivamente, rendendo i solfiti e i bisolfiti buoni agenti riducenti.
Ditioniti (S 2 O 4 2- ) . Sia la ditionite di sodio che quella di zinco hanno trovato impiego nello sbiancamento delle paste meccaniche e dei tessuti. La preparazione dello ione ditionite è realizzata tramite la riduzione dello ione bisolfito e dell’anidride solforosa con polvere di Zn.
2HSO 3 – + SO 2 + Zn → Zn 2+ + S 2 O 4 2- + SO 3 2- + H 2 O (17)
Lo ione ditionite, S 2 O 4 2- , che ha zolfo nello stato di ossidazione +3, si comporta come un forte agente riducente in soluzione alcalina.
S 2 O 4 2- + 4OH – → 2SO 3 2- 2H 2 O + 2 e – (18)
Con l’abbassamento del pH, il potere riducente dello ione ditionite diminuisce, come previsto dal principio di LeChatelier.
I ditioniti sono utili per rimuovere le macchie di ruggine, e soluzioni di citrato neutro di Na 2 S 2 O 4 sono state usate per rimuovere i prodotti di corrosione del ferro dagli oggetti recuperati dal Titanic.
Boroidruro di sodio (NaBH 4 ). La boroidride di sodio è stata usata principalmente nello sbiancamento industriale delle paste meccaniche. Lo ione BH 4 – è un forte agente riducente in soluzione alcalina.
BH 4 – + 10OH – → BO 3 3- + 8 e – + 7H 2 O (19)
Un problema nell’uso della boroidride di sodio è che lo ione BH 4 – si decompone lentamente in soluzione acquosa.
BH 4 – + 4H 2 O → B(OH) 4 – + 4H 2 (20)
Come metodo alternativo, i sali BH 4 – possono essere dissolti in CH 3 OH o nel meno tossico C 2 H 5 OH. La decomposizione dello ione BH 4 – negli alcoli avviene ad un ritmo molto più lento:
BH 4 – + 4ROH → B(OR) 4 – + 4H 2 (R = CH 3 , C 2 H 5 ) (21)
Conclusione
Un agente decolorante può sbiancare o decolorare una sostanza reagendo con i cromofori che sono responsabili del colore della sostanza. A seconda della natura dei cromofori, l’agente sbiancante sarà un agente ossidante o riducente. Cioè, il cromoforo viene ossidato o ridotto per produrre una sostanza incolore o sbiancata. Gli agenti sbiancanti e i loro usi commerciali sono riassunti nella tabella 1.