Tendenza 2: Per gli ossiacidi di un dato atomo centrale l’acidità aumenta con lo stato di ossidazione dell’elemento centrale o, in altre parole, il numero di ossigeni legati all’atomo centrale.
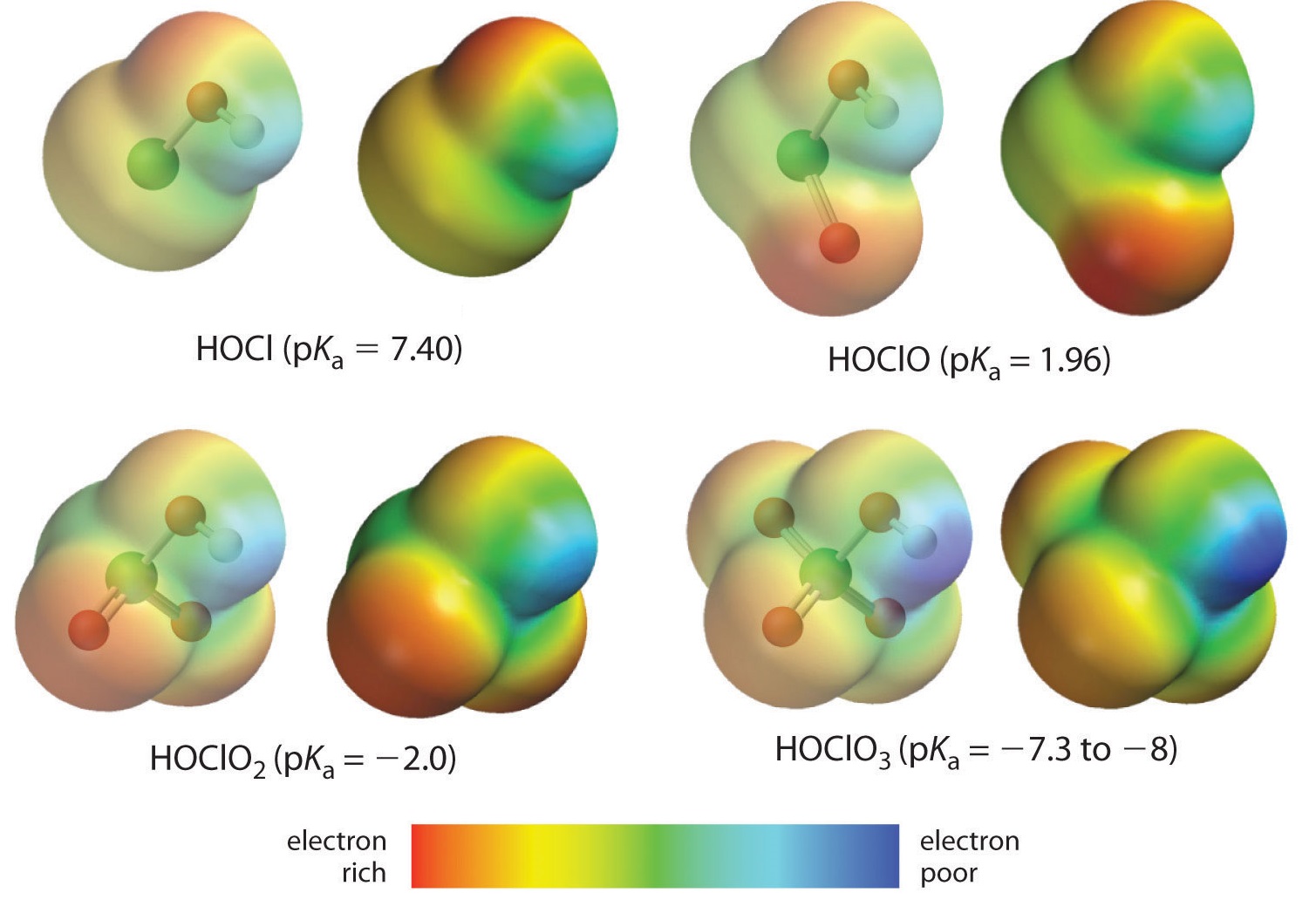
Qui stiamo guardando la tendenza per gli acidi in cui ci sono numeri variabili di ossigeno legati a un dato atomo centrale. Un esempio è la serie degli acidi perclorico (\ce{ClO_4^{-}}), clorico (\ce{ClO_3^{-}}), cloroso (\ce{ClO_2^{-}}), e ipocloso (\ce{ClO^{-}}). In queste serie, maggiore è il numero di ossigeni, più forte è l’acido. Questo può essere spiegato in diversi modi. Dal punto di vista dell’acido stesso il fattore chiave è di nuovo l’effetto induttivo, in questo caso coinvolgendo la capacità degli ossigeni attaccati all’atomo centrale di tirare la densità di elettroni attraverso il legame OH. Questo si vede dal diagramma di densità di carica per gli ossiacidi di cloro mostrato nella figura \(\PageIndex{1}}), in cui la carica positiva parziale sull’idrogeno acido aumenta con il numero di ossigeni presenti.
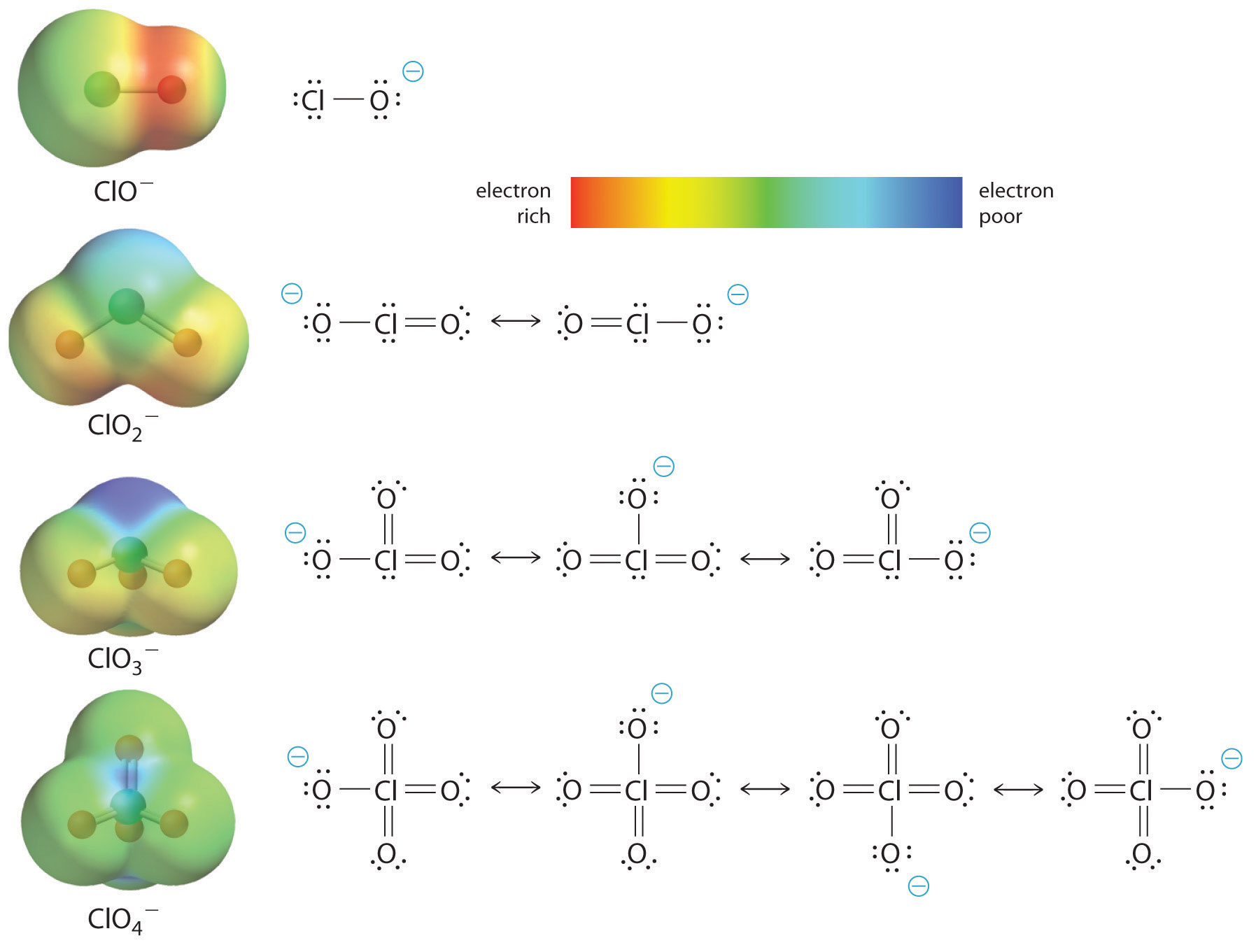
L’aumento dell’acidità dell’ossiacido con il numero di ossigeni legati all’atomo centrale può essere visto anche considerando la stabilità dell’ossianione coniugato. Che la stabilità della base coniugata aumenta con il numero di ossigeni può essere visto dai diagrammi di distribuzione della carica e dai modelli di legame di Lewis per gli ossanioni di cloro mostrati in figura (\PageIndex{2}). Come la carica negativa è distribuita su più atomi di ossigeno, diventa sempre più diffusa.
Esercizio \(\PageIndex{1})
Lo zolfo e il selenio formano entrambi ossiacidi di formula \(\ce{H_2EO_4}\ dove E è S o Se. Questi sono chiamati rispettivamente acido solforoso e acido selenico. Quale ossiacido ti aspetteresti che sia più acido: l’acido selenico o l’acido solforoso?
Risposta
L’acido solforoso dovrebbe essere più acido. Poiché lo zolfo è più elettronegativo del selenio, lo zolfo polarizzerà i legami OH in misura maggiore, rendendoli più acidi. Questa previsione è confermata da un confronto dei valori \(pK_a\) per gli acidi:
| Acido | (pK_{a1}) | (pK_{a2}) |
|---|---|---|
| acido solforoso, \(H_2SO_3) | 1.85 | 7.2 |
| acido solforoso, \(H_2SeO_3\) | 2.62 | 8.32 |