In reazioni come quelle di Hofmann di metilazione esaustiva – eliminazione, l’olefina meno sostituita si forma generalmente come prodotto principale. Questa è chiamata la regola di Hofmann. Tutte queste reazioni portano gruppi lascianti carichi come -NR3+ o -SR2+ e coinvolgono basi forti. La regola di Zaitsev (o regola di Saytzeff) attira la nostra attenzione sulla possibilità alternativa. Eliminando HX, si ottiene l’olefina più stabile (Fig 2.3.1). L’apparente contraddizione in questa serie di regole è facilmente risolta attraverso uno sguardo critico ai meccanismi coinvolti in questi due set di condizioni di reazione.
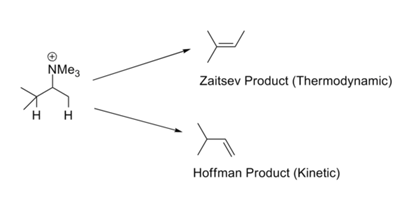
Ci potrebbero essere due ragioni per tali preferenze. Ingold (1960) e Bunnett (1969) hanno suggerito che un gruppo lasciante carico positivamente aumenta l’acidità dei protoni β. Un sostituente nella posizione β potrebbe diminuire iperconiugativamente l’acidità del protone β. Di conseguenza, un gruppo metilico terminale (che non ha alcun sostituente alchilico) è più acido del protone metilico interno (con almeno un sostituente alchilico). Quando il gruppo uscente è un alogeno, il meccanismo si sposta verso E1. In queste condizioni, la stabilità del doppio legame che si sviluppa diventa importante e questo porta al prodotto termodinamicamente più stabile. La scuola di H.C. Brown aveva suggerito (1956) che i fattori sterici governano tali reazioni di eliminazione. I gruppi lascianti carichi sono grandi rispetto ai gruppi lascianti neutri.
I gruppi lascianti più grandi come -NR3+ e -SR2+ danno più prodotto Hoffmann rispetto ai gruppi più piccoli come gli alogeni. La voluminosità della base aumenta anche il prodotto Hoffmann al costo del prodotto Zaitsav. La situazione sembra essere più complessa. Quando la forza della base è stata aumentata senza aumentare la voluminosità al sito di reazione (X-C6H4-O¯), il prodotto di Hoffmann è aumentato al costo del prodotto di Zaitsav (Froemsdorf (1966,67)). Questo suggerisce un meccanismo E1cB, dove l’acidità del protone β è importante. Quindi il meccanismo (e quindi la composizione dei prodotti) potrebbe essere alterato da fattori come la dimensione del gruppo di partenza, la dimensione della base, la natura del gruppo di partenza e la forza della base.
Contribuenti
- Prof. R Balaji Rao (Dipartimento di Chimica, Banaras Hindu University, Varanasi) come parte di Information and Communication Technology