US Pharm. 2018;43(9):21-26.
ABSTRACT : Le traitement hormonal substitutif (THS) est le traitement le plus efficace des symptômes vasomoteurs et génito-urinaires associés à la ménopause. Les effets indésirables associés au THS dépendent de divers facteurs, notamment la posologie, la voie d’administration, la durée d’utilisation, le moment de l’initiation et le choix de l’agent. La décision de commencer un THS doit inclure une évaluation des risques, et le THS doit être adapté à la patiente. Les nombreuses options existantes en matière de THS sont proposées dans un large éventail de dosages et de formes pharmaceutiques. Les pharmaciens devraient être en mesure de conseiller les patients sur le THS et ses effets secondaires.
La femme moyenne vivra un tiers de sa vie pendant ou après la ménopause.1 Le traitement des symptômes de la ménopause a pris une importance croissante en raison des morbidités associées au vieillissement chez les femmes.2 L’hormonothérapie substitutive (HTS), terme utilisé pour décrire l’œstrogénothérapie, la polythérapie œstroprogestative ou la thérapie agoniste ou antagoniste des récepteurs d’œstrogènes, continue de jouer un rôle majeur dans l’atténuation des symptômes périménopausiques et postménopausiques3. Bien que l’expérience de chaque femme soit différente, les symptômes vasomoteurs (SMV) et les symptômes vulvovaginaux sont deux des plaintes les plus courantes associées aux changements hormonaux impliqués dans la ménopause.4
Symptômes de la ménopause
Les SMV font partie des symptômes de la ménopause les plus courants et les plus gênants. Les bouffées de chaleur, caractérisées par une sensation soudaine de chaleur dans la partie supérieure de la poitrine et le visage qui dure de 2 à 4 minutes, surviennent chez environ 75 % des femmes ménopausées.D’autres SMV possibles sont la transpiration, les palpitations et l’anxiété.Les SMV ont été associés à une diminution de la qualité du sommeil, à l’irritabilité, à des difficultés de concentration et à une réduction de la qualité de vie3. En outre, ces symptômes ont été associés à des risques cardiovasculaires, osseux et cognitifs.5-9 Le THS est depuis longtemps reconnu comme le traitement le plus efficace du SMV.4,10
En plus du SMV gênant, de nombreuses femmes présentent des symptômes vulvo-vaginaux. On estime que 10 à 40 % des femmes souffrent d’atrophie vaginale.3 L’atrophie vaginale peut entraîner des douleurs, des brûlures et des démangeaisons vulvaires, une sécheresse vaginale, des pertes vaginales, une dyspareunie (rapports sexuels difficiles ou douloureux) et des taches ou des saignements après les rapports sexuels.1 Ces symptômes ont tendance à se manifester à la fin de la ménopause et peuvent entraîner une gêne lors du port de vêtements serrés, en position assise ou lors d’un exercice physique, ou lors d’une activité sexuelle.Un THS topique est généralement recommandé pour le traitement des symptômes vulvo-vaginaux1.
En plus de soulager les symptômes énoncés précédemment, il existe des preuves que le THS standard à faible dose peut également prévenir les fractures post-ménopausiques de la hanche, de la colonne vertébrale et les fractures non vertébrales10. Les avantages du THS pour les SMV et les symptômes génito-urinaires comprennent une amélioration de l’hyperactivité vésicale, une diminution des troubles du sommeil, une réduction du risque de diabète de type 2, une protection potentielle contre la coronaropathie et l’infarctus du myocarde, une diminution du risque d’ostéoporose ou de fracture et une réduction potentielle de la mortalité toutes causes confondues.1,10 Les avantages du THS sur la densité osseuse diminuent toutefois rapidement après son arrêt. De plus, bien que certains produits soient approuvés par la FDA pour la prévention de l’ostéoporose, aucun d’entre eux n’est actuellement approuvé pour le traitement de l’ostéoporose. Les principaux risques associés à l’utilisation de ces agents comprennent la thromboembolie veineuse (TEV), l’accident vasculaire cérébral ischémique, l’augmentation de l’incidence du cancer de l’endomètre (si un œstrogène non opposé est utilisé chez une femme ayant un utérus) et l’augmentation du risque de cancer du sein lorsque le THS est utilisé au-delà de 3 à 5 ans.4,10
Produits de THS disponibles
Un large éventail de produits de THS est disponible sous diverses formes posologiques.4 Parmi les préparations orales, les options comprennent les œstrogènes équins conjugués (CEE), le 17-bêta-estradiol micronisé (micronisé pour améliorer l’absorption), les œstrogènes estérifiés, l’éthinylestradiol (une préparation œstrogénique très puissante qui est utilisée à des doses beaucoup plus faibles pour le THS que pour la contraception orale), les comprimés d’association œstroprogestative et un comprimé d’association CEE/bazédoxifène4.
Le comprimé CEE/bazédoxifène, association d’un œstrogène et d’un modulateur sélectif des récepteurs aux œstrogènes, est disponible aux États-Unis pour le traitement du SMV ménopausique et la prévention de l’ostéoporose. Dans cette association, le bazédoxifène prévient l’hyperplasie endométriale induite par les œstrogènes, rendant inutile l’administration d’un progestatif. Cependant, le bazédoxifène est associé à un risque accru de TEV.4 L’utilisation du bazédoxifène s’est avérée sûre lorsqu’elle a été étudiée pendant une période allant jusqu’à 7 ans pour le traitement de l’ostéoporose, mais l’association n’a été étudiée que pendant des périodes plus courtes.11,12 Les essais sur le SMV d’une durée allant jusqu’à 2 ans n’ont démontré aucune augmentation de l’incidence de la sensibilité des seins ou du risque de cancer du sein.3 Les lignes directrices actuelles recommandent l’utilisation de FEC/bazéoxifène chez les femmes ménopausées ayant un utérus et ne présentant pas de contre-indications pour traiter le SMV et aider à prévenir la perte osseuse, mais ne précisent pas la durée du traitement.Sur la base des données disponibles, le traitement du SMV par FEC/bazéoxifène pendant une période allant jusqu’à 2 ans semble sûr ; la sécurité de l’utilisation au-delà de 2 ans reste incertaine.
La THS est également disponible sous forme de diverses applications topiques. Des préparations de patchs transdermiques de 17-bêta-estradiol ou de combinaisons œstroprogestatives sont disponibles. D’autres préparations topiques comprennent des sachets de gel ou des pompes doseuses, des vaporisateurs et des émulsions.4 Les injections de dépôt peuvent également être envisagées, mais ces produits sont rarement utilisés dans le cadre d’un THS.4 Un résumé des formulations de THS systémiques disponibles est présenté dans le TABLEAU 1.13-15
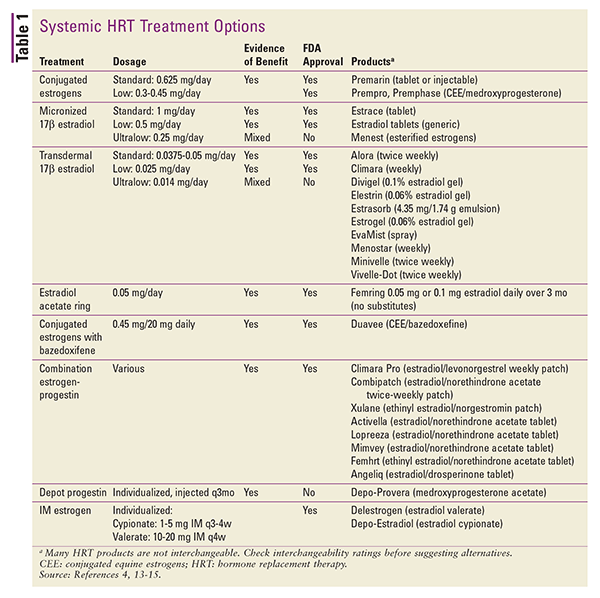
Lors de la conversion d’une forme posologique à une autre, les différences de voie d’administration et de puissance du produit peuvent être prises en compte en utilisant des équivalents de dose estimés.4 Les équivalents de dose pour les préparations orales sont les suivants : 1 mg de 17-bêta-estradiol micronisé équivaut à 1,25 mg de sulfate d’estrone de pipérazine. Dans les conversions entre les préparations d’œstrogènes orales et transdermiques, 0,05 mg/24 heures transdermiques est égal à environ 0,625 mg par jour par voie orale.4
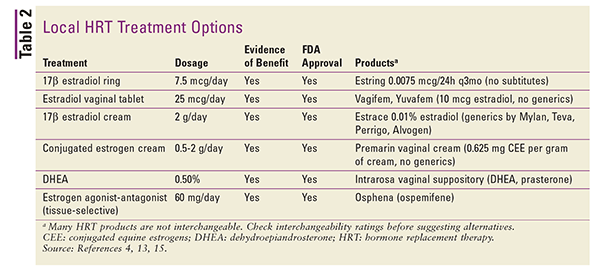
Les préparations locales sont généralement à faible dose et sont utilisées spécifiquement pour la prise en charge des symptômes de l’atrophie vulvo-vaginale.4 Des doses plus élevées peuvent être utilisées pour le traitement du SMV systémique, mais cela n’est généralement pas recommandé.4 Les préparations locales comprennent les anneaux vaginaux, les comprimés et les crèmes. Consultez le TABLEAU 2 pour un résumé des formulations de THS locales disponibles.4,13,15
Recommandations actuelles des lignes directrices
Trois organisations – l’American College of Obstetricians and Gynecologists, la North American Menopause Society (NAMS) et l’Endocrine Society – ont produit des lignes directrices sur l’utilisation du THS à la ménopause. Comme l’indiquent ces lignes directrices, les indications du THS comprennent la prise en charge du SMV associé à la ménopause et le traitement des effets vulvo-vaginaux en l’absence de symptômes systémiques gênants.1,3,4 On a constaté que l’œstrogène seul ou en association avec un progestatif réduisait le SMV hebdomadaire de 75 % et réduisait significativement la gravité des symptômes par rapport au placebo4.
Chez les femmes âgées de moins de 60 ans qui sont moins de 10 ans après la ménopause, qui présentent des SMV gênants et qui n’ont pas de contre-indication au THS ou de risque excessif de cancer cardiovasculaire ou du sein, l’utilisation d’un traitement à base d’œstrogènes seuls est recommandée pour celles qui n’ont pas d’utérus. L’ajout d’un progestatif est recommandé chez les patientes ayant un utérus afin de prévenir l’hyperplasie de l’endomètre et le cancer potentiel de l’endomètre.1,3,4 Actuellement, l’exposition requise au progestatif n’est pas claire, mais de nombreux prestataires donnent des progestatifs selon un cycle de 14 jours chaque mois.4 Pour les femmes âgées de plus de 60 ans ou qui sont plus de 10 ans après la ménopause, il est recommandé d’envisager d’autres thérapies (non hormonales) au lieu d’un THS3.
Chez les femmes présentant un risque élevé de maladie cardiovasculaire (MCV ; défini comme un risque de MCV à 10 ans de >10 % selon l’outil d’estimation du risque cardiovasculaire de l’American College of Cardiology/American Heart Association), les thérapies non hormonales sont préférables3. Chez les femmes présentant un risque modéré de MCV, l’œstrogène transdermique avec ou sans progestatif est préférable au traitement oral, car ces préparations ont moins d’effet sur la tension artérielle, les lipides et le métabolisme glucidique.1 Chez les patientes présentant un risque élevé de TEV, il est préférable d’utiliser les voies non orales à la dose efficace la plus faible. Enfin, chez les patientes présentant un risque élevé ou intermédiaire de cancer du sein, la préférence est donnée aux traitements non hormonaux.4
Si l’on opte pour un THS, toutes les directives recommandent l’utilisation de la dose efficace la plus faible.1,4,10 L’un des avantages des doses plus faibles de THS est le meilleur profil d’effets secondaires par rapport aux régimes à forte dose.4 Il n’existe actuellement aucune voie d’administration privilégiée pour le traitement du SMV ; par conséquent, la voie d’administration doit être guidée par les préférences de la patiente. Il convient de noter que les produits transdermiques peuvent être associés à une incidence plus faible d’effets indésirables, tels que la TEV, mais des études sont encore en cours.10
Pour le traitement des symptômes génito-urinaires chez les femmes sans antécédents de cancers hormono-dépendants, des œstrogènes vaginaux à faible dose peuvent être utilisés.1 Pour les symptômes vaginaux uniquement, les directives recommandent de ne pas ajouter de progestatif, que l’utérus soit présent ou non. Ce traitement peut également être approprié chez les patientes ayant des antécédents de cancers hormono-dépendants, mais dans ce cas, le choix du traitement doit être basé sur un processus de décision partagé comprenant une discussion des risques et des avantages. Les avantages potentiels des œstrogènes vaginaux comprennent une amélioration rapide des symptômes vaginaux et urinaires et une prévention possible des infections urinaires récurrentes. Les traitements non œstrogéniques approuvés par la FDA et conformes aux lignes directrices utilisés pour soulager la dyspareunie comprennent l’ospemifène et la déshydropiandrostérone intravaginale16,17.
Les traitements à base de progestatifs seuls, la testostérone, les traitements non hormonaux alternatifs à base de plantes et les hormones bioidentiques composées manquent de données et ne sont généralement pas recommandés.1,4 Le NAMS indique que les prescripteurs peuvent envisager un THS composé dans les situations où une patiente ne peut pas tolérer les traitements approuvés par la FDA3. Les options de traitement non hormonal des symptômes vasomoteurs comprennent les inhibiteurs sélectifs de la recapture de la sérotonine et les inhibiteurs sélectifs de la recapture de la sérotonine et de la noradrénaline, la clonidine et la gabapentine, et les traitements non hormonaux des symptômes vaginaux comprennent les lubrifiants, les agonistes-antagonistes des œstrogènes et les remèdes à base de plantes4. Les preuves soutenant l’utilisation des thérapies non hormonales varient, et toutes les options ne disposent pas de preuves avérées ou d’une indication approuvée par la FDA.4
La surveillance du THS doit inclure des dépistages réguliers du cancer du sein pendant et après la fin du traitement. Les saignements récurrents non programmés doivent être évalués rapidement.1 La durée du traitement doit être revue au moins une fois par an, et la durée de traitement la plus courte est préférable.1 Lorsque les patientes et les prestataires décident d’arrêter le THS, une stratégie d’arrêt progressif ou brutal peut être utilisée. Il n’y a pas de données probantes concernant les méthodes d’arrêt ; par conséquent, la prise de décision partagée est recommandée pour le processus d’arrêt.1,4
Interactions médicamenteuses
La majorité des produits de THS disponibles dans le commerce (TABLEAU 1) subissent un métabolisme hépatique médié par le système CYP45015. Plus précisément, les produits œstrogéniques sont partiellement métabolisés par le CYP3A4 ; par conséquent, les inducteurs puissants du CYP3A4 peuvent réduire l’efficacité du THS œstrogénique et les inhibiteurs puissants peuvent augmenter les concentrations sériques d’œstrogènes. De plus, d’autres médicaments substrats de ces enzymes peuvent interférer avec le métabolisme du THS.15
Effets secondaires graves et courants
Les principaux effets secondaires associés au THS sont les MCV, le cancer du sein, le cancer de l’endomètre ou de l’ovaire, les accidents vasculaires cérébraux et les TEV.1 L’utilisation d’œstrogènes sans opposition augmente le risque d’hyperplasie et de cancer de l’endomètre, d’où la recommandation d’ajouter un progestatif chez les femmes ayant un utérus. En ce qui concerne le risque de cancer du sein, il semble qu’il y ait un faible risque de développer un cancer du sein lorsqu’une femme prend des oestrogènes pendant 5 ans.3 La littérature actuelle n’est pas cohérente en ce qui concerne la détermination du risque de développer un cancer de l’ovaire à cause de l’HTS.3 D’autres essais randomisés et contrôlés sont nécessaires pour déterminer le risque réel de développer un cancer de l’ovaire avec l’utilisation de l’HTS.1 Les effets de l’HTS sur la coronaropathie, l’accident vasculaire cérébral et la TEV varient en fonction de l’âge de la femme au moment de l’initiation ou du temps écoulé depuis le début de la ménopause. Il semble que les femmes qui prennent un THS pendant plus de 10 ans après le début de la ménopause courent un risque accru de développer une coronaropathie.3 Dans l’ensemble, les études suggèrent que les formulations orales et transdermiques à faible dose confèrent un risque moindre d’AVC et de TEV par rapport au THS à dose standard.3 Les patientes qui ont plus de 60 ans au moment de l’initiation du THS ou qui sont à plus de 10 ans du début de la ménopause courent un risque accru de ces effets indésirables. De plus, les femmes qui prennent un THS avec des œstrogènes, seuls ou en association, présentent un risque accru de calculs biliaires, de cholécystite et de cholécystectomie.Le risque de maladie de la vésicule biliaire a été associé à l’utilisation d’un THS oral et peut ne pas exister avec les formulations topiques ou transdermiques1,3.
Contre-indications
Les directives des sociétés professionnelles n’ont pas spécifié de liste de contre-indications absolues ou relatives à l’HTS.2 Par conséquent, comme pour la plupart des décisions cliniques, une évaluation individuelle des risques et des avantages est importante. En général, l’HTS doit être évitée chez les patientes présentant des saignements vaginaux inexpliqués, des antécédents d’accident vasculaire cérébral ou d’accident ischémique transitoire, d’infarctus du myocarde, d’embolie pulmonaire ou de TEV, de cancer du sein ou de l’endomètre, de maladie hépatique active, de déficience connue en protéine C, en protéine S ou en antithrombine ou d’autres troubles thrombophiles, et de grossesse connue ou soupçonnée1. De plus, la prudence est de mise chez les patients souffrant de diabète, de maladie de la vésicule biliaire, d’hypertriglycéridémie (>400 mg/jour), d’hypoparathyroïdie, de méningiome bénin, de risque intermédiaire ou élevé de cancer du sein, de risque élevé de maladie cardiaque ou de migraine avec aura2.
Points de conseil
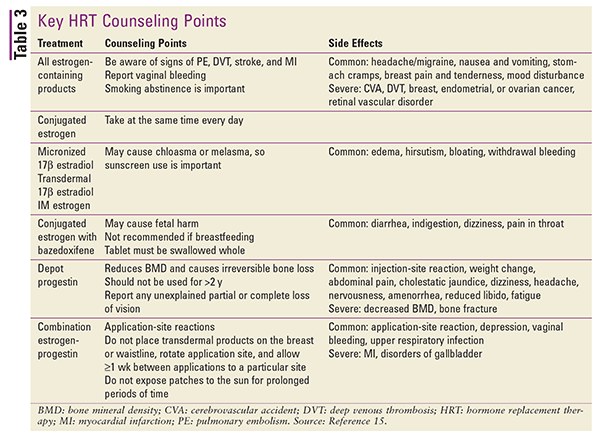
Reportez-vous au TABLEAU 3 pour un résumé des principaux points de conseil aux patientes et des effets secondaires des différents types de THS.15
Conclusion
Le THS, qui est disponible dans un large éventail de préparations, est le traitement le plus efficace à la fois pour le SMV et les symptômes génito-urinaires. Comme les risques associés au THS sont différents pour chaque femme, le traitement doit être individualisé et viser à maximiser l’efficacité, à minimiser la durée du traitement et à réduire le risque d’effets indésirables. Dans les scénarios où le THS n’est pas une option, des options de traitement non hormonal pour le SMV et les symptômes génito-urinaires sont disponibles, mais l’efficacité et l’approbation de ces produits par la FDA varient ; par conséquent, les données sur l’efficacité de ces produits devraient être examinées.
1. Stuenkel CA, Davis SR, Gompel A, et al. Traitement des symptômes de la ménopause : une directive de pratique clinique de l’Endocrine Society. J Clin Endocrinol Metab. 2015;100(11):3975-4011.
2. Shifren JL, Schiff I. Rôle de l’hormonothérapie dans la gestion de la ménopause. Obstet Gynecol. 2010;115(4):839-855.
3. Le comité consultatif de la déclaration de position 2017 sur l’hormonothérapie de la NAMS. L’énoncé de position 2017 sur l’hormonothérapie de la Société nord-américaine de la ménopause. Ménopause. 2017;24(7):728-753.
4. Bulletin de pratique ACOG n° 141 : gestion des symptômes de la ménopause. Obstet Gynecol. 2014;123(1):202-216.
5. Thurston RC, Sutton-Tyrrell K, Everson-Rose SA, et al. Bouffées de chaleur et maladies cardiovasculaires subcliniques : résultats de l’étude de la santé des femmes à travers la nation Heart Study. Circulation. 2008;118(12):1234-1240.
6. Thurston RC, Kuller LH, Edmundowicz D, Matthews KA. Histoire de bouffées de chaleur et de calcification aortique chez les femmes ménopausées. Ménopause. 2010;17(2):256-261.
7. Thurston RC, Sutton-Tyrrell K, Everson-Rose SA, et al. Hot flashes and carotid intima media thickness among midlife women. Menopause. 2011;18(4):352-358.
8. Crandall CJ, Aragaki A, Cauley JA, et al. Associations of menopausal vasomotor symptoms with fracture incidence. J Clin Endocrinol Metab. 2015;100(2):524-534.
9. Maki PM. La mémoire verbale et la ménopause. Maturitas. 2015;82(3):288-290.
10. North American Menopause Society. L’énoncé de position 2012 sur l’hormonothérapie de : La Société nord-américaine de la ménopause. Menopause. 2012;19(3):257-271.
11. Palacios S, Silverman SL, de Villiers TJ, et al. Un essai randomisé et contrôlé par placebo de 7 ans évaluant l’efficacité et la sécurité à long terme du bazédoxifène chez les femmes ménopausées atteintes d’ostéoporose : effets sur la densité osseuse et les fractures. Menopause. 2015;22(8):806-813.
12. Archer DF, Freeman EW, Komm BS, et al. Analyse groupée des effets des œstrogènes conjugués/bazéoxifène sur les symptômes vasomoteurs dans les essais sur les œstrogènes sélectifs, la ménopause et la réponse à la thérapie. J Womens Health (Larchmt). 2016;25(11):1102-1111.
13. FDA. Livre orange : produits pharmaceutiques approuvés avec des évaluations d’équivalence thérapeutique. Détails du produit pour ANDA 204726. www.accessdata.fda.gov/scripts/cder/ob/results_product.cfm?Appl_Type=A&Appl_No=204726. Consulté le 18 mars 2018.
14. FDA. Drugs@FDA : Produits pharmaceutiques approuvés par la FDA. www.accessdata.fda.gov/scripts/cder/daf/index.cfm. Consulté le 17 juin 2018.
15. DrugDex . Greenwood Village, CO : Truven Health Analytics, Inc. www.micromedexsolutions.com. Consulté le 15 juin 2018.
16. Constantine G, Graham S, Portman DJ, et al. Female sexual function improved with ospemifene in postmenopausal women with vulvar and vaginal atrophy : results of a randomized, placebo-controlled trial. Climacteric. 2015;18(2):226-232.
17. Labrie F, Archer DF, Koltun W, et al. Efficacité de la déhydroépiandrostérone (DHEA) intravaginale sur la dyspareunie et la sécheresse vaginale modérées à sévères, les symptômes de l’atrophie vulvo-vaginale et du syndrome génito-urinaire de la ménopause. Menopause. 2016;23(3):243-256.