Abstrait
Des complications comme la fuite anastomotique (AL) après des procédures colorectales sont associées à une morbidité importante. Une fuite anastomotique subclinique peut être trompeuse en raison de son comportement clinique et pose donc un dilemme diagnostique. Parfois, les examens radiologiques sont un complément mais peuvent être un détour dans la progression du diagnostic. Nous présentons un cas d’AL subclinique où une erreur de diagnostic a conduit à des résultats défavorables. Chez les patients sensibles, les résultats du diagnostic doivent être interprétés avec prudence en fonction du scénario clinique. Les chirurgiens et les radiologues doivent être bien familiarisés avec les différentes présentations des complications postopératoires après une chirurgie gastro-intestinale inférieure et leurs manifestations sur l’imagerie.
Mots clés
fuite anastomotique, fuite subclinique, lavement de contraste
Introduction
Les procédures colo-rectales constituent une part importante de la chirurgie générale. Malgré tous les progrès et une technique chirurgicale précise, les complications, notamment la fuite anastomotique (FA), entraînent une morbidité et une mortalité importantes . Une fuite locale ou confinée ne présente pas de symptômes alarmants et est donc appelée fuite anastomotique subclinique. La tomodensitométrie (TDM) de l’abdomen est devenue la méthode de choix pour évaluer les complications post-chirurgicales. Bien que sa supériorité dans de tels cas ne soit plus à prouver, les erreurs humaines dans les rapports conduisant à des résultats inférieurs aux normes ne sont pas rares. La confiance dans l’imagerie comme outil de diagnostic pour remplacer le jugement clinique (en raison de l’impact médico-légal), est devenue un sujet de préoccupation.
Présentation du cas
Un homme de 82 ans a été admis à l’unité médicale pour une léthargie inhabituelle. Il avait subi une résection antérieure assistée par laparoscopie avec une iléostomie de couverture pour un adénocarcinome du milieu du rectum six semaines auparavant. L’anastomose a été réalisée avec une agrafeuse circulaire de 30 mm. Pendant la présentation actuelle, il s’est plaint d’une augmentation du débit de la stomie et d’une fatigue inhabituelle. L’examen physique était sans particularité. Les tests hématologiques de routine ont montré un rapport urée/créatinine élevé et des anomalies des électrolytes. La gestion des anomalies de volume et d’électrolytes a été initiée.
Par la suite, le débit de la stomie a progressivement diminué et le patient a commencé à se plaindre de douleurs abdominales et de vomissements. L’équipe chirurgicale a été impliquée à ce stade des soins. Les radiographies abdominales ont montré des boucles dilatées de l’intestin grêle et de multiples niveaux de liquide aérien. La tomographie abdominale a montré des boucles dilatées de l’intestin grêle. L’anastomose colorectale était intacte et ne présentait aucun signe de fuite. Le diagnostic différentiel était soit une occlusion intestinale adhésive, soit un iléus secondaire à des anomalies électrolytiques. La décompression nasogastrique et la réanimation liquidienne ont commencé. En prévision d’un rétablissement retardé en raison des adhérences et de la chirurgie antérieure, une alimentation parentérale a été mise en place. Initialement, les caractéristiques obstructives se sont améliorées après 48 heures avec le retour de la fonction de la stomie.
Cependant, lors de la réintroduction de liquides oraux clairs, le patient a développé des douleurs récurrentes et des vomissements bilieux. Un produit de contraste hydrosoluble a été administré par sonde nasogastrique (NGT) pour obtenir des résultats diagnostiques et thérapeutiques. L’étude a rapporté une obstruction de l’intestin grêle à proximité du site de l’iléostomie et une administration de contraste par l’iléostomie a été conseillée par le radiologue pour confirmation. Une sonde de Foley a été insérée dans la stomie et le patient a été envoyé au service d’imagerie pour un nouveau scanner. De manière inattendue, le rapport a suggéré des extravasations de contraste dans la cavité péritonéale et le pneumopéritoine. Une perforation au site de l’iléostomie, peut-être due au cathéter, a été suggérée comme une cause possible.
Envisageant une perforation de l’iléostomie, la décision a été prise pour une laparotomie d’urgence. Comme c’était la sixième semaine depuis la procédure primaire, un lavement de contraste hydrosoluble a été effectué pour vérifier l’intégrité de l’anastomose avant une éventuelle résection ou inversion de l’iléostomie si nécessaire. Il a été rapporté que l’anastomose colorectale était intacte avec une bonne distension rectale. La mise en commun du contraste libre dans le pelvis a été supposée comme un débordement de la perforation de l’iléostomie lors de l’instance précédente (Figure 1 flèche).
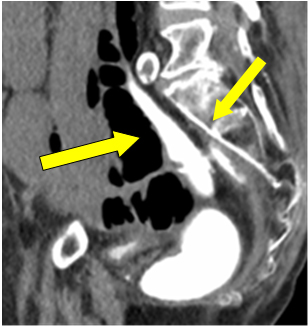
Figure 1 : Extravasation du contraste dans le pelvis.
Une laparotomie médiane de re-regard a été effectuée. De manière surprenante, aucune perforation macroscopique n’a été visualisée. Les résultats comprenaient une quantité modérée de fluides hémosériques avec quelques adhérences fibrineuses sans aucune bande obstructive. Des boucles d’intestin grêle de calibre normal et adhérentes ont été remarquées dans le bassin. Elles n’ont pas été dérangées par le chirurgien (pas de fuite anastomotique à l’imagerie). Une adhésiolyse de l’intestin grêle restant a été effectuée et l’iléostomie a été inversée.
Le patient a été transféré dans une unité de haute dépendance et a été étroitement surveillé. Il est resté stable jusqu’au cinquième jour postopératoire où il est devenu délirant et a développé une fibrillation auriculaire rapide. On a constaté que la plaie de laparotomie était en déhiscence. Compte tenu de la complexité de l’histoire chirurgicale, une nouvelle tomodensitométrie était justifiée pour établir une feuille de route. Il a montré un pneumopéritoine étendu et une collection d’environ 200 ml de liquide augmentant le bord dans la gouttière paracolique gauche. Le patient a de nouveau été emmené au bloc opératoire des urgences où une réexploration a été effectuée. A l’ouverture de l’abdomen, une péritonite féculente était présente avec un large défaut dans l’anastomose colorectale caché par des adhérences de l’intestin grêle au site. L’anastomose a été retirée et une stomie sigmoïde terminale a été créée avec fermeture du moignon rectal.
Le patient a eu une convalescence lente et a été transféré dans un établissement de réadaptation. Il a finalement été renvoyé chez lui après avoir passé 14 jours en soins transitoires.
Discussion
L’AL reste la principale cause de morbidité et de mortalité en chirurgie colorectale. Si elle n’est pas rapidement identifiée et traitée de manière appropriée, le taux de mortalité peut atteindre 50 % . Une stomie défectueuse peut ne pas garantir l’intégrité de l’anastomose gastro-intestinale inférieure.
Différents termes et grades anastomotiques ont été décrits dans la littérature. La gestion clinique dépend du site anatomique, du degré de fuite et de la gravité des symptômes. Les caractéristiques subliniques des fuites confinées entraînent souvent une confusion dans le diagnostic. Un indice de suspicion élevé et une détection précoce sont la clé d’une prise en charge clinique rapide. L’absence de détection précoce entraînera une détérioration clinique et une charge supplémentaire sur l’économie du système de santé.
La tomodensitométrie est l’examen le plus facilement disponible pour les complications intestinales postopératoires. Certaines caractéristiques radiologiques de fuite comme l’air ou le liquide péri-anastomotique ou une combinaison des deux peuvent être rarement présentes. Cependant, son efficacité diagnostique dans les AL de l’intestin inférieur n’est pas bien établie. L’imagerie peut être difficile à interpréter en raison des changements postopératoires et d’autres facteurs de confusion tels que le pneumopéritoine résiduel, la cicatrisation ou l’accumulation inflammatoire des tissus mous pré-sacrés. La taille et l’étendue de la fuite sont un autre facteur important à garder à l’esprit.
Le lavement de contraste permet non seulement de démontrer le taux et l’étendue de la fuite mais aide également à diagnostiquer des phénomènes comme les collections pré-sacrées. Son rôle en tant qu’étude de routine avant l’inversion de la stomie de dérivation est encore discutable, en particulier chez les patients cliniquement insoupçonnables. Cependant, des études ont montré la supériorité du lavement de contraste hydrosoluble dans la détection de fuites dans l’anastomose distale où les deux modalités sont utilisées.
Diverses études ont également rapporté des taux de faux négatifs de 35% à 49% pour l’imagerie radiologique des fuites anastomotiques suspectées .
Dans les situations difficiles, il faut s’appuyer sur le jugement clinique plutôt que d’être dirigé par l’imagerie seule, car une scintigraphie négative n’est pas une réponse définitive si la suspicion clinique n’est pas traitée de manière appropriée.
Dans ce scénario, l’obstruction intestinale était un leurre (probablement un iléus en cours dû à une septicémie subclinique). Lors de la première exploration, aucune fuite macroscopique n’a été trouvée dans l’iléostomie. L’histologie de la pièce réséquée n’a montré aucune lésion de la muqueuse. Cependant, une déchirure sérologique suggérait que le cathéter avait traversé une voie sous-séreuse avant de pénétrer dans le péritoine. Une analyse rétrospective des images a été réalisée avec le service de radiologie. Sur l’un des films, on a constaté que l’extrémité du cathéter traversait le plan sous-cutané (figure 2). Cela explique le contraste libre dans la cavité péritonéale, plutôt que la perforation luminale réelle de l’iléostomie. L’hypothèse sur l’origine du contraste a contribué à l’énigme du diagnostic.
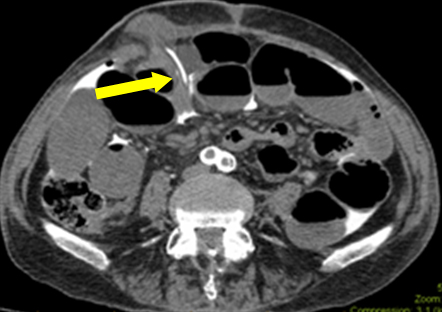
Figure 2 : Image axiale montrant l’extrémité du cathéter pénétrant du plan sous-cutané dans la cavité péritonéale
Bien que triviale, mais la fuite et l’accumulation de contraste près du site anastomotique sur le lavement était une découverte significative. Malheureusement, elle a été attribuée à la partie des extravasations antérieures par la perforation de la stomie.
Le patient avait récemment été opéré pour une tumeur maligne et, en raison d’une mauvaise alimentation et d’une obstruction intestinale continue, la guérison de l’anastomose était déjà compromise. En raison d’une précédente résection antérieure basse, les boucles de l’intestin grêle adhéraient au pelvis, confinant l’AL initialement mineure, d’où l’absence de caractéristiques cliniques classiques. Une fois que l’iléostomie a été inversée et que la diversion fécale n’était plus présente pour protéger l’intégrité anastomotique, la taille de la fuite a progressé et a conduit à une détérioration avec péritonite et déhiscence abdominale.
Des erreurs de diagnostic peuvent se produire dans n’importe quel domaine de la médecine. Il faut être prudent dans l’interprétation des résultats des études dans le contexte de l’acuité clinique . Nous pouvons réduire ces incidences en vérifiant systématiquement les scanners avant les procédures et aussi la banque de futurs cas peut être établie par un retour constructif régulier pour l’imagerie qui diffère des résultats opératoires.
Les patients atteints d’une maladie néoplasique, associée à d’autres comorbidités et à un état nutritionnel compromis, sont très susceptibles d’altérer la guérison d’une anastomose intestinale. Ils doivent être considérés comme vulnérables à une anastomose subclinique, en particulier lorsque les signes classiques de fuite sont absents. La radiologie postopératoire doit être interprétée avec précaution dans ce cas et l’intervention chirurgicale peut servir de meilleur mode de diagnostic et donc de mode thérapeutique également.
En outre, l’apprentissage de la radiologie chirurgicale est d’une importance capitale pour les chirurgiens et un retour d’information régulier aux radiologues peut aider à identifier de nouvelles présentations de complications postopératoires après une chirurgie colorectale.
- Trencheva K, Morrissey KP, Wells M, Mancuso CA, Lee SW, et al. (2013) Identification des prédicteurs importants de fuite anastomotique après une résection du côlon et du rectum : étude prospective sur 616 patients. Ann Surg 257 : 108-113.
- Lim M, Akhtar S, Sasapu K, Harris K, Burke D, et al. (2006) Fuites cliniques et subcliniques après anastomose colorectale basse : une étude clinique et radiologique. Dis Colon Rectum 49 : 1611-1619.
- Bruce J, Krukowski ZH, Al-Khairy G, Russell EM, Park KG (2001) Revue systématique de la définition et de la mesure de la fuite anastomotique après une chirurgie gastro-intestinale. Br J surg 88 : 1157-1168.
- Guillem JG, Cohen AM (1999) Current issues in colorectal cancer surgery. Semin Oncol 26 : 505-513.
- Leester B, Asztalos I, Polnyib C (2002) Complications septiques après résection rectale antérieure basse–la dérivation de la stomie est-elle encore justifiée ? Acta Chir Iugosl 49 : 67-71.
- Power N, Atri M, Ryan S, Haddad R, Smith A (2007) CT assessment of anastomotic bowel leak. Clin Radiol 62 : 37-42.
- Nicksa GA, Dring RV, Johnson KH, Sardella WV, Vignati PV, et al. (2007) Anastomotic leaks : what is the best diagnostic imaging study ? Dis Colon Rectum 50 : 197-203.
- Kalady MF, Mantyh CR, Petrofski J, Ludwig KA (2008) Imagerie de contraste de routine de l’anastomose pelvienne basse avant la fermeture d’une iléostomie défonctionnelle : est-elle nécessaire ? J Gastrointest Surg 12 : 1227-1231.
- Khair G, Alhamarneh O, Avery J, Cast J, Gunn J, et al. (2007) Utilisation systématique du lavement de gastrograffine avant l’inversion d’une iléostomie à anse. Dig Surg 24 : 338-341.
- Akyol AM, McGregor JR, Galloway DJ, George WD (1992) Radiologie de contraste postopératoire précoce dans l’évaluation de l’intégrité des anastomoses colorectales. Int J Colorectal Dis 7 : 141-143.
- Goligher JC, Graham NG, De Dombal FT (1970) Déhiscence anastomotique après résection antérieure du rectum et du sigmoïde. Br J Surg 57 : 109-118.
- Haynes IG, Goldman M, Silverman SH, Alexander-Williams J, Keighley MR (1986) The Water-soluble contrast enema after colonic anastomosis. Br J Surg 69 : 714-717.
- Khoury W, Ben-Yehuda A, Ben-Haim M, Klausner JM, Szold O (2009) Abdominal computed tomography for diagnosing postoperative lower gastrointestinal tract leaks. J Gastrointest Surg 13 : 1454-1458.
- Doeksen A, Tanis PJ, Wüst AF, Vrouenraets BC, van Lanschot JJ, et al. (2008) Évaluation radiologique des anastomoses colorectales. Int J Colorectal Dis 23 : 863-868.