L’utilisation et l’importance des piles et des batteries sont indiscutables. Dans notre vie de tous les jours, nous utilisons les piles de tant de façons différentes. Maintenant, dans les quelques concepts précédents, nous vous avons déjà présenté les piles en général. Cependant, ici nous allons vous donner une analyse approfondie des piles galvaniques. Alors, commençons.
Vidéos suggérées
Piles galvaniques
Parmi les autres piles, une pile galvanique est un type de pile électrochimique. Elle permet de fournir du courant électrique en réalisant le transfert d’électrons par une réaction d’oxydoréduction. Une pile galvanique est une idée exemplaire de la façon dont l’énergie peut être exploitée à l’aide de réactions simples entre quelques éléments donnés. Il est étonnant d’étudier comment une cellule galvanique peut être mise en place et utilisée pour obtenir de l’énergie.
Expliquant dans les termes les plus simples, une cellule galvanique agit comme un dispositif dans lequel des réactions simultanées d’oxydation et de réduction ont lieu. Ces réactions sont utilisées pour convertir l’énergie chimique en énergie électrique, qui peut être utilisée à toutes fins commerciales.
Plus de sujets sous Électrochimie
- Batteries
- Conductance des solutions électrolytiques
- Corrosion
- Piles électrochimiques
- Piles électrolytiques et électrolyse
- Piles à combustible
- Équation de Nernst
- Variation de la conductivité et de la conductivité molaire avec la concentration
.
Fonctionnement des piles galvaniques

Le fonctionnement d’une pile galvanique est assez simple. Il implique une réaction chimique qui rend l’énergie électrique disponible comme résultat final. Au cours d’une réaction d’oxydoréduction, une cellule galvanique utilise le transfert d’énergie entre les électrons pour convertir l’énergie chimique en énergie électrique.
La cellule galvanique utilise la capacité de séparer le flux d’électrons dans le processus d’oxydation et de réduction, en provoquant une demi-réaction et en connectant chacun d’eux avec un fil afin qu’un chemin puisse être formé pour le flux d’électrons à travers un tel fil. Ce flux d’électrons est essentiellement appelé un courant. On peut faire circuler un tel courant dans un fil pour compléter un circuit et obtenir sa sortie dans n’importe quel appareil tel qu’une télévision ou une montre.
Une cellule galvanique peut être fabriquée à partir de deux métaux quelconques. Ces deux métaux peuvent former l’anode et la cathode s’ils sont laissés en contact l’un avec l’autre. Cette combinaison permet la corrosion galvanique de ce métal qui est plus anodique. Un circuit de connexion est nécessaire pour permettre à cette corrosion de se produire.
Mise en place d’une cellule galvanique
Pour créer une cellule galvanique, il faudrait passer par la mise en place suivante. La cellule comprendrait idéalement deux électrodes. L’une de ces électrodes, la cathode, sera une électrode chargée positivement tandis que l’autre, sera l’anode, l’électrode chargée négativement.
Ces deux électrodes formeront les deux composants essentiels de la cellule galvanique. La réaction chimique liée à la réduction aura lieu à la cathode tandis que la demi-réaction d’oxydation aura lieu à l’anode. Comme cela a déjà été dit, n’importe quels deux métaux peuvent être utilisés pour créer la réaction chimique.
Comprendre la cellule galvanique avec un exemple
Prenons un exemple où les deux métaux impliqués dans la réaction chimique sont le zinc et le cuivre. Lorsque la réaction chimique a lieu, le zinc finit par perdre deux électrons. Ceux-ci seront pris en charge par le cuivre pour devenir du cuivre élémentaire. Comme ces deux métaux seront placés dans deux récipients distincts et qu’ils seraient reliés par un fil conducteur, un courant électrique se formerait, qui transférerait tous les électrons d’un métal à l’autre.
Dans le même temps, les deux métaux seront immergés dans une solution saline, disons, le sulfate de zinc et le sulfate de cuivre dans ce cas. Dans ce cas, les deux solutions ne sont pas mélangées directement mais peuvent être réunies à l’aide d’un pont ou d’un milieu. Ce milieu sera responsable du transfert des ions mais aussi s’assurera que les deux solutions ne viennent pas se mélanger l’une à l’autre.
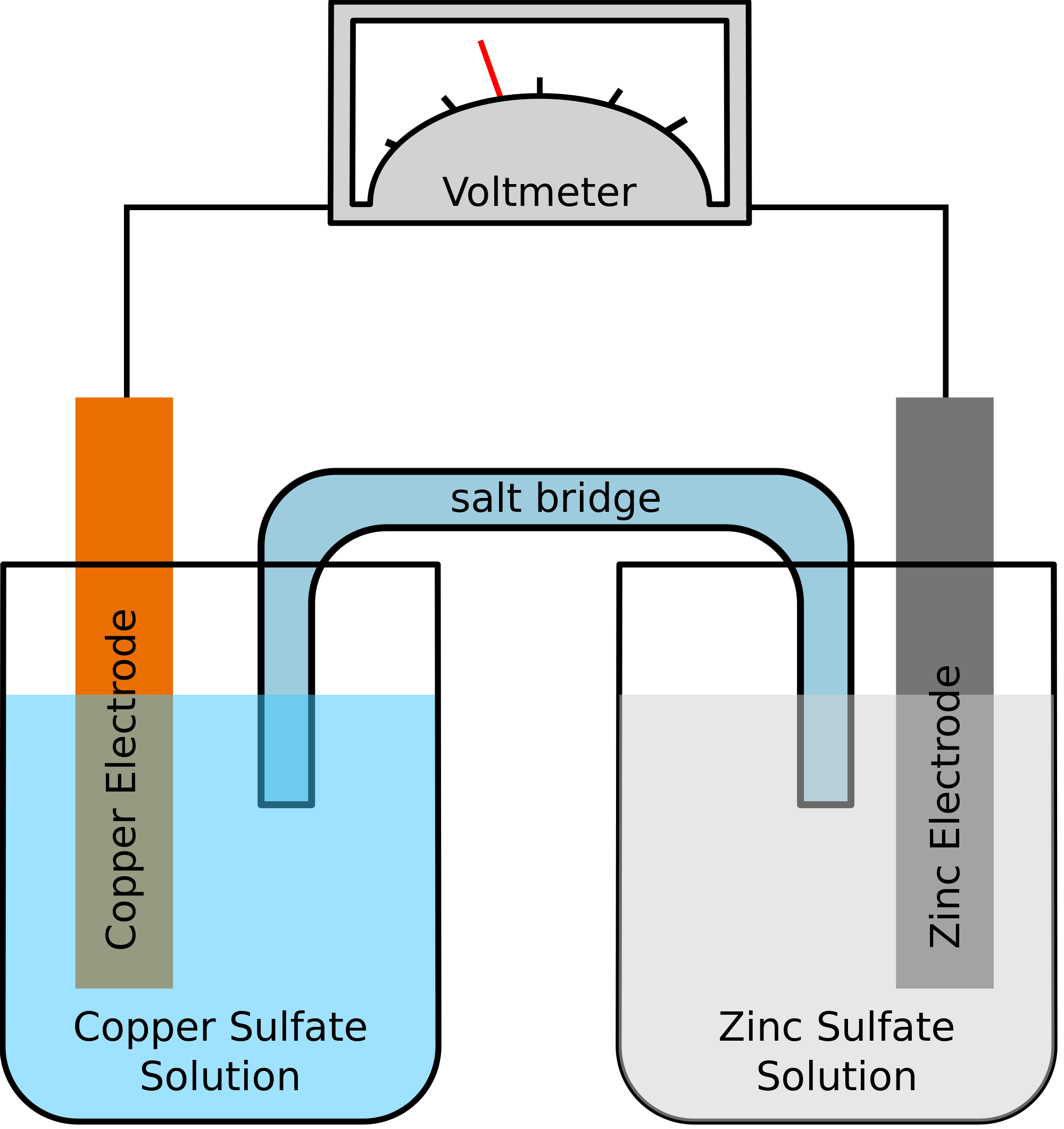
Ce pont aide à compléter le circuit pour transporter la charge électrique et s’assure également que les solutions dans les récipients avec les métaux restent neutres et ne se mélangent pas entre elles. Tant que le pont salin n’interfère pas avec la réaction d’oxydoréduction, sous laquelle l’oxydation et la réduction ont lieu, le pont salin utilisé dans la réaction chimique n’a pas d’importance.
Certains termes importants
Certains des termes importants mis en œuvre dans une cellule galvanique sont énumérés ci-dessous :
- Limites de phase : Elle se réfère aux deux métaux qui agissent comme cathode et anode.
- Pont salin : Le pont ou le milieu de connexion qui permet à une réaction d’oxydoréduction de se produire.
- Oxydation et réduction : Les processus chimiques qui permettent au courant électrique de se former et de circuler dans une cellule galvanique.
Des exemples résolus pour vous
Question : Dans une cellule galvanique, que se passerait-il si aucun pont de sel n’est utilisé pendant que la réaction d’oxydoréduction a lieu ?
Solution : En l’absence de pont salin à l’intérieur de chaque récipient contenant les métaux, la réaction d’oxydoréduction commencerait à peu près de la même façon. Mais en l’absence du pont salin, celle-ci s’arrêterait plutôt brusquement. Les solutions respectives ne seront pas en mesure de maintenir leur neutralité électrique. En dehors de cela, il n’y aura aucun changement dans la réaction chimique ou une altération de quelque type que ce soit en raison de l’absence du pont salin ou du milieu.
.