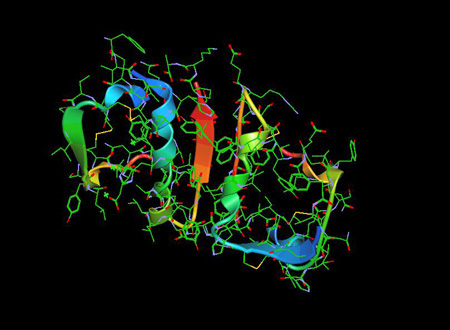
La molécule d’insuline 1ZNI PDB est une hormone pancréatique qui joue un rôle essentiel dans la régulation de la glycémie ainsi que du métabolisme des lipides et des glucides….
Pour la structure 3D de la molécule d’insuline à l’aide de Jsmol Cliquez
Overview
L’insuline est une hormone polypeptidique produite par les cellules β des îlots pancréatiques qui est principalement responsable de la régulation de la glycémie et du stockage des glucides et des lipides. Le diabète de type 1 est dû à une production insuffisante d’insuline causée par la destruction et la perte des cellules β des îlots pancréatiques produisant l’insuline. Le diabète de type 2 est dû à une résistance relative à l’insuline. Elle est considérée comme la principale hormone anabolisante de l’organisme. (1)
Structure de la protéine
L’insuline a été découverte comme étant un polypeptide en 1928 avec sa séquence d’acides aminés identifiée en 1952. C’est en fait un dipeptide, contenant respectivement les chaînes A et B, reliées par des ponts disulfures, et contenant 51 acides aminés, avec un poids moléculaire de 5802. Son point isoélectrique est de pH 5,5.5 La chaîne A comprend 21 acides aminés et la chaîne B 30 acides aminés. La chaîne A possède une hélice N-terminale liée à une hélice C-terminale antiparallèle ; la chaîne B possède un segment central hélicoïdal. Les deux chaînes sont reliées par deux liaisons disulfures, qui unissent les hélices N- et C-terminales de la chaîne A à l’hélice centrale de la chaîne B. Dans la pro-insuline, un peptide de liaison relie l’extrémité N-terminale de la chaîne A à l’extrémité C-terminale de la chaîne B.
Au sein des vertébrés, la séquence d’acides aminés de l’insuline est fortement conservée. L’insuline bovine ne diffère de l’insuline humaine que par trois résidus d’acides aminés, et l’insuline porcine par un seul. Même l’insuline de certaines espèces de poissons est suffisamment similaire à l’insuline humaine pour être cliniquement efficace chez l’homme. La séquence de l’insuline de certains invertébrés est assez semblable à celle de l’insuline humaine, et ses effets physiologiques sont similaires. La forte homologie observée dans la séquence de l’insuline de diverses espèces suggère qu’elle a été conservée pendant une grande partie de l’histoire de l’évolution animale. Le peptide C de la proinsuline, cependant, diffère beaucoup plus entre les espèces ; c’est aussi une hormone, mais secondaire.
L’insuline est produite et stockée dans l’organisme sous forme d’hexamère (une unité de six molécules d’insuline), alors que la forme active est le monomère. L’hexamère est une forme inactive stable à long terme, qui sert à protéger l’insuline hautement réactive, tout en étant facilement disponible. La conversion hexamère-monomère est l’un des aspects centraux des formulations d’insuline pour injection. L’hexamère est beaucoup plus stable que le monomère, ce qui est souhaitable pour des raisons pratiques ; cependant, le monomère est un médicament qui réagit beaucoup plus rapidement, car la vitesse de diffusion est inversement liée à la taille des particules.
Mécanismes de la sécrétion d’insuline
L’insuline est produite dans le pancréas et le corps de Brockmann (chez certains poissons), et libérée lorsque l’un de plusieurs stimuli est détecté. Ces stimuli comprennent les protéines ingérées et le glucose dans le sang produit par les aliments digérés. Les glucides peuvent être des polymères de sucres simples ou les sucres simples eux-mêmes. Si les glucides contiennent du glucose, ce dernier sera absorbé dans la circulation sanguine et la glycémie commencera à augmenter. Dans les cellules cibles, l’insuline déclenche une transduction du signal, qui a pour effet d’augmenter l’absorption et le stockage du glucose. Enfin, l’insuline est dégradée, mettant fin à la réponse.
Chez les mammifères, l’insuline est synthétisée dans le pancréas au sein des cellules bêta. Un million à trois millions d’îlots pancréatiques forment la partie endocrine du pancréas, qui est principalement une glande exocrine. La partie endocrine ne représente que 2 % de la masse totale du pancréas. Au sein des îlots pancréatiques, les cellules bêta constituent 65 à 80 % de l’ensemble des cellules.
La libération d’insuline
Régulation de la glycémie Les cellules bêta des îlots de Langerhans libèrent l’insuline en deux phases. La première phase de libération est rapidement déclenchée en réponse à l’augmentation de la glycémie, et dure environ 10 minutes. La deuxième phase est une libération lente et soutenue de vésicules nouvellement formées, déclenchée indépendamment du sucre, qui atteint son maximum en 2 à 3 heures. La réduction de la première phase de libération d’insuline peut être le premier défaut détectable des cellules bêta prédisant l’apparition du diabète de type 2. La libération de la première phase et la sensibilité à l’insuline sont des prédicteurs indépendants du diabète.
Les taux d’insuline dans le sang
Le taux d’insuline dans le sang peut être mesuré en unités internationales, comme les µIU/mL ou en concentration molaire, comme les pmol/L, où 1 µIU/mL équivaut à 6,945 pmol/L. Un taux sanguin typique entre les repas est de 8-11 μIU/mL (57-79 pmol/L).
Mécanisme d’action -Transduction du signal de l’insuline
Transduction du signal Les effets de l’insuline sont initiés par sa liaison à un récepteur présent dans la membrane cellulaire. La molécule du récepteur contient une sous-unité α- et β. Deux molécules sont jointes pour former ce que l’on appelle un homodimère. L’insuline se lie aux sous-unités α de l’homodimère, qui se trouve du côté extracellulaire des cellules. Les sous-unités β ont une activité enzymatique tyrosine kinase qui est déclenchée par la liaison de l’insuline. Cette activité provoque l’autophosphorylation des sous-unités β et, par la suite, la phosphorylation de protéines à l’intérieur de la cellule, appelées substrats du récepteur de l’insuline (IRS). La phosphorylation des IRS active une cascade de transduction du signal qui conduit à l’activation d’autres kinases ainsi que de facteurs de transcription qui médient les effets intracellulaires de l’insuline.
Action de l’insuline des effets physiologiques
les actions de l’insuline au niveau du métabolisme humain global comprennent : Augmentation de l’apport cellulaire de certaines substances, plus particulièrement le glucose dans les muscles et le tissu adipeux (environ deux tiers des cellules du corps) Augmentation de la réplication de l’ADN et de la synthèse des protéines via le contrôle de l’absorption des acides aminés Modification de l’activité de nombreuses enzymes.
Régulateur du métabolisme endocannabinoïde. L’insuline est un régulateur majeur du métabolisme des endocannabinoïdes (EC) et il a été démontré que le traitement à l’insuline réduit les EC intracellulaires, le 2-arachidonylglycérol (2-AG) et l’anandamide (AEA), ce qui correspond à des changements d’expression sensibles à l’insuline dans les enzymes du métabolisme des EC. Dans les adipocytes résistants à l’insuline, les schémas d’expression des enzymes induits par l’insuline sont perturbés d’une manière compatible avec une synthèse élevée des CE et une dégradation réduite des CE. Les résultats suggèrent que les adipocytes insulinorésistants ne parviennent pas à réguler le métabolisme des CE et à diminuer les niveaux de CE intracellulaires en réponse à la stimulation par l’insuline, ce qui explique que les individus obèses insulinorésistants présentent des concentrations accrues de CE. Cette dysrégulation contribue à l’accumulation excessive de graisse viscérale et à la réduction de la libération d’adiponectine par le tissu adipeux abdominal, et en outre à l’apparition de plusieurs facteurs de risque cardiométaboliques qui sont associés à l’obésité et au diabète de type 2.
1- Voet D, Voet JG (2011). Biochimie (4e éd.). New York : Wiley.
2-Gisela Wilcox (2005) Insuline et résistance à l’insuline, Clin Biochem Rev. 2005 Mai ; 26(2) : 19-39.
3- Rhoades RA, Bell DR (2009). Physiologie médicale : principes pour la médecine clinique (3e éd.). Philadelphie : Lippincott Williams & Wilkins. pp. 644-47.
4-Gerich JE (février 2002). « Is reduced first-phase insulin release the earliest detectable abnormality in individuals destined to develop type 2 diabetes ? ». Diabète. 51 (Suppl 1) : S117–21. doi:10.2337/diabetes.51.2007.s117. PMID 11815469.
5- Lorenzo C, Wagenknecht LE, Rewers MJ, Karter AJ, Bergman RN, Hanley AJ, Haffner SM (septembre 2010). « Indice de disposition, efficacité du glucose et conversion au diabète de type 2 : l’étude sur la résistance à l’insuline et l’athérosclérose (IRAS) ». Diabète
6- Un dictionnaire des unités de mesure Archivé 2013-10-28 à la Wayback Machine. Par Russ Rowlett, l’Université de Caroline du Nord à Chapel Hill. 13 juin 2001
7- Iwase H, Kobayashi M, Nakajima M, Takatori T (janvier 2001). « Le rapport entre l’insuline et le peptide C peut être utilisé pour établir un diagnostic médico-légal de surdosage d’insuline exogène ». Forensic Science International. 115 (1-2) : 123-27. doi:10.1016/S0379-0738(00)00298-X. PMID 11056282.
8- Xiang Z (juin 2006). « Progrès dans la modélisation de la structure des protéines par homologie ». Current Protein & Peptide Science. 7 (3) : 217-27. doi:10.2174/138920306777452312. PMC 1839925. PMID 16787261.
9- Zagrovic B, Snow CD, Shirts MR, Pande VS (novembre 2002). « Simulation du repliement d’une petite protéine alpha-hélicoïdale dans les détails atomistiques en utilisant le calcul distribué dans le monde entier ». Journal of Molecular Biology. 323 (5) : 927-37.
10-D’Eon TM, Pierce KA, Roix JJ, Tyler A, Chen H, Teixeira SR (mai 2008). « Le rôle de la résistance à l’insuline des adipocytes dans la pathogenèse des élévations des endocannabinoïdes liées à l’obésité ». Diabète. 57 (5) : 1262-68.
11- Di Marzo V (août 2008). « Le système endocannabinoïde dans l’obésité et le diabète de type 2 ». Diabetologia. 51 (8) : 1356-67. doi:10.1007/s00125-008-1048-2. PMID 18563385.