Voici le truc à propos de la couverture des « amines » dans Org 2 : il n’y a pas de narration.
Comme la plupart des chapitres, il ne commence pas par un ensemble de concepts et ne se construit pas jusqu’à une série d’exemples auxquels vous pouvez ensuite appliquer ces concepts.
Non. Un chapitre typique sur les amines dans un manuel d’introduction n’est essentiellement qu’un méli-mélo de sujets apparemment aléatoires jetés ensemble et qui n’avaient leur place nulle part ailleurs. Le seul fil conducteur est qu’elles contiennent de l’azote d’une manière ou d’une autre.
Cas d’école : le post aléatoire d’aujourd’hui sur les amines porte sur les réarrangements de Hofmann et de Curtius.
Qu’est-ce qui vous pousse à faire cela, vous pourriez vous demander ? Il n’y a pas de bonne réponse. La plupart des cours les couvrent à un moment ou à un autre, et ils doivent bien s’intégrer quelque part. Alors, que diable. Pourquoi pas maintenant ?
Table des matières
- Les réarrangements de Hofmann et Curtius
- Le mécanisme des réarrangements de Hofmann et Curtius, première partie – Mise en place du réarrangement
- Deuxième partie : l’étape clé du réarrangement dans les réarrangements de Hofmann et Curtius
- Troisième partie : Formation de l’isocyanate
- Mise en commun des étapes
- Le sort de l’isocyanate : Formation de carbamates, d’amines et d’urées
- Résumé : Les réarrangements de Hofmann et Curtius
- Notes
- (Avancé) Références et lectures complémentaires
- Les réarrangements de Hofmann et Curtius
- Le mécanisme des réarrangements de Hofmann et de Curtius, partie 1 : mise en place du réarrangement
- Partie 1 : Prélude
- 3. L’étape clé du réarrangement dans le Hofmann et le Curtius
- Formation de l’isocyanate
- Mettre les étapes ensemble
- Le sort de l’isocyanate
- Résumé : Les réarrangements de Hofmann et de Curtius
- Notes
- (Advanced) Références et lectures complémentaires
Les réarrangements de Hofmann et Curtius
Les réarrangements de Hofmann et Curtius sont deux exemples de toute une famille de réactions de réarrangement qui partagent une étape mécanistique commune.
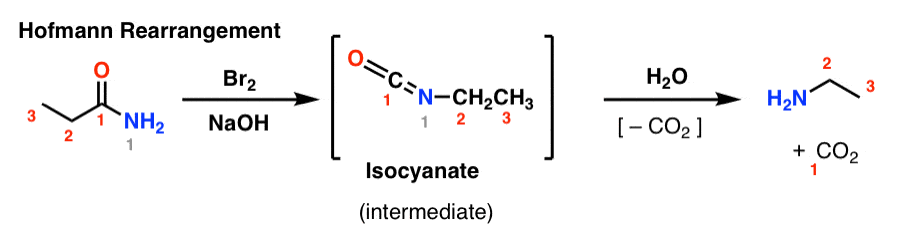
Dans le réarrangement de Hofmann, un amide est traité avec du brome et une base (généralement NaOH ou KOH). En chauffant, un isocyanate intermédiaire est formé, qui n’est pas isolé. En présence d’eau, l’isocyanate perd du dioxyde de carbone ( » décarboxyle « ) pour donner une amine.
La liaison clé qui se forme dans le Hofmann est la liaison C2-N. Notez comment le groupe carbonyle (C1) est perdu, formant du dioxyde de carbone (CO2). (note : ce n’est pas une numérotation UICPA, juste une numérotation pour faciliter la discussion)
Dans le réarrangement de Curtius, un azide d’acyle est chauffé, et un isocyanate est formé. Dans le réarrangement de Curtius, l’isocyanate peut être isolé, mais il est généralement transformé plus loin en d’autres espèces telles qu’un carbamate, une urée, ou (par décarboxylation, comme dans le Hofmann) en une amine (plus sur ces derniers ci-dessous).
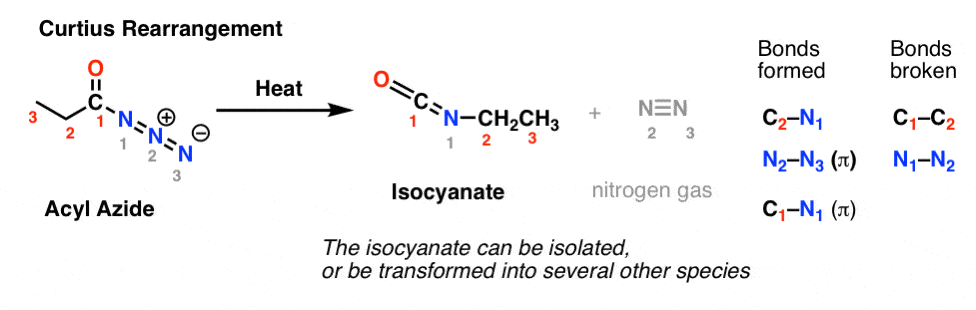
L’observation clé à noter dans les deux cas est que la liaison C1-C2 a été rompue, et qu’une nouvelle liaison C2-N s’est formée.
La question est COMMENT ?
Le mécanisme des réarrangements de Hofmann et de Curtius, partie 1 : mise en place du réarrangement
Le mécanisme des réarrangements de Curtius et de Hofmann comporte quatre parties importantes, et nous allons toutes les parcourir.
- Préliminaire (simple)
- L’étape clé de la migration (délicate, mais moins délicate si vous vous rendez compte que vous en avez vu une variante dans l’Org 1 !)
- Formation de l’isocyanate (simple)
4. Epilogue : Transformations de l’isocyanate
Partie 1 : Prélude
- Le réarrangement de Hofmann se produit avec un amide.
- Le réarrangement de Curtius se produit avec un azide d’acyle.
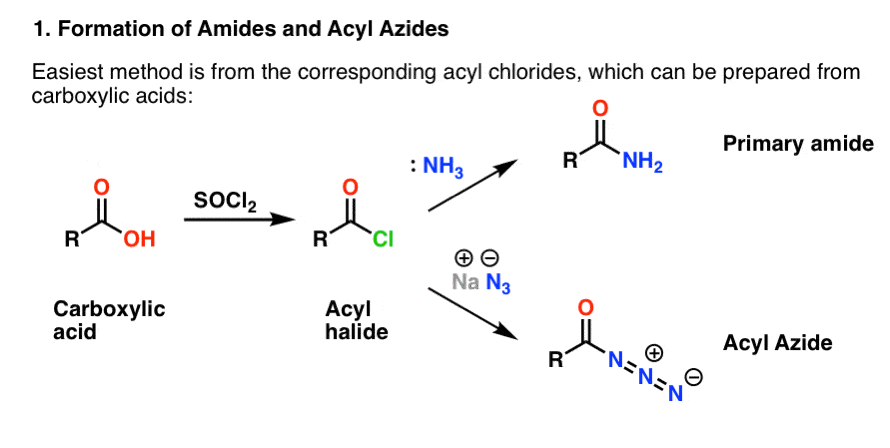
Les deux sont commodément préparés à partir d’halogénures d’acyle par une réaction d’addition-élimination. Si vous abordez les amines maintenant, alors les réactions carbonyles sont probablement un territoire familier. Les halogénures d’acyle peuvent être préparés à partir d’acides carboxyliques en utilisant un réactif comme le chlorure de thionyle (SOCl2) ou le pentachlorure de phosphore (PCl5).
Mise en place du Hofmann
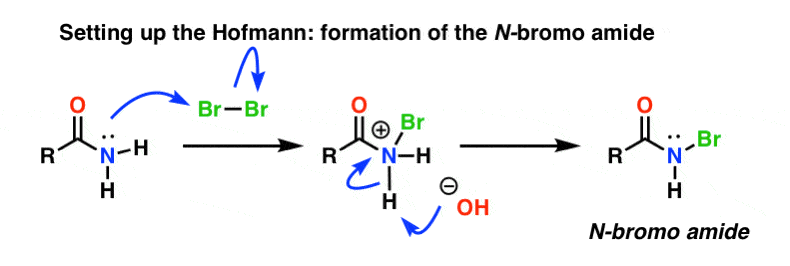
Dans le réarrangement de Hofmann, l’amide est traité avec du brome (Br2) et une base telle que NaOH. Il en résulte la rupture de N-H et la formation de N-Br, ce qui entraîne l’installation d’un bon groupe partant sur l’azote. On appelle cela un « N-bromo amide ».
Le Curtius n’a pas besoin d’être « installé », car l’azide d’acyle possède déjà un splendide groupe partant intégré : N2. C’est pourquoi les azides organiques doivent être traités avec précaution, car un traitement brutal peut conduire à des explosions.
3. L’étape clé du réarrangement dans le Hofmann et le Curtius
Maintenant, nous passons aux choses sérieuses.
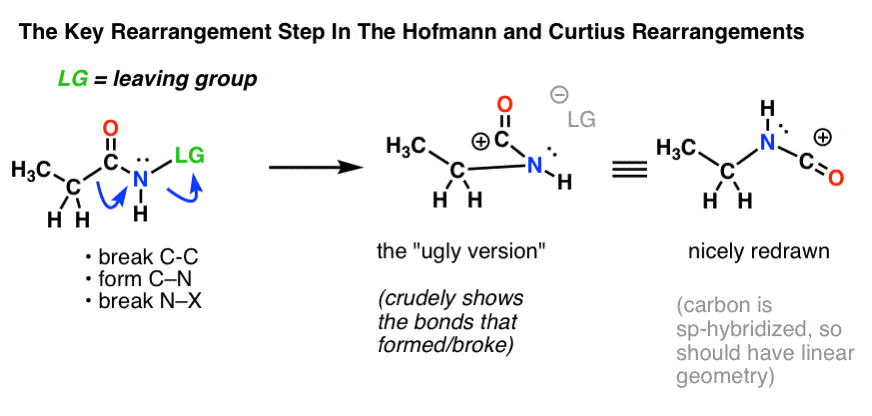
L’étape clé des réarrangements de Hofmann et Curtius est la migration d’un atome de carbone pour déplacer un groupe partant sur un azote adjacent.
Cela nécessite de dessiner deux flèches courbes, qui sont représentées dans la structure à l’extrême gauche (ci-dessous).
- Dans la première flèche courbe, la liaison C-C se rompt, et une nouvelle liaison C-N se forme.
- Dans la seconde flèche courbe, la liaison N-LG (groupe partant) se rompt.
Cependant, il n’est pas toujours facile de passer directement de la structure à l’extrême gauche à la structure à l’extrême droite (qui est dessinée joliment et proprement ! ).
Des points innombrables sont inutilement perdus aux examens chaque année par des étudiants qui obtiennent les flèches courbes correctement mais finissent par dessiner la mauvaise structure ! C’est pourquoi j’encourage les étudiants à dessiner d’abord une « version laide », qui ressemble à de la merde mais qui a au moins toutes les liaisons au bon endroit. Il sera toujours temps de la redessiner et de la rendre jolie plus tard.
Au début, ce réarrangement a probablement l’air… bizarre. Mais c’est en fait une réaction que vous avez déjà vue auparavant ! (mais sous une forme déguisée).
Quelqu’un se souvient du mécanisme de l’étape d' »oxydation » dans l’hydroboration-oxydation ?
C’est essentiellement la même chose !
Voici un rappel:
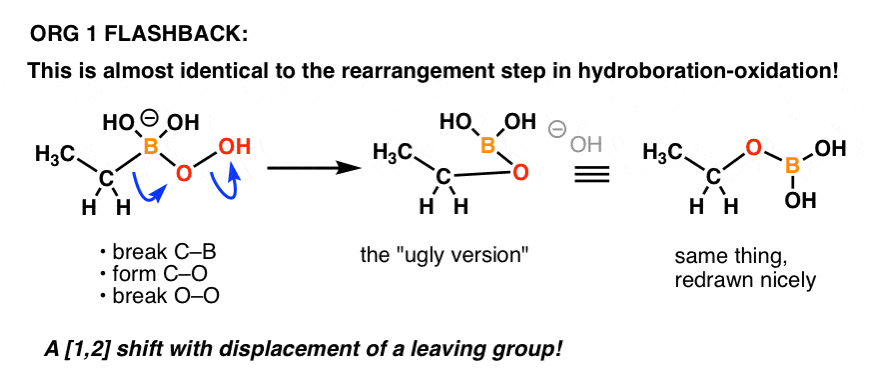
Un autre exemple de la façon dont les choses que vous apprenez dans une partie antérieure de la chimie organique peuvent revenir dans une partie ultérieure du cours !
Visitons l’étape de réarrangement spécifique des réarrangements de Hofmann et de Curtius avec des exemples concrets.
Voici l’étape clé du Hofmann, où le chauffage entraîne la rupture du C-C , la formation du C-N et la rupture du N-Br.
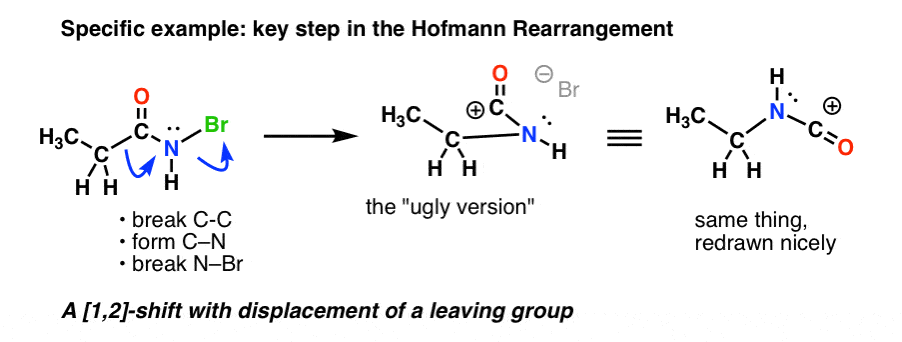
Si vous suivez toutes les flèches, vous devriez vous retrouver avec un carbocation d’apparence bizarre (en haut à droite) dont nous nous occuperons dans une minute.
Dans le Curtius, le chauffage de l’azide d’acyle entraîne un réarrangement. Le groupe partant est l’azote gazeux (N2).
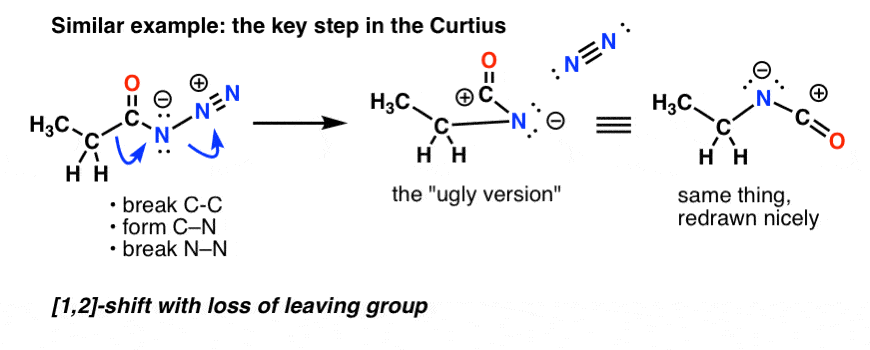
(Une différence subtile entre le Curtius et le Hofmann est qu’il n’y a pas d’hydrogène attaché à N dans le Curtius, donc on se retrouve avec une charge négative sur l’azote dans l’espèce réarrangée.)
Formation de l’isocyanate
L’étape suivante consiste à passer de notre espèce réarrangée à l’isocyanate. Pour toute personne habituée à dessiner des formes de résonance, cela ne devrait pas être trop difficile.
(Comme nous le verrons plus loin, des études ont déterminé que la formation de l’isocyanate se produit en même temps que la migration. Mais pour nos objectifs pédagogiques, je pense qu’il est utile de traiter cette étape de manière isolée. Nous pourrons tout reconstituer dans une minute).
Comme vous vous en souvenez peut-être de waayyyy back dans Org 1, une forme de résonance avec des octets complets est supérieure à une forme sans (révision rapide). Notre produit d’apparence bizarre issu du réarrangement a un carbocation adjacent à un azote contenant une paire solitaire. La première étape consiste donc à dessiner la formation d’une nouvelle liaison C-N pi. C’est essentiellement juste une forme de résonance.
Le réarrangement de Hofmann se produit en présence d’une base. Donc après avoir dessiné la forme de résonance, l’étape suivante est la déprotonation de la liaison N-H donnant l’isocyanate neutre.
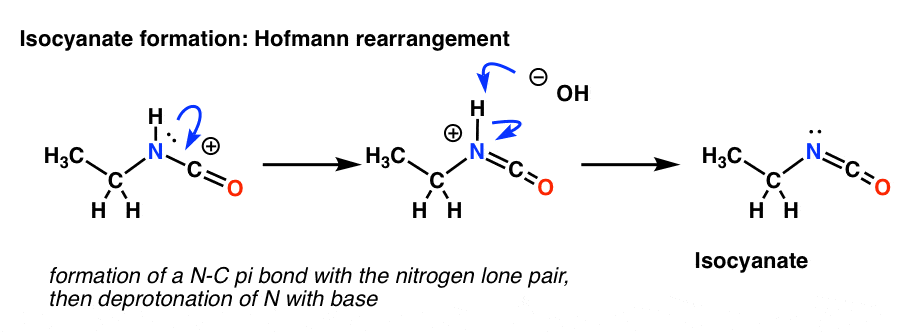
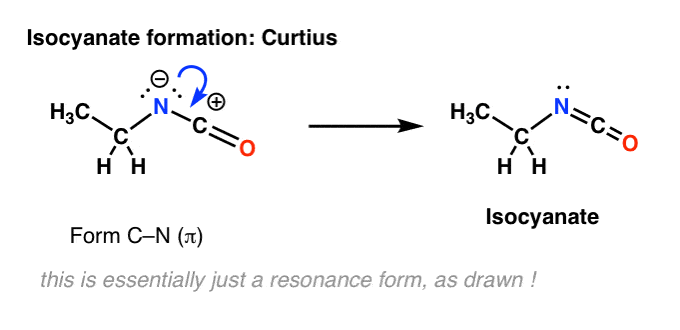
Il n’y a pas d’hydrogène sur l’azote dans le Curtius. Donc, la formation de l’isocyanate est obtenue simplement par le don d’une paire solitaire de l’azote au carbocation. Vous pouvez juste regarder cela comme le dessin d’une forme de résonance.
Mettre les étapes ensemble
Les études sur le mécanisme des réarrangements de Hofmann et de Curtius ont déterminé que ces deux étapes ne se produisent pas séquentiellement ; elles se produisent en fait en même temps ! (comment le savons-nous ? voir note 1 )
C’est-à-dire que la migration se produit en même temps que la formation de l’isocyanate.
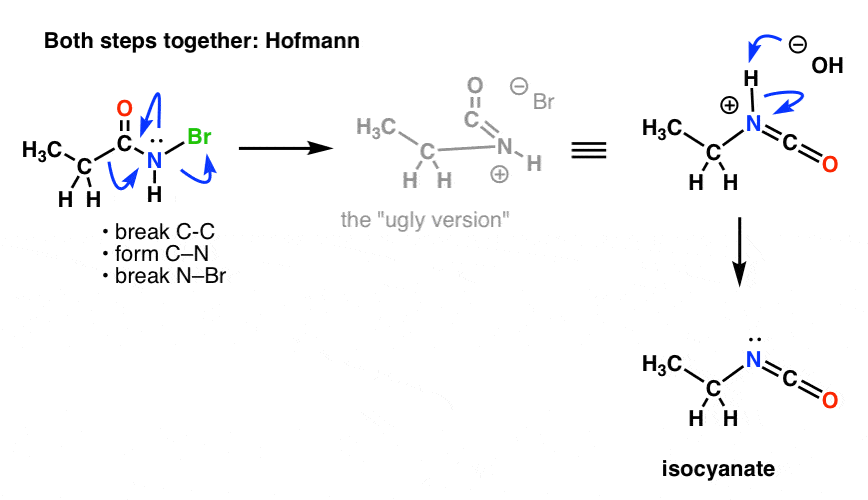
Nous devons redessiner les mécanismes de Hofmann et Curtius pour refléter cela, en incorporant les deux étapes.
Voici le Hofmann (notez que l’événement de déprotonation est en fait séparé).
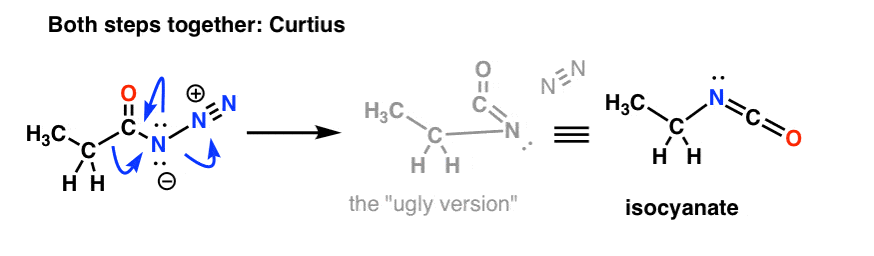
Et le Curtius:
Le sort de l’isocyanate
Les deux Hofmann et Curtius donnent lieu à un isocyanate. Vous n’avez probablement jamais rencontré d’isocyanates auparavant. À première vue, ce sont des espèces à l’aspect plutôt étrange, mais leur chimie n’est pas si différente de celle d’autres espèces carbonylées comme les esters, les amides et les halogénures d’acyle.
La structure de l’isocyanate ressemble beaucoup à celle du dioxyde de carbone, CO2. Le carbone est lié par une liaison pi à deux atomes fortement électronégatifs. Cela fait du carbone un excellent électrophile.
En ajoutant divers nucléophiles, les isocyanates peuvent être transformés en d’autres espèces utiles.
– L’ajout d’un alcool entraîne la formation d’un carbamate
– L’ajout d’une amine entraîne une urée
– L’ajout d’eau entraîne un acide carbamique, qui est instable. Les acides carbamiques perdent rapidement du dioxyde de carbone pour donner une amine.
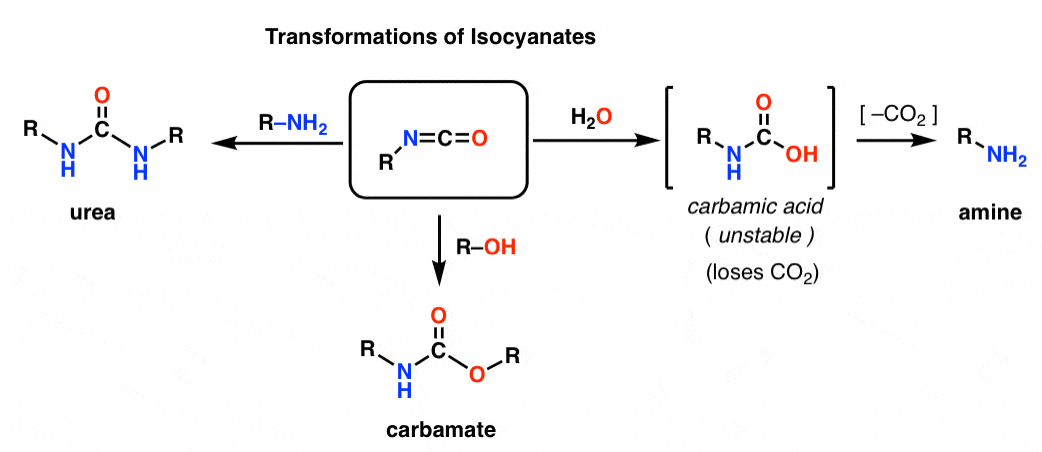
En particulier, la voie de décarboxylation présente un moyen astucieux de fabriquer des amines. Nous avons appris des tonnes de façons de fabriquer des acides carboxyliques, mais pas trop de façons de fabriquer des amines (à part la substitution nucléophile et l’amination réductrice). Le Hofmann est une bonne astuce à avoir dans votre poche arrière dans les situations où aucune de ces situations ne pourrait s’appliquer – comme la fabrication d’anilines substituées, par exemple.
Mécanismes ? OK, très bien. Voir le sujet bonus 1.
Résumé : Les réarrangements de Hofmann et de Curtius
Le mécanisme de ces réarrangements est délicat à première vue, mais il est considérablement facilité une fois que vous réalisez que vous avez déjà vu une variante de la réaction de migration auparavant (i.c’est-à-dire dans l’hydroboration-oxydation).
Je recommande vivement de dessiner d’abord la version laide, car cela vous aidera à vous concentrer pour voir les liaisons qui se forment et se brisent, avant d’essayer de la redessiner en une structure plus esthétiquement attrayante. Cela vaut également pour les réarrangements de Beckmann et de Wolff, qui ont une étape similaire.(voir ci-dessous)
Notes
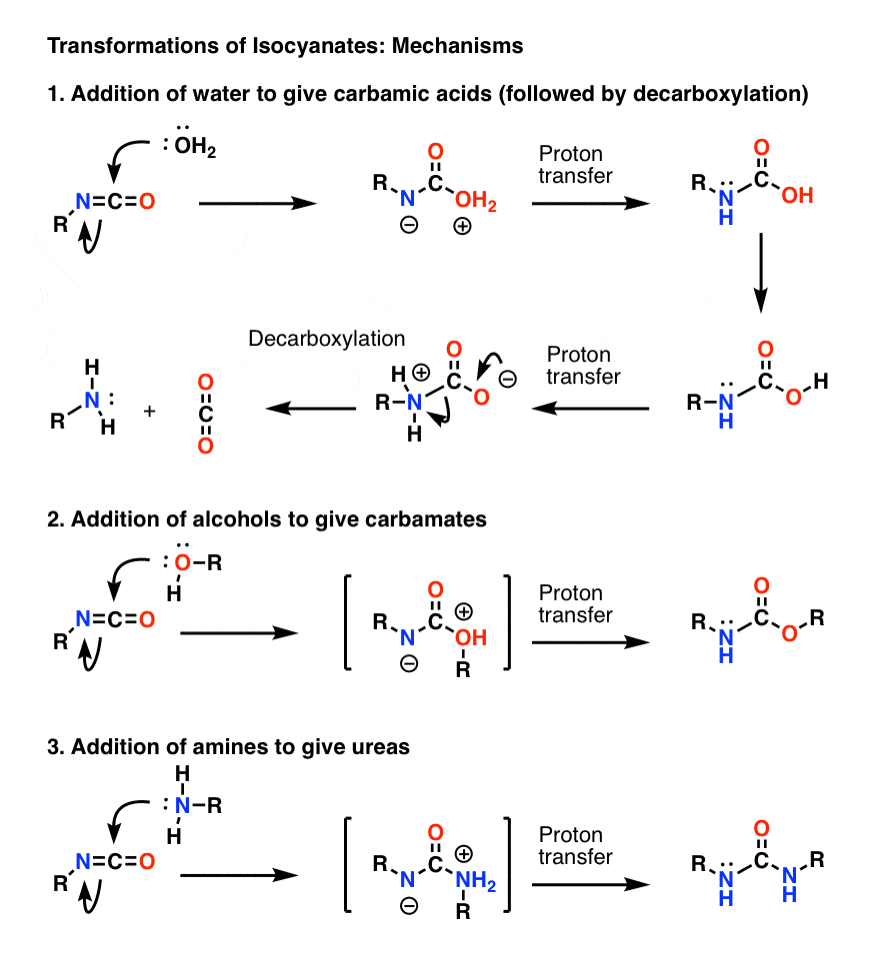
Thème bonus 1 : Les isocyanates
Le mécanisme le plus important des isocyanates est l’addition électrophile (c’est-à-dire l’ajout d’un nucléophile au carbone central, électrophile). Dans le mécanisme ci-dessous, j’ai montré le nucléophile s’ajoutant au carbone de manière à former un anion sur l’azote, bien que ce ne soit probablement pas la meilleure forme de résonance (l’oxygène est meilleur pour stabiliser la charge négative que l’azote). Le transfert de protons de l’oxygène à l’azote donne lieu à une espèce neutre. (J’ai utilisé la baguette magique de transfert de protons ici, parce que c’est plus rapide).
Notez que l’étape de décarboxylation en 1) n’a pas besoin d’être précédée par la déportation de l’oxygène, bien qu’elle doive certainement se produire de telle sorte que l’azote soit protoné pendant l’étape (vous ne voulez pas former un ion amide fortement basique, par exemple).
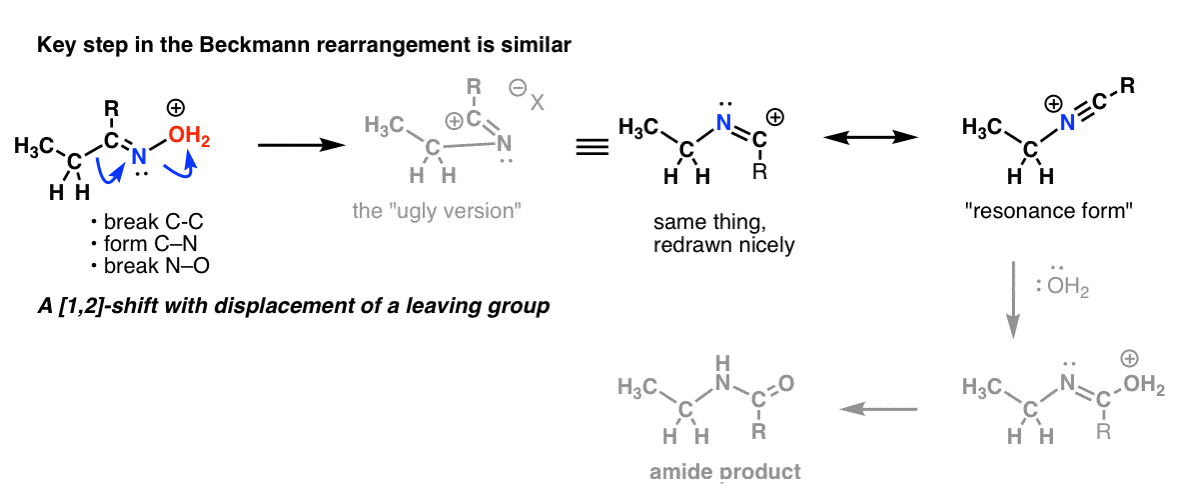
Thème bonus 2 : Les réarrangements de Beckmann, Wolff et autres partagent une étape similaire
Mais attendez, il y a plus !
Il y a un décalage 1,2 avec perte d’un groupe partant dans le réarrangement de Beckmann. L’étape clé est essentiellement la même que celle que nous avons vue dans le Hofmann et le Curtius.
Et dans le réarrangement de Wolff, qui est communément aussi couvert, vous pourriez aussi reconnaître la même étape clé.
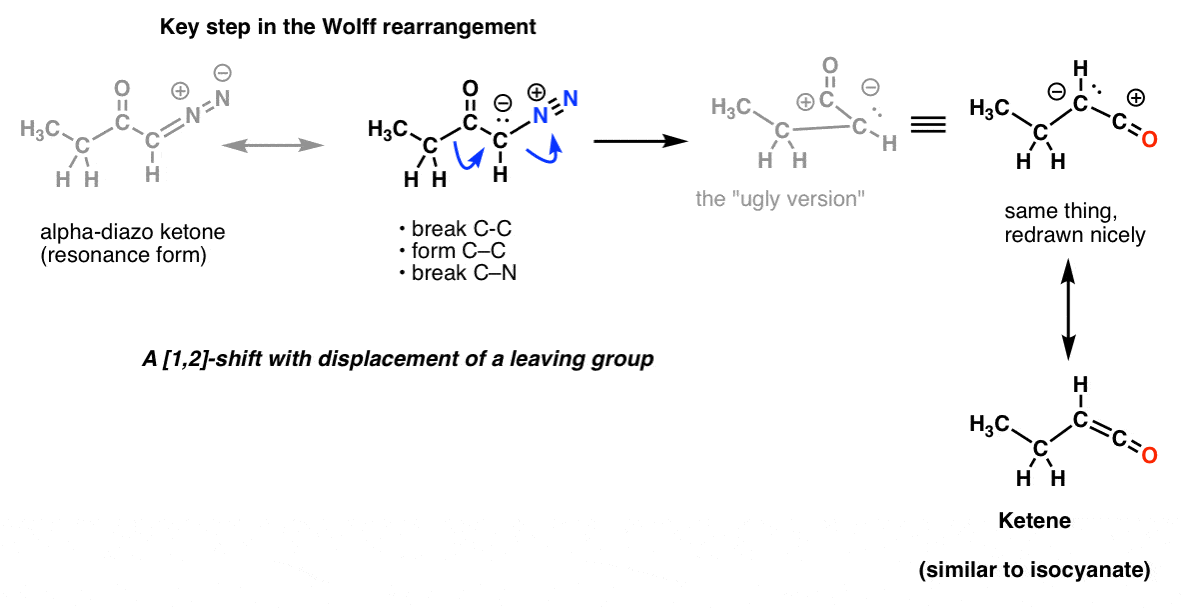
Et ce n’est pas tout ! Il y a une réaction appelée le réarrangement de Schmidt, qui est comme le Curtius, mais qui vient de l’ajout de HN3 à un chlorure d’acyle (ou acide carboxylique). Et il y en a une autre appelée réarrangement de Lossen qui se produit avec les acides hydroxyamiques. Il n’y a pas de prix pour deviner l’étape clé de ces deux processus. Et nous n’avons même pas mentionné le Baeyer-Villiger, qui n’implique pas l’azote, mais qui est à peu près le même type de processus.
Lorsque j’ai appris l’étape d’hydroboration-oxydation dans l’Org 1, il y a de nombreuses lunes, je ne m’attendais certainement pas à voir le même schéma réactionnel se répéter sous tant de formes différentes.
L’essentiel est qu’il y a beaucoup de réactions qui portent des noms différents mais qui procèdent du même processus mécanistique. Cela souligne l’importance d’apprendre les modèles clés de la chimie organique, parce qu’ils se répètent certainement beaucoup.
Note de fin. Concerté, pas séparé ?
Si le Curtius était par étapes, la perte d’azote conduirait à un nitrène. Les nitrènes subissent une foule de réactions intéressantes, comme l’insertion dans les liaisons C-H ( !). On peut donc concevoir une expérience pour tester cela : si l’on essaie le réarrangement de Curtius suivant, on pourrait chercher des preuves de la formation d’un cycle à cinq membres.
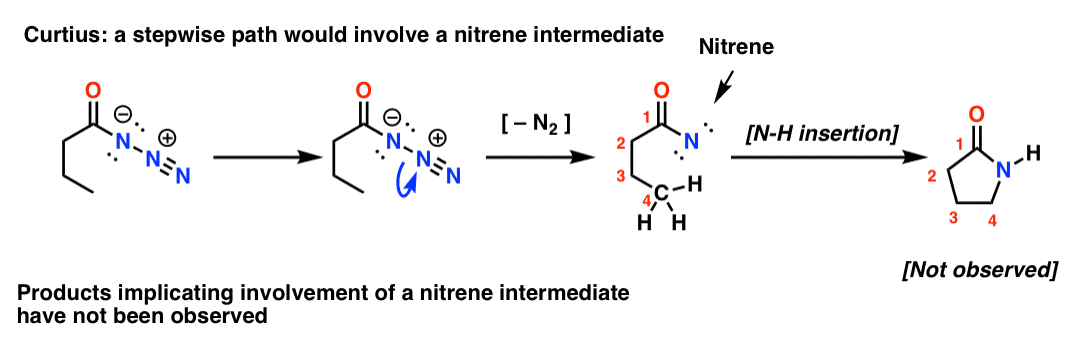
L’absence de tels produits, ainsi que d’autres preuves, indique un mécanisme concerté.
(Advanced) Références et lectures complémentaires
- Ueber die Einwirkung des Broms in alkalischer Lösung auf Amide
W. Hofmann
Chem. Ber. 1881, 14, 2725-2736
DOI : 10.1002/cber.188101402242
Article original d’A. W. Hofmann (qui était un chimiste très productif et dont le nom est attribué à de nombreuses autres transformations) sur la dégradation des amides en amines primaires. - Un réarrangement de Hofmann modifié doux et efficace
Xicai Huang, Mehran Seid, et Jeffrey W. Keillor
The Journal of Organic Chemistry 1997, 62 (21), 7495-7496
DOI:10.1021/jo9708553
Il s’agit d’un réarrangement de Hofmann modifié effectué dans le méthanol – dans ce cas, l’acide carbamique intermédiaire peut réagir avec le solvant méthanol pour produire des carbamates de méthyle avec un bon rendement. - Formation de carbamates de méthyle par des réarrangements de HOFMANN modifiés : METHYL N-(p-METHOXYPHENYL)CARBAMATE
Jeffrey W. Keillor et Xicai Huang
Org. Synth. 2002, 78, 234
DOI : 10.15227/orgsyn.078.0234
Une procédure fiable et testée indépendamment pour le réarrangement de Hofmann modifié dans la Réf #2. - La réaction de Hofmann
Wallis, Everett L. ; Lane, John F.
Org. React. 1946, 3, 267-306
DOI : 10.1002/0471264180.or003.07
Une revue ancienne mais complète (pour son époque) sur la réaction de Hofmann (la réaction amide à amine, à ne pas confondre avec ses autres réactions). - Notes – Un réexamen des limites de la réaction de Hofmann
Ernest Magnien et Richard Baltzly
The Journal of Organic Chemistry 1958, 23 (12), 2029-2032
DOI:10.1021/jo01106a630
C’est un article intéressant où les auteurs ont tenté d’étendre la portée du réarrangement de Hofmann au-delà de ce qui était décrit dans l’article original en ajustant soigneusement les conditions de réaction. - 20. Hydrazide und Azide organischer Säuren
Curtius, T. I. Abhandlung.
Journal Für Praktische Chemie, 50(1), 275-294. (1894).
DOI:1002/prac.18940500125 - Ueber Stickstoffwasserstoffsäure (Azoimid) N3H.
Curtius, T.
Berichte Der Deutschen Chemischen Gesellschaft, 23(2), 3023-3033.(1890).
DOI:1002/cber.189002302232
Premiers articles de Theodore Curtius décrivant la réactivité des hyrazides d’acyle et des azides d’acyle. - La réaction de Curtius
Smith, P. A. S.
Org. React. 1946, 3, 336
DOI : 10.1002/0471264180.or003.09
Une revue ancienne mais complète de la réaction de Curtius, qui comprend l’histoire de la découverte de ce réarrangement, la portée du substrat, les limites, la comparaison avec d’autres réactions similaires et les procédures expérimentales. - ISOCYANATE D’UNDECYLE
F. H. Allen et Alan Bell
Org. Synth. 1944, 24, 94
DOI : 10.15227/orgsyn.024.0094
Une procédure ancienne mais reproductible et testée pour synthétiser des isocyanates par le réarrangement de Curtius. - Synthèse totale sans groupe protecteur de la (±)-Dievodiamine
William P. Unsworth, Christiana Kitsiou, et Richard J. K. Taylor
Organic Letters 2013 15 (13), 3302-3305
DOI:1021/ol4013469
La première étape de cette synthèse totale utilise un réarrangement de Curtius pour effectuer une cyclisation intramoléculaire de l’acide carboxylique substitué par l’indole. - Méthodes et réactions de synthèse. 121. Préparation catalysée par l’iodure de zinc d’azides d’aroyle à partir de chlorures d’aroyle et d’azide de triméthylsilyle
K. Surya Prakash, Pradeep S. Iyer, Massoud Arvanaghi, et George A. Olah
The Journal of Organic Chemistry 1983 48 (19), 3358-3359
DOI : 10.1021/jo00167a051
Une procédure pratique pour la préparation d’azides d’aryle aromatiques du professeur George A. Olah, lauréat du prix Nobel. Ceux-ci peuvent ensuite être utilisés pour les réarrangements de Curtius.